青蒿素抑制星形膠質細胞炎癥通路的分子機制研究
張書滔 童宇 郭小嵐 陳俊希 許光亞 唐勇 鄭露露 時政
摘要:目的 分別以P2X7、外泌體以及瞬時受體電位香草酸亞型1(TRPV1)為作用靶點,研究青蒿素(ART)抑制星形膠質細胞炎癥通路的分子機制。方法 培養小鼠原代星形膠質細胞,利用膠質纖維酸性蛋白(GFAP)免疫熒光鑒定原代星形膠質細胞的純度;MTT法檢測ART對細胞活性的影響;脂多糖(LPS)處理原代星形膠質細胞,構建細胞炎癥模型;分為空白對照組,ART組,外泌體抑制劑組,P2X7受體抑制劑組,TRPV1受體抑制劑組,TRPV1受體激動劑組,通過ELISA法和吸光光度法檢測細胞上清液中炎癥因子的含量(TNF-α、IL-1β、IL-6及NO)。結果 GFAP陽性細胞數達95%表明成功分離培養小鼠原代星形膠質細胞;300 ng/mL的LPS處理12 h是刺激星形膠質細胞構建炎癥模型的最佳濃度和時間;10 μmol/mL的ART處理12 h 可以達到最佳的抗炎效果,并且當濃度小于20 μmol/mL時,對細胞活性基本無影響;抑制P2X7受體的表達和外泌體的釋放均能降低細胞中炎癥因子TNF-α的含量,但不能與ART產生協同降低的效果;抑制TRPV1受體增加了細胞中的TNF-α、IL-1β、IL-6以及NO表達,激活TRPV1受體可降低TNF-α、IL-1β、IL-6以及NO表達,并且ART與TRPV1受體激動劑合用時,能協同降低炎性因子表達。結論 青蒿素除了已知的通路發揮其抗炎作用之外,還有可能通過TRPV1通路發揮其抗炎作用。本研究為青蒿素發揮抗炎作用的分子機制提供了新的方向。
關鍵詞:神經炎癥;青蒿素;星形膠質細胞;P2X7;外泌體;TRPV1
中圖分類號:R285.5文獻標志碼:A
The preliminary molecular mechanism study of artemisinin inhibit astrocytes inflammatory pathway
Zhang Shutao1, Tong Yu1, Guo Xiaolan1,Chen Junxi1, Xu Guangya2, Tang Yong3, Zheng Lulu4, and Shi Zheng1
(1 School of Clinical Medicine, Affiliated Hospital of Chengdu University, Chengdu 610106; 2 School of Basic Medicine of Chengdu University, Chengdu 610106; 3 School of Health and Rehabilitation of Chengdu University of Traditional Chinese Medicine, Chengdu 610075; 4 College of Food and Bioengineering of Chengdu University, Chengdu 610106)
Abstract Objective To investigate the molecular mechanism of artemisinin (ART) inhibiting the inflammation pathway of astrocytes by targeting P2X7, exosomes and transient receptor potential vanilic acid subtype 1 (TRPV1). Methods Mouse primary astrocytes were cultured, and the purity of primary astrocytes was determined by GFAP immunofluorescence. The effect of ART on cell activity was detected by MTT assay. Primary astrocytes were treated with lipopolysaccharide (LPS) to construct a cellular inflammation model. They were divided into blank control group, ART group, exosome inhibitor group, P2X7 receptor inhibitor group, TRPV1 receptor inhibitor group and TRPV1 receptor agonist group. The contents of inflammatory factors (TNF-α, IL-1β, IL-6 and NO) in cell supernatant were detected by ELISA and absorbance spectrophotometry, then determine the best anti-inflammatory effect of each group. Results The number of GFAP positive cells was 95%, indicating that the primary mouse astrocytes were successfully isolated and cultured 300 ng/mL LPS treatment for 12 h was the best concentration and time to stimulate astrocytes to construct the inflammatory model.10 μmol/mL ART for 12 h can achieve the best anti-inflammatory effect, and when the concentration is less than 20 μmol/mL, there is no effect on the cell activity. Inhibition of P2X7 receptor expression and release of exosomes can decrease the content of inflammatory cytokine TNF-α in cells, but cannot produce synergistic effect with ART. Inhibitor of TRPV1 receptor increased the expression of TNF-α, IL-1β, IL-6 and NO in cells, and activation of TRPV1 receptor could decrease the expression of TNF-α, IL-1β, IL-6 and NO. ART combined with TRPV1 receptor agonist could cooperatively reduce the expression of inflammatory factors. Conclusion Artemisinin may exert its anti-inflammatory effect through TRPV1 pathway besides known pathways. This study provides a new direction for the molecular mechanism of artemisinin's anti-inflammatory effect.
Key words Neuroinflammation; Artemisinin; Astrocytes; P2X7; Exosomes; TRPV1
神經炎癥是由中樞神經系統(CNS)中的固有的免疫細胞(小膠質細胞和星形膠質細胞)激活的免疫應答[1]。通常,在CNS損傷、感染、毒素的刺激下或在自身免疫的作用下會出現神經炎癥。神經炎癥與中樞神經系統疾病的發生發展有著密切的聯系,如:阿爾茨海默病、帕金森病、肌萎縮性脊髓側索硬化癥和多發性硬化等神經退行性疾病[2]。星形膠質細胞是哺乳動物大腦中含量最多的神經膠質細胞,其除了傳統的對神經元起支持作用和血腦屏障成分外,還參與調節局部血流量、腦代謝、離子穩態和氧化應激等過程[3]。星形膠質細胞在受到損傷后,形態與功能發生變化形成反應性星形膠質細胞,其不僅產生促炎細胞因子,如TNF-α、IL-1β和IFN-γ,同時增加活性氧(ROS)的產生,加重炎癥反應過程,導致神經退化甚至凋亡壞死,從而啟動和促進炎癥反應[4]。因此,星形膠質細胞是神經免疫系統中重要的靶細胞。
青蒿素(ART)是從復合花序植物黃花蒿莖葉中提取的有過氧基團的倍半萜內酯的一種無色針狀晶體,經化學改造后可生產多種不同的衍生物[5],如雙氫青蒿素、青蒿琥酯、SM905和SM933等。青蒿素及其衍生物除了具有抗瘧作用外,還具有強效的抗炎、抗真菌、抗腫瘤和免疫調節等廣泛的藥理學活性[6]。值得注意的是, 越來越多的證據表明,ART可以作為治療炎癥藥物, 通過作用于炎癥過程治療中樞神經系統(CNS)疾病。研究表明ART可以在小膠質細胞中通過減少炎癥介質的產生,增加IκB-α的表達,從而阻斷NF-κB轉移到細胞核上,進而抑制脂多糖(LPS)誘導的炎癥反應[7]。雙氫青蒿素通過調節PI3K/AKT的磷酸化和下調炎癥因子IL-1β和IL-6明顯減輕了LPS誘導的抑郁樣行為和認知功能障礙[8]。
瞬時受體電位香草酸亞型1(TRPV1)作為配體門控的非選擇性陽離子通道,是瞬時受體點位(TRP)蛋白中最具特征的成員。越來越多的證據表明,TRPV1與免疫反應密切相關,被認為是大多數癲癇發作和神經退行性疾病的神經炎癥中的分子開關[9]。其廣泛分布于哺乳動物的感覺神經纖維中,在非神經細胞如膠質細胞、單核細胞中也存在[10],與神經源性疼痛和炎癥的發生密切相關,可以被多種神經炎癥介質如緩激肽、前列腺素、ATP、神經生長因子(NGF)等直接或間接激活,釋放P物質、CGRP等多種神經肽類物質,參與TNF-α的致炎過程、誘導神經源性炎癥等病理過程[11]。P2X受體是一種非選擇性的ATP門控陽離子通道,其被激活后,使細胞膜對陽離子更加通透,引起質膜去極化,從而導致了一系列的生理或病理變化。近年來,P2X7受體在神經炎癥的形成與進展調控作用備受關注。王玨等[12]通過小鼠實驗證明,在炎癥等病理情況下,局部細胞可釋放大量ATP和降解產物,這些物質濃度的升高可達到激活小膠質細胞的水平,其中BV-2(小鼠小膠質細胞)細胞的P2X7的表達升高最為強烈,小膠質細胞再進一步釋放促炎因子加重神經系統的損傷,通過基因層面降低P2X7的過表達可能有效抑制神經性炎癥反應。同時,TRPV1與P2X受體兩者之間存在一定的聯系,背根神經節(DRG)的衛星膠質細胞中的P2X7受體參與了TRPV1介導的糖尿病神經病理痛(DNP)的過程,并且涉及炎癥反應,由p38和ERK信號通路介導[13]。外泌體(exosome)是細胞外囊泡的一個亞組,大小從30到100 nm不等,由不同的細胞類型釋放[14]。研究表明星形膠質細胞釋放的外泌體可以將錯誤折疊的病原蛋白和/或異常表達的miRNA轉運到神經元中,然后作用引發或傳播神經炎癥[15],且星形膠質細胞外泌體能夠干預JAK2/STAT3通路從而抑制小膠質細胞介導的炎癥反應和凋亡途徑,來緩解癲癇大鼠小膠質細胞活化介導的神經炎性損傷及凋亡,發揮神經系統的保護作用[16]。綜上所述,P2X7、TRPV1和外泌體均參與了星形膠質細胞介導的神經炎癥反應,但青蒿素是否通過這3個受體發揮抗中樞炎癥的機制尚不清楚。
因此,本文擬通過原代星形膠質細胞的培養及鑒定、炎癥模型的建立、青蒿素抗炎作用濃度時間的考察以及P2X7、外泌體和TRPV1對青蒿素抗炎作用的影響,從而研究P2X7、TRPV1和外泌體在青蒿素抑制LPS刺激原代星形膠質細胞炎癥方面的作用,為青蒿素的在抗炎作用的分子機制提供更多實驗證據。
1 材料與方法
1.1 實驗動物
選用出生24~48 h的昆明新生小鼠,母體生殖期間均自由進食飲水,環境溫度和濕度分別維持在25 ℃和60%左右,自然節律光照。本實驗規程及方案符合成都大學動物倫理審查標準。
1.2 試劑和耗材
基礎高糖培養基、胎牛血清、雙抗青霉素-鏈霉素(美國Hyclone公司);牛血清白蛋白、Triton X-100、A438079(P2X7受體拮抗劑)、GW4869(外泌體抑制劑)(美國Sigma-Aldrich公司);Capsaicin(辣椒素,TRPV1受體激動劑)、Capsazepine(辣椒平,競爭性TRPV1受體拮抗劑)(英國Tocris Bioscience公司);Mouse TNF-α ELISA Kit、Mouse IL-6 ELISA(北京四正柏生物科技有限公司)、Mouse IL-1β ELISA Kit(杭州聯科生物技術股份有限公司)、一氧化氮(NO)測定試劑盒(酶法)(南京建成生物工程研究所);青蒿素(批號:A0114,成都曼思特生物科技有限公司)。
1.3 小鼠原代星形膠質細胞的培養
取出生24~48 h的新生乳鼠的全腦,剝離整個腦組織,將腦組織完整取出于解剖顯微鏡下小心剝離腦膜和血管,并使用4 ℃預冷的磷酸鹽緩沖液清洗后將組織剪碎成糜狀的組織塊,加入1 mL 0.25%胰蛋白酶,在37 ℃的細胞培養箱中消化30 min后,取等量含10%胎牛血清的培養基終止消化。離心(15 min, 1000 r/min, 4 ℃),棄上清液,加入適量10%胎牛血清和1%雙抗的DMEM培養基輕柔緩慢吹打細胞,制備單細胞懸液接種于6孔培養板。培養第2天放置于恒溫搖床中200 r/min震搖2 h。
1.4 鼠原代星形膠質細胞的鑒定
待細胞處于對數生長期時,取出爬片,先加入磷酸緩沖液清洗3次,每次5 min,隨后加入4%的多聚甲醛固定液,固定15 min。固定結束后,用磷酸緩沖液清洗3次,清洗時間依次為10、5和5 min。用5% BSA+ 0.3% Triton X-100于37 ℃孵箱中孵育1 h。吸走封閉液,加入一抗,4 ℃過夜結束后,在避光環境中,用磷酸緩沖液清洗3次,每次10 min,清洗好后,加入二抗,37 ℃孵箱孵育1 h。磷酸緩沖液清洗3次,每次10 min,加入15 μL的4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole, DAPI),室溫避光靜置5 min,磷酸緩沖液漂洗5 min,吸干液體,再加入10 μL防淬滅劑,防止熒光劑的淬滅,置熒光顯微鏡下觀察。
1.5 LPS炎癥細胞模型的建立
將對數生長期的小鼠星形膠質細胞以1×105個的密度接種于96孔板中,在培養箱培養24 h,待細胞貼壁形態正常后,分為對照組、LPS不同濃度組(100、200、300、600和1000 ng/mL的LPS處理12 h)、LPS時間干預組(300 ng/mL的LPS處理0、3、6、12和24 h)。采用酶聯免疫吸附法檢測細胞上清液中TNF-α水平。
1.6 青蒿素對LPS誘導的炎癥細胞活性的影響
將對數生長期的小鼠星形膠質細胞以1×105個的密度接種于96孔板中,待細胞貼壁形態正常后,分為調零組(無細胞,僅加培養基)、空白對照組(有細胞,有培養基,不加藥)、生理狀態ART組(ART濃度分別為5、10、20、40、80 μmol/mL)、病理狀態ART組,邊緣孔以磷酸緩沖液填充,作用12 h,每組設置6個復孔。12 h后,去除培養基,每孔加入100 μL 5 ng/mL的MTT,放置培養箱孵育2 h后,吸出MTT 溶液,每孔加入100 μL DMSO,然后使用酶標儀檢測490 nm波長處吸光度值。細胞存活率(%)=(A實驗組-
A調零組)/ (A對照組-A調零組)×100%。
1.7 青蒿素抗炎作用濃度和時間的考察
實驗分為空白對照組、DMSO組、模型組(300 ng/mL的LPS)、ART不同濃度組(5、7、9、10、20、40和80 μmol/mL的ART處理12 h)、ART不同時間組(10 μmol/mL的ART分別處理0、3、6、12和24 h),每組設置6個復孔。采用酶聯免疫吸附法檢測細胞上清液中TNF-α水平,考察ART最佳的抗炎作用濃度和時間。
1.8 青蒿素對外泌體、P2X7以及TRPV1受體的影響
實驗分為空白對照組、DMSO組、模型組
(300 ng/mL的LPS)、治療組(LPS+DMSO;LPS+
10 μmol/mL ART;LPS+10 μmol/mL GW4869(外泌體抑制劑);LPS+10 μmol/mL ART+10 μmol/mL GW4869;LPS+10 μmol/mL A438079(P2X7抑制劑);LPS+10 μmol/mL ART+10 μmol/mL A438079;LPS+10 μmol/mL Capsazepine(辣椒平,競爭性TRPV1拮抗劑);LPS+10 μmol/mL ART+10 μmol/mL
Capsazepine)。采用酶聯免疫吸附法檢測細胞上清液中TNF-α水平,考察ART對外泌體、P2X7以及TRPV1受體的作用。
1.9 青蒿素對TRPV1受體的影響
將對數生長期的小鼠星形膠質細胞以1×105個/孔的密度接種于96孔板中,待細胞貼壁形態正常后,分為空白對照組、DMSO組、模型組(300 ng/mL的LPS)、空白藥物組(10 μmol/mL的capsaicin(辣椒素,TRPV1受體激動劑);10 μmol/mL (capsazepine)、治療組(LPS+DMSO;LPS+10 μmol/mL ART;
LPS+10 μmol/mL capsazepine;LPS+10 μmol/mL
ART+10 μmol/mL capsazepine;LPS+10 μmol/mL
capsaicin;LPS+10 μmol/mL ART+10 μmol/mL capsaicin)。采用酶聯免疫吸附法檢測細胞上清液中TNF-α、IL-6和IL-1β水平。由于NO的化學性質相當的活潑,它在體內代謝會轉化成為亞硝酸鹽(NO2﹣)和硝酸鹽(NO3﹣),而亞硝酸鹽又會進一步被轉化成為硝酸鹽,因此,本實驗是利用硝酸還原酶將硝酸鹽特異性地還原成為亞硝酸鹽,然后再通過顯色深淺從而測定細胞上清液中濃度的高低:NO含量=(測定A值-空白A值)/(標準A值-空白A值)×標準品濃度(100 μmol/mL)。
1.10 統計學處理
數據用均值±標準差(x±s)表示,當P<0.05時,認為數據有統計學意義。在多組組間的比較采用的是單因素方差分析(one-way Anova);在組內兩兩比較采用的是配對檢驗,整個數據采用GraphPad Prism7作圖統計分析。
2 結果
2.1 小鼠原代星形膠質細胞的鑒定結果
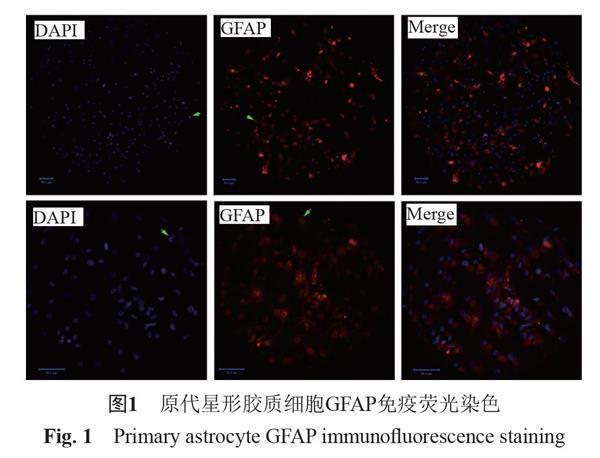
采用GFAP免疫熒光對原代培養的小鼠細胞進行染色,結果如圖1,培養的星形膠質細胞胞漿和突起被染成紅色,隨機選擇5個位置計數,計算GFAP染色和DAPI染色的比例的平均值,計算出GFAP陽性細胞數達95%,可用于后續實驗。
2.2 LPS炎癥細胞模型的建立
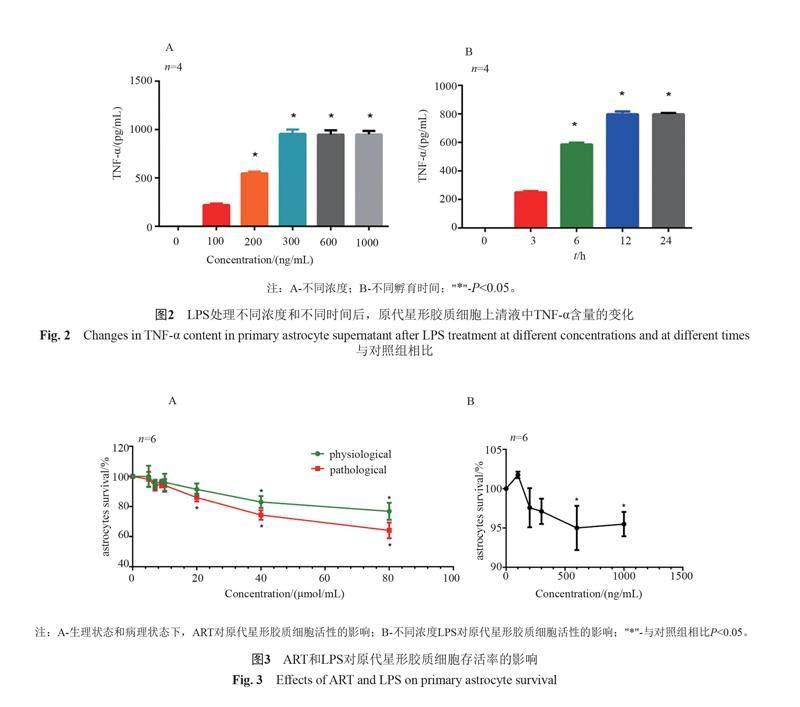
通過檢測細胞培養上清液中炎癥因子TNF-α的水平探討LPS炎癥細胞模型的最佳構建條件。結果如圖2,300 ng/mL的LPS處理12 h時,TNF-α濃度最高,繼續增加LPS濃度和作用時間,TNF-α的濃度不能顯著升高。故用300 ng/mL的LPS處理12 h是刺激星形膠質細胞構建炎癥模型的最佳濃度和時間。
2.3 青蒿素對細胞活性的影響
MTT實驗的結果如圖3,當ART濃度為5 μmol/mL和10 μmol/mL時,對生理狀態和病理狀態的原代星形膠質細胞的活性并無顯著影響,但當繼續增加ART濃度時20 μmol/mL時,開始抑制原代星形膠質細胞的活性。
2.4 青蒿素抗炎的最佳濃度和時間
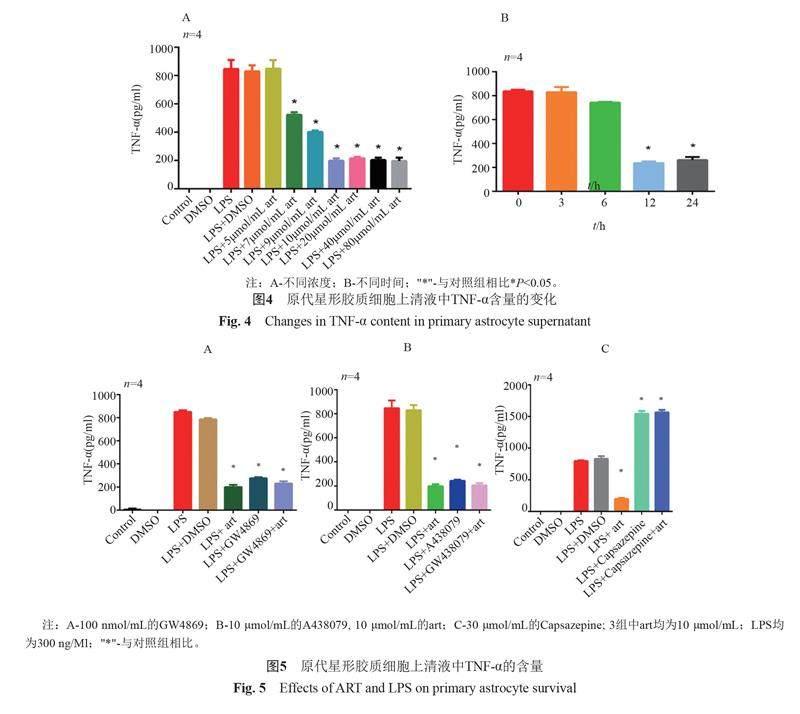
ART濃度為7 μmol/mL時表現出抗炎活性,在濃度為10 μmol/mL處理12 h時發揮出最好抗炎效應,然而繼續增加ART的濃度和作用時間,抗炎效應不能持續增長。因此,10 μmol/mL ART干預12 h為抑制LPS刺激的原代星形膠質細胞分泌TNF-α濃度的最佳濃度和時間(圖4)。
2.5 青蒿素對外泌體、P2X7以及TRPV1受體的影響結果
分別用ART、A438079(P2X7抑制劑)和GW4869(外泌體抑制劑)均能降低細胞上清液中TNF-α的濃度,但是ART分別與A438079和GW4869合用時并未協同降低TNF-α的濃度(圖5A、B)。由此推測出ART的抗炎作用靶點不是P2X7受體和外泌體。單獨使用ART時,可以降低TNF-α的濃度,而單獨使用capsazepine會升高細胞上清中TNF-α的濃度,合并使用ART和capsazepine時,青蒿素并未發揮出抑制TNF-α濃度的能力,推測ART發揮抑制TNF-α濃度的作用可能是通過TRPV1受體,因TRPV1受體被抑制,從而不能發揮出ART對TNF-α的抑制作用(圖5)。
2.6 青蒿素對TRPV1受體的影響結果
在LPS誘導的星形膠質細胞炎癥模型中,單獨使用ART和capsaicin均能降低細胞上清液中TNF-α、IL-1β、IL-6以及NO的濃度,而capsazepine卻升高了星形膠質細胞上清液中TNF-α、IL-1β、IL-6以及NO的濃度。以上研究表明,ART與capsaicin都能抑制LPS致炎的星形膠質細胞炎癥,而capsazepine不能抑制,當ART和capsaicin以及capsazepine聯合使用去干預LPS致炎的星形膠質細胞時。有趣的是,ART無法降低capsazepine組的炎癥因子。結果說明:ART可能通過激活TRPV1受體,引起細胞釋放多種神經肽,從而發揮抗炎作用(圖6)。
3 討論
神經炎癥是各種神經系統疾病(包括神經退行性疾病和中樞神經系統損傷)的關鍵因素[17]。在本研究中發現ART的確具有良好的抗炎活性,并且通過激動TRPV1受體,抑制星形膠質細胞中促炎因子:TNF-α、IL-1β、IL-6以及NO的釋放,從而發揮其抗炎作用,本研究為青蒿素發揮抗炎作用的分子機制提供了新的方向。
盡管ART在多種信號轉導過程的調節中發揮著不同的作用[18-19],但迄今為止,這些途徑中的分子機制仍然需要進一步研究。Kim等[20]通過體外實驗中發現,盡管ART干預對淀粉樣β(Aβ)纖維的形成沒有影響,但ART確實可以減輕APPSWE/PS1dE9轉基因小鼠神經炎癥負擔[21]。另外,ART可以通過抑制NF-κB核易位和細胞溶質固有免疫信號受體NOD-和LRR-結構域從而抑制β-分泌酶切割淀粉樣蛋白前體蛋白(APP)和炎癥反應,發揮治療阿爾茲海默癥的作用[22]。
ART及其衍生物除了減輕中樞神經系統的炎癥反應外,還可有效治療全身炎癥病[23-24]。因此,ART可以是開發阿爾茲海默和其他神經退行性疾病治療或預防策略的潛在候選藥物。
P2X7受體與其余嘌呤信號受體P2X受體具有不同的藥理學特性[25]。P2X7受體在組織損傷、感染或在腫瘤微環境等伴隨炎癥的條件下可被激活,實際上,P2X7受體長期激活后,可形成允許分子量大于900 Da的親水性物質通過的孔道,這種孔道的形成可導致炎性小體的激活[26]。炎性小體主要是通過裂解方式使蛋白酶,caspase-1,前體白細胞介素分子形成IL-1β和IL-18,隨后釋放到胞外產生炎癥[27]。研究表明,P2X7受體在多種炎性病理狀態下表達上調,并可影響炎性介質的表達和釋放,參與炎性反應和免疫反應,誘導細胞損傷甚至凋亡等過程。本課題證實了P2X7抑制劑確實可以通過抑制P2X7受體,從而降低LPS致炎的原代星形膠質細胞上清液中TNF-α的濃度,能夠在一定程度上減輕炎癥反應,但是,P2X7受體抑制劑并不能和ART一起協同作用降低原代星形膠質細胞上清液中TNF-α的水平。
外泌體和炎癥之間也有緊密的聯系,不同類型的免疫細胞在識別外來刺激后,會分泌出發生改變的外泌體[28]。當受到LPS刺激時,巨噬細胞分泌的外泌體水平增加,蛋白質含量增加,并可誘導巨噬細胞中TNF-α和IL-6的產生[29]。另一方面,免疫細胞也可以作外泌體的受體細胞,觸發炎癥反應。有研究證明急性結腸炎小鼠的血清中的外泌體,可以上調MAPK信號轉導和釋放TNF-α[30],促進炎癥的發生和發展。因此,可以得出結論,免疫細胞主動分泌的外泌體也在炎癥過程的調節中發揮重要作用。本實驗也證實了可以通過抑制外泌體的釋放從降低了而LPS致炎的原代星形膠質細胞上清液中TNF-α的水平,但是在外泌體抑制劑和ART共同作用的分組中,并沒有體現出協同作用。從本實驗中發現ART并沒有通過抑制外泌體的釋放從而發揮抗炎作用。
TRPV1可能通過調節膠質細胞的活性來調節神經炎癥。在碘乙酸鈉誘導的炎性痛大鼠模型中,TRPV1拮抗劑可有效抑制誘發痛及自發痛,且TRPV1抑制劑可降低腦組織等部位中SP、CGRP等神經肽的表達,從而減輕神經源性炎癥程度[31]。但是,其對星形膠質細胞中的影響的研究還較少。在經過前期對外泌體、P2X7受體的研究后,進行了TRPV1受體在ART抑制LPS介導的原代星形膠質細胞炎癥中的作用,然而體外培養的原代星形膠質細胞得到的卻是不一樣的結果:TRPV1抑制劑capsazepine不能夠降低體外培養的原代星形膠質細胞上清液中的TNF-α、IL-1β、IL-6和NO的水平,且capsazepine和LPS升高的炎性因子水平無法被ART所降低,而TRPV1激動劑Capsaicin反而能夠和ART一起協同降低LPS致炎的體外培養的原代星形膠質細胞上清液中的炎性因子水平。這表明,capsaicin、capsazepine和ART與TRPV1受體之間的關系并不那么簡單,三者之間相互作用關系還值得更深入的研究。免疫系統和神經系統之間的相互作用與小膠質細胞和星形膠質細胞中促炎性細胞因子的產生有關,這些細胞因子構成中樞神經系統炎癥介質的主要來源[32]。由此可見,ART除了已知的通過NF-κB發揮其抗炎作用之外,可能激動TRPV1受體發揮抗炎作用。本研究為ART發揮抗炎作用的分子機制提供了新的方向。
參 考 文 獻
Subhramanyam C S, Wang C, Hu Q, et al. Microglia-mediated neuroinflammation in neurodegenerative diseases[J]. Semin Cell Dev Biol, 2019, 94: 112-120.
Gogoleva V S, Drutskaya M S, Atretkhany K S. The role of microglia in the homeostasis of the central nervous system and neuroinflammation[J]. Mol Biol (Mosk), 2019, 53(5): 790-798.
Michinaga S, Koyama Y. Dual roles of astrocyte-derived factors in regulation of blood-brain barrier function after brain damage[J]. Int J Mol Sci, 2019, 20(3): 571.
Linnerbauer M, Wheeler M A, Quintana F J. Astrocyte crosstalk in CNS inflammation[J]. Neuron, 2020, 108(4): 608-622.
Sun X, Yan P, Zou C, et al. Targeting autophagy enhances the anticancer effect of artemisinin and its derivatives[J]. Med Res Rev, 2019, 39(6): 2172-2193.
Wang Y, Wang Y, You F, et al. Novel use for old drugs: The emerging role of artemisinin and its derivatives in fibrosis[J]. Pharmacol Res, 2020, 157: 104829.
Zhu C, Xiong Z, Chen X, et al. Artemisinin attenuates lipopolysaccharide-stimulated proinflammatory responses by inhibiting NF-kappaB pathway in microglia cells[J]. PLoS One, 2012, 7(4): e35125.
Gao Y, Cui M, Zhong S, et al. Dihydroartemisinin ameliorates LPS-induced neuroinflammation by inhibiting the PI3K/AKT pathway[J]. Metab Brain Dis, 2020, 35(4): 661-672.
Kong W L, Peng Y Y, Peng B W. Modulation of neuroinflammation: Role and therapeutic potential of TRPV1 in the neuro-immune axis[J]. Brain Behav Immun, 2017, 64: 354-366.
劉夏陽, 李壯, 周欣悅, 等. TRPV1的生物學功能研究進展[J/OL]. 生物化學與生物物理進展, doi:10.16476/j.pibb.2022.0127.
李魁君, 李春剛, 劉興君. 辣椒素受體(TRPV1)的生物學作用及其作為藥物靶點的研究進展[J]. 沈陽藥科大學學報, 2011, 28(11): 917-927.
王玨, 唐亞梅, 周俊宜. 過表達P2x7受體引發小膠質細胞的炎癥反應[J]. 熱帶醫學雜志, 2012, 12(3): 251-253.
王安慧. 嘌呤能2X7受體在背根神經節TRPV1介導大鼠糖尿病神經病理痛中的作用研究[D]. 南昌: 南昌大學, 2021.
Schneider A, Simons M. Exosomes: vesicular carriers for intercellular communication in neurodegenerative disorders[J]. Cell Tissue Res, 2013, 352(1): 33-47.
Pascual M, Ibá?ez F, Guerri C. Exosomes as mediators of neuron-glia communication in neuroinflammation[J]. NRR, 2020, 15(5): 796-801.
陳菲, 陳霞, 黃財城. 星形膠質細胞外泌體對癲癇大鼠小膠質細胞活化及JAK2/STAT3通路的影響[J]. 卒中與神經疾病, 2022, 29(3): 267-273.
Yang Q Q, Zhou J W. Neuroinflammation in the central nervous system: Symphony of glial cells[J]. Glia, 2019, 67(6): 1017-1035.
Crespo-Ortiz M P, Wei M Q. Antitumor activity of artemisinin and its derivatives: From a well-known antimalarial agent to a potential anticancer drug[J]. J Biomed Biotechnol, 2012: 247597.
Tu Y. Artemisinin-A gift from traditional Chinese Medicine to the world (Nobel Lecture)[J]. Angew Chem Int Ed Engl, 2016, 55(35): 10210-10226.
Kim H, Park B S, Lee K G, et al. Effects of naturally occurring compounds on fibril formation and oxidative stress of beta-amyloid [J]. J Agric Food Chem, 2005, 53(22): 8537-8541.
Shi J Q, Zhang C C, Sun X L, et al. Antimalarial drug artemisinin extenuates amyloidogenesis and neuroinflammation in APPswe/PS1dE9 transgenic mice via inhibition of nuclear factor-kappaB and NLRP3 inflammasome activation J]. CNS Neurosci Ther, 2013, 19(4): 262-268.
Zhang X, Song W. The role of APP and BACE1 trafficking in APP processing and amyloid-beta generation[J]. Alzheimers Res Ther, 2013, 5(5): 46.
Shakir L, Hussain M, Javeed A, et al. Artemisinins and immune system[J]. Eur J Pharmacol, 2011, 668(1-2): 6-14.
Shi C, Li H, Yang Y, et al. Anti-inflammatory and immunoregulatory functions of artemisinin and its derivatives[J]. Mediators Inflamm, 2015: 435713.
Jindrichova M, Zemkova H. Purinergic P2X family and specific features of the P2X7 subtype[J]. Cesk Fysiol, 2013, 62(2): 40-46.
Monif M, Reid C A, Powell K L, et al. The P2X7 receptor drives microglial activation and proliferation: A trophic role for P2X7R pore[J]. J Neurosci, 2009, 29(12): 3781-3791.
Watanabe H, Gaide O, Pétrilli V, et al. Activation of the IL-1beta-processing inflammasome is involved in contact hypersensitivity[J]. J Invest Dermatol, 2007, 127(8): 1956-1963.
Caradec J, Kharmate G, Hosseini-Beheshti E, et al. Reproducibility and efficiency of serum-derived exosome extraction methods[J]. Clin Biochem, 2014, 47(13-14): 1286-1292.
Skokos D, Botros H G, Demeure C, et al. Mast cell-derived exosomes induce phenotypic and functional maturation of dendritic cells and elicit specific immune responses in vivo[J]. J Immunol, 2003, 170(6): 3037-3045.
Fabbri M, Paone A, Calore F, et al. MicroRNAs bind to toll-like receptors to induce prometastatic inflammatory response[J]. Proc Natl Acad Sci U S A, 2012, 109(31): E2110-2116.
南麗婷, 吳丹, 李莎莎, 等. 碘乙酸鈉鼠爪炎性痛模型的建立及TRPV1介導的痛敏機制的研究[J]. 右江民族醫學院學報, 2022, 44(2): 205-210.
Skaper S D, Facci L. Mast cell-glia axis in neuroinflammation and therapeutic potential of the anandamide congener palmitoylethanolamide[J]. Philos Trans R Soc Lond B Biol Sci, 2012, 367(1607): 3312-3325.
收稿日期:2022-12-28
基金項目:成都大學臨床醫學院附屬醫院創新團隊項目(No. CDFYCX202208);四川省科技廳農業科技成果轉化資金項目(No. 2022NZZJ0015);四川省2021—2023年高等教育人才培養質量和教學改革項目(No. JG2021-1103);龍泉驛英才計劃C類創新人才計劃 (No. 90);成都大學附屬醫院院級課題(No. Y202232和No. Y202234)
作者簡介:張書滔,男,生于2000年,主要研究方向為神經疾病的中西醫康復治療,E-mail: Shutao0731@163.com
*通信作者,E-mail: drshiz1002@hotmail.com

