《β-內酰胺類抗菌藥物皮膚試驗指導原則(2021年版)》醫療機構執行情況調研分析
許譯尹?余霞霞?張學麗?邵華

摘要:目的 調研分析我國《β-內酰胺類抗菌藥物皮膚試驗指導原則(2021年版)》頒布后醫療機構執行情況,為推進該類藥物皮試規范管理提供參考。方法 設計問卷開展調查并運用Excel匯總整理,SPSS 26.0統計分析。調研覆蓋我國18個省(自治區、直轄市)共計143家醫療機構。問卷內容涵蓋醫院基本信息、院內皮試管理相關規定、β-內酰胺類藥物皮膚試驗方法等共計42個問題。結果 共收到有效反饋問卷143份。調研顯示大部分醫療機構已根據《指導原則》規范院內β-內酰胺類藥物皮膚試驗流程,在不同發文部門更新率、是否選擇皮試、皮試液來源及濃度、判讀標準等方面有顯著性差異。結論 各醫療機構對于《指導原則》執行情況良好,但仍存在固有觀念及流程難以轉變,實際操作缺乏統一管理標準等問題。我國皮試相關權威資料應統一修訂管理,各級醫療機構皮試規定有待進一步規范化與精細化,流程制定需藥學專業人員參與。
關鍵詞:β-內酰胺類抗菌藥物;皮膚試驗;問卷調查;分析研究
中圖分類號:R978.1文獻標志碼:A
Investigation and analysis of the implementation of the guidelines for skin testing of β-lactam antibiotics (2021 edition) in medical institutions
Xu Yiyin, Yu Xiaxia, Zhang Xueli, and Shao Hua
(Department of Pharmacy, Zhongda Hospital, Southeast University, Nanjing 210009)
Abstract Objective To investigate and analyze the implementation of the guidelines for skin testing of β-lactam antibiotics (2021 edition) in medical institutions in China to provide a reference for promoting the standardized management of skin testing of these drugs. Methods A questionnaire was designed to carry out surveys, and the results were summarized by Excel and analyzed by SPSS 26.0. The survey covered a total of 143 medical institutions in 18 provinces (autonomous regions and municipalities) in China. The questionnaire had a total of 42 questions, including basic hospital information, hospital skin test management regulations, and the method of skin testing for β-lactam drugs. Results A total of 143 valid feedback questionnaires were received. The investigation showed that most hospitals had standardized the procedures for skin tests of β-lactamides in hospitals according to the guidelines, and there were significant differences in the updating rate of different departments, the selection of skin tests, the source and concentration of skin test solutions, and the interpretation standard. Conclusion? The guidelines have been well implemented by medical institutions, but there are still some problems, such as the difficulty of changing the inherent concepts and procedures and the lack of unified management standards in practical operation. The provisions of skin tests in various medical institutions need to be further standardized and refined, and pharmaceutical professionals should be involved in the formulation of the process.
Key words β-lactam antibiotics; Skin tests; Questionnaire survey; Analysis study
β-內酰胺類藥物是目前臨床廣泛應用的一類抗菌藥物,其不良反應與嚴重不良反應報告數量在我國抗感染藥物排名中均居于首位[1]。過敏反應是β-內酰胺類藥物最常見的不良反應之一,有可能引發休克等嚴重后果,是限制臨床選用該類藥物的主要原因。因皮膚試驗(均指皮內試驗,以下簡稱皮試)對過敏反應具有一定預測作用,我國先后發布了多項β-內酰胺類抗菌藥物皮試相關規定,但文件之間意見不一,精細化程度不足,覆蓋區域、藥品種類不夠全面,企業制定的藥品說明書對于皮試規定部分尚有分歧,臨床實際操作中的皮試規范仍未統一。
鑒于全國皮試現狀,國家衛生健康委員會于2021年制定《β-內酰胺類抗菌藥物皮膚試驗指導原則(2021年版)》(以下簡稱《指導原則》),首次從國家層面規范醫療機構皮試管理全流程。該文件頒布后臨床β-內酰胺類抗菌藥物具體皮試操作未見相關研究報道,本文旨在調研全國各地區醫院對于最新皮試指導原則執行情況,以期為進一步規范β-內酰胺類抗菌藥物皮試流程提供參考。
1 對象與方法
1.1 調查對象
本研究充分考慮地區差異,采用多階段抽樣法,按照行政區域劃分為5個區域(東部、南部、西部、北部、中部),每個區域抽取代表性醫院,覆蓋省會/非省會城市的三級/二級醫院、教學/非教學醫院、地方醫院、部隊醫院等,納入醫院中所有符合條件、自愿參加調查的藥師,納入標準:從事臨床一線工作1年以上或對院內皮試規定較為了解的藥師。
1.2 調查方法
1.2.1 調查工具
采用《β-內酰胺類抗菌藥物皮試管理規定調研問卷》進行調查。該問卷基于《指導原則》及既往相關文件,由我院自行設計并經醫藥護相關專家討論審核后編制而成,由醫院基本情況、皮試管理規定、其他相關問題3部分,共計42個問題組成。
1.2.2 資料收集方法
通過網絡定向發放問卷,藥師掃描二維碼進行不記名填寫,同時在選中醫院中設置醫院負責人,動員、督導本醫院問卷發放和回收的情況。填寫時間為6周,共回收問卷180份,有效問卷143份,有效回收率79.5%。
1.2.3 統計與分析
將所有數據導入Excel軟件建立原始數據庫,并進行邏輯檢錯,剔除無效及重復問卷。因主要調查執行情況,因此新規后僅計入對于皮試規定有更新的醫院數,并排除“其他”項后導入SPSS 26.0軟件進行統計分析,采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
本次調查覆蓋安徽、北京、福建、廣東、廣西、貴州、河南、黑龍江、吉林、江蘇、江西、遼寧、寧夏、山東、上海、四川、浙江和重慶等18個省(自治區、直轄市)的143家醫院。
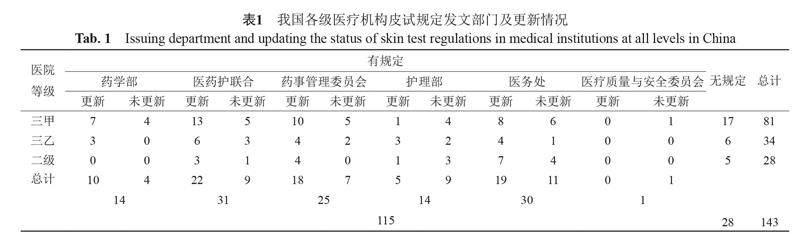
2.1 醫院皮試規定發文部門及更新情況現狀
本次調研顯示大部分醫院既往有皮試相關規定并已根據《指導原則》及時更新。其中發文部門含專業藥學人員(藥學部、醫藥護聯合、藥事管理委員會)的醫療機構皮試規定更新率最高,與護理部相比有統計學差異(χ2 =6.583,P=0.010),詳見表1。未更新理由主要包括:《指導原則》法律效應不如說明書、傳統觀念難以改變、藥品質量存疑及部分醫院正在籌備更新。
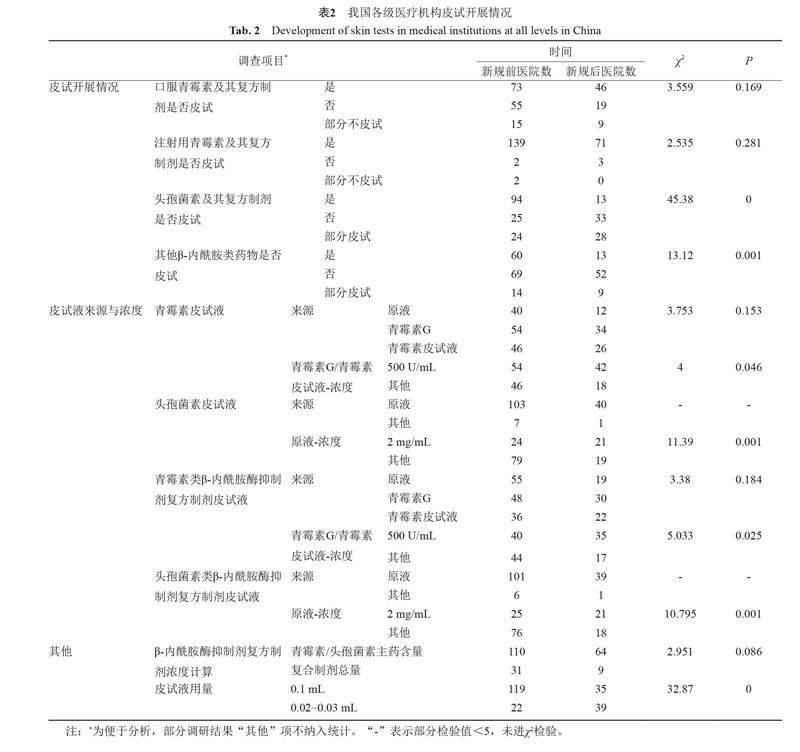
2.2 具體執行情況
《指導原則》提出不推薦在使用頭孢菌素及其他β-內酰胺類藥物前常規進行皮試,目前仍對其進行常規皮試的醫療機構數量顯著減少。大部分醫療機構已根據《指導原則》推薦濃度對院內青霉素類藥物(P=0.046)及其復方制劑(P=0.025)、頭孢菌素類藥物(P=0.001)及其復方制劑(P=0.001)的皮試液濃度進行規范,一半以上的醫療機構已調整皮試液用量為0.02~0.03mL(P=0),詳見表2。調研顯示醫療機構選擇皮試的頭孢菌素類藥物多為頭孢噻肟、頭孢替安、頭孢曲松、頭孢西丁、頭孢米諾及說明書中要求皮試品種。
2.3皮試結果判讀
《指導原則》規定皮試應設立陰性對照,比原皮丘增大超過3 mm者判斷為皮試陽性。本次調研顯示各級醫療機構皮試陽性判讀標準規范性有顯著提升(P=0.001),不進行皮試陰性對照的醫療機構(32.43%)較前有所下降,僅6家醫療機構將皮試結果交予變態反應學專家判讀,詳見表3。
2.4青霉素皮試陽性患者管理辦法
《指導原則》表明皮試結果除誘發嚴重過敏反應外,應記錄為“皮試陽性”,而非“過敏”。既往僅皮試陽性的患者,亦可在密切觀察基礎上重復皮試。目前青霉素與頭孢菌素之間的交叉過敏性較少見[2],因此不具有相互借鑒意義。調查結果顯示大部分醫療機構仍將陽性患者等同于過敏管理,且青霉素皮試陽性后,僅少部分醫療機構會選擇直接使用頭孢菌素,詳見表4。
3 討論
3.1 醫療機構皮試規定現狀
目前尚無《指導原則》更新后全國醫院關于β-內酰胺類抗菌藥物皮試情況相關調查,執行程度尚不明確,僅有研究也局限于既往省市[3]、院內[4]或部分β-內酰胺類抗菌藥物[5]。本研究顯示我國目前大部分醫療機構皮試操作規范性皆有提升,但實際操作中仍存在細節問題。
3.1.1 發文部門
本次調研發現有藥學部參與制定院內皮試規定的醫療機構及時更新率更高且操作規范更具體。已有研究表明藥師的參與可以促進抗菌藥物在預防和治療中的合理使用[6]。自《頭孢類抗菌藥物皮膚過敏試驗高端論壇專家共識(2008版)》發布以來,浙江、廣東、重慶等地在藥學專家的牽頭下陸續出臺β-內酰胺類藥物皮試相關規定[7-9]。綜上所述,規范皮試操作流程需要藥學專家參與。
3.1.2 皮試選擇
本次調研顯示目前頭孢菌素類藥物及其他β-內酰胺類藥物常規皮試率顯著降低,超過80%的醫療機構選擇不再對其進行常規皮試,但仍有一半以上的醫療機構(62.16%)常規開展口服青霉素類藥物皮試。無甄別的盲目皮試非但不能獲益,假陽性結果一經記錄即在患者醫療過程中持續存在,從而導致患者無法選用一線治療方案[10-11]。假陰性結果則容易使醫務人員放松警惕、疏于觀察,忽略皮試本身也可引起過敏性休克甚至死亡的風險[12],錯過最佳搶救時機[13]。不同于既往規定中“無論采用何種給藥途徑,使用青霉素抗菌藥物前必須先做青霉素皮試”[14],《指導原則》呼吁精準定位青霉素皮試適應證,從口服青霉素類藥物起,逐步取消常規青霉素皮試,同時首次明確規范了頭孢菌素類藥物及其他β-內酰胺類藥物皮試適應證。然而由于未具體規范口服青霉素藥物的皮試操作、說明書模糊用詞[15]、患者自身不愿意選擇皮試等多項因素,既往各醫院執行情況不佳,《指導原則》頒布后口服青霉素類藥物皮試院內規范并無較大變動。
3.1.3 具體皮試操作
《指導原則》規定β-內酰胺類抗菌藥物皮試液用量統一變更為0.02~0.03 mL,一半以上的醫療機構已作出調整(P=0),但仍有進一步改進空間。美國過敏哮喘免疫學會相關指南提示,對于常規注射器而言,小容量(<0.03 mL)難以正常輸注,臨床操作時需考慮注入皮內實際劑量出現誤差的可能性[16]。
3.1.4 皮試結果判讀及陽性患者管理
目前極少醫院(6.76%)常規開展皮膚陰性對照試驗,尚無醫院設置組胺陽性對照試驗且臨床觀察時間往往不一。各級醫療機構對于皮試陽性判讀標準仍存在分歧,甚至院內不同藥物判讀標準亦不相同。調研顯示,皮試結果判讀者多為當班護士(85.14%),僅少部分醫院(8.11%)交由變態反應學專家判讀, 其可靠性值得懷疑。研究表明過敏標簽與醫療相關感染增加有關,使用非β-內酰胺類藥物預防的患者手術切口感染幾率增加50%[17],同時可增加艱難梭菌、耐甲氧西林金黃色葡萄球菌(MRSA)、耐萬古霉素腸球菌(VRE)定植/感染幾率[18]。一項基于3萬名手術患者的真實世界研究表明,對于有過敏標簽患者,臨床醫生往往避免使用致敏藥物乃至所有β-內酰胺類藥物[19-20]。較前一致,本次調研發現一半以上的醫院(68.53%)將青霉素皮試陽性患者等同于青霉素過敏管理,僅有極少數醫院會選擇繼續直接使用頭孢菌素。大部分(83.92%)醫院往往會在嚴密監護下進行皮試后再行選擇,部分醫院(6.99%)甚至直接禁用頭孢菌素類藥物。《指導原則》指出患者皮試陽性不應等同于過敏,但對其管理方面無進一步具體規定。
3.2 建議
國外已通過實施抗菌藥物過敏測試-抗菌藥物管理計劃(AAT-AMS)取消抗菌藥物過敏標簽[21],并推薦對于皮試陽性患者進行分層管理、逐級脫敏[22-23],鼓勵藥師主動規范醫療機構抗菌藥物皮試操作流程[24-25]。因此應積極推進《指導原則》落地,及時更新院內規定;確切落實《指導原則》規范化措施,扭轉皮試固有觀念;將β-內酰胺類藥物皮試單純一刀切模式改為用藥前詳細詢問既往史、用藥后密切觀察患者反應、完善應急搶救措施等多方位監護;加強醫護人員皮試相關培訓,直至能準確進行皮試操作及結果判讀;逐步推廣生理鹽水陰性對照和組胺陽性對照,以提高預測準確率。同時督促生產企業對標國際標準,優化生產工藝、嚴格質檢,從根源上縮短國內外同品藥品的質量差距;強化企業責任意識,明晰說明書內皮試要求,避免出現“慎用”等模糊詞語,減少臨床實際操作中的困惑;鼓勵生產企業生產頭孢菌素類抗菌藥物專用皮試液,統一種類及濃度以減少人為因素導致的誤差。建議國家衛生主管部門對頭孢菌素類、其他β-內酰胺類抗菌藥物皮試操作規程及皮試陽性患者管理規范進行細化以便于實際操作;呼吁制定相關法律法規為醫生停止β-內酰胺類抗菌藥物常規皮試提供保障,肯定合規操作,規避行業風險;國家藥監部門需審查說明書內皮試標準及相關描述,及時修訂《中國藥典臨床用藥須知》等相關規定,保證權威資料內容一致,讓醫務人員有章可循,避免不必要的法律糾紛。
4總結
本次調研顯示《指導原則》對各醫療機構規范皮試管理有積極作用,但仍存在皮試適應證不一,皮試固有觀念及流程難以轉變,實際操作中皮試液種類、濃度、劑量選擇差異較大,皮試結果判讀不規范,皮試陽性患者缺乏統一管理標準等問題。β-內酰胺類抗菌藥物皮試管理受醫務人員觀念、行政法規、生產企業、群眾認知等諸多影響,實際操作涉及醫、藥、護多學科參與,亟須各方面共同努力。本次調研采用橫斷面研究,具有耗時短、成本低、覆蓋面廣等優點,及時反映《指導原則》頒布后我國醫療機構β-內酰胺類抗菌藥物皮試現狀,但也由于調查項目不夠全面、時間限制等問題造成調查結果相對滯后。因此可以本次調查為基礎,為皮試規定進一步精細化與規范化提供依據。
致謝: 感謝江蘇省醫學會臨床藥學分會各委員單位對本次調研工作的支持。
參 考 文 獻
國家藥品不良反應監測中心. 國家藥品不良反應監測報告(2021年)[R]. 2021.
Sousa-Pinto B, Blumenthal K G, Courtney L, et al. Assessment of the frequency of dual allergy to penicillins and cefazolin: A systematic review and meta-analysis[J]. JAMA Surg, 2021, 156(4): e210021.
何艷, 章登政, 付偉, 等. 湖北省內醫療機構β-內酰胺類抗菌藥物皮膚試驗現狀調查分析[J]. 中國醫院藥學雜志, 2020, 40(18): 1937-1941.
吳仲玉, 劉兆云. 我院頭孢菌素類抗菌藥物合理使用及皮試情況分析[J]. 中國醫藥科學, 2020, 10(16): 54-57.
陳相軍, 周益, 孟娟, 等. 醫療機構頭孢菌素類抗菌藥物皮試規范化管理[J]. 中國抗生素雜志, 2021, 46(12): 1133-1137.
Wong L H, Tay E, Heng S T, et al. Hospital pharmacists and antimicrobial stewardship: A qualitative analysis[J]. Antibiotics (Basel), 2021, 10(12): 1441-1456.
浙江省醫院藥事管理質控中心, 浙江省微生物與免疫學會, 浙江省護理質控中心, 等. 浙江省頭孢菌素類抗菌藥物皮膚過敏試驗指導意見[J]. 中國現代應用藥學, 2018, 35(12): 1907-1909.
趙志剛. 頭孢類抗菌藥物皮膚過敏試驗高端論壇專家共識[J]. 臨床藥物治療雜志, 2008, 6(4): 1-2.
廣東省藥學會. 頭孢類抗菌藥物皮膚過敏試驗專家共識[J]. 今日藥學, 2008, 18(6):1.
Unger N R, Gauthier T P, Cheung L W. Penicillin skin testing: Potential implications for antimicrobial stewardship[J]. Pharmacotherapy, 2013, 33(8): 856-867.
Bourke J, Pavlos R, James I, et al. Improving the effectiveness of penicillin allergy de-labeling[J]. J Allergy Clin Immunol Pract, 2015, 3(3): 365-334.
吳曉麗, 陳海云. 頭孢曲松鈉皮試致過敏性休克死亡1例[J]. 醫藥導報, 2018, 37(1): 131.
張金紅, 房德敏, 高穎, 等. 頭孢唑林鈉皮試陰性致過敏性休克的系統文獻分析[J]. 中國藥學雜志, 2019, 54(12): 1024-1030.
《抗菌藥物臨床應用指導原則》修訂工作組.抗菌藥物臨床應用指導原則: 2015年版[S]. 抗菌藥物臨床應用指導原則:2015年版, 2015.
張桂香, 王心愉, 竇昊, 等. 高度重視青霉素類口服制劑用前應做皮試的規定[J]. 中國藥業, 2002, (9): 13.
Bernstein I L, Li J T, Bernstein D I, et al. Allergy diagnostic testing: an updated practice parameter[J]. Ann Allergy Asthma Immunol, 2008, 100(Suppl 3): S1-148.
Blumenthal K G, Ryan E E, Li Y, et al. The impact of a reported penicillin allergy on surgical site infection risk[J]. Clin Infect Dis, 2018, 66(3): 329-336.
Macy E, Contreras R. Health care use and serious infection prevalence associated with penicillin “allergy” in hospitalized patients: A cohort study[J]. J Allergy Clin Immunol, 2014, 133(3): 790-796.
蔣華玲, 馮澤英, 朱建平, 等. 頭孢菌素類藥物皮試結果陽性對患者院內費用和住院時長的影響——一項基于3萬名手術患者的真實世界研究[J]. 中國醫院藥學雜志, 2022, 42(11): 1156-1159.
Trubiano J A, Worth L J, Urbancic K, et al. Return to sender: the need to re-address patient antibiotic allergy labels in Australia and New Zealand[J]. Intern Med J, 2016, 46(11): 1311-1317.
Trubiano J A, Thursky K A, Stewardson A J, et al. Impact of an integrated antibiotic allergy testing program on antimicrobial stewardship: A multicenter evaluation[J]. Clin Infect Dis, 2017, 65(1): 166-174.
González-García R, Albanell-Fernández M, Aranda L, et al. Evaluation of desensitization protocols to betalactam antibiotics[J]. J Clin Pharm Ther, 2022, 47(5): 592-599.
Stone C A Jr, Trubiano J, Coleman D T, et al. The challenge of de-labeling penicillin allergy[J]. Allergy, 2020, 75(2): 273-288.
Mann K L, Wu J Y, Shah S S. Implementation of a pharmacist-driven detailed penicillin allergy interview[J]. Ann Pharmacother, 2020, 54(4): 364-370.
du Plessis T, Walls G, Jordan A, et al. Implementation of a pharmacist-led penicillin allergy de-labelling service in a public hospital[J]. J Antimicrob Chemother, 2019, 74(5): 1438-1446.
收稿日期:2023-03-01
基金項目:國家科技重大專項(民口)重大新藥創制(No. 2020ZX09201-015)
作者簡介:許譯尹,女,生于1995年,藥師,研究方向為抗感染藥物,臨床藥學,E-mail: 1185770201@qq.com
*通信作者,E-mail: gycsh@163.com

