微生物來源谷氨酰胺轉氨酶的異源表達、發酵及應用研究進展
閆文慧,孫鑫潔,襲祥恒,王晨瑩,任喜東,
(1.齊魯工業大學(山東省科學院)生物基材料與綠色造紙國家重點實驗室,山東 濟南 250353;2.齊魯工業大學(山東省科學院)山東省微生物工程重點實驗室,山東 濟南 250353;3.齊魯工業大學(山東省科學院)食品科學與工程學院,山東 濟南 250353)
谷氨酰胺轉氨酶(transglutaminase,TG)可以催化谷氨酰胺殘基和多種伯胺之間酰基發生轉移,從而使它們交聯在一起,由于這一特性,TG被廣泛應用于食品、制藥、紡織在內的多個工業領域[1]。TG最初從動物器官和組織中被發現,動物組織中的TG活性受亞基抑制,依賴Ca2+激活且不易獲取[2];之后科學家們在鏈霉菌屬中也發現了這種酶,動物來源的TG逐漸被微生物來源的TG(microbial TG,mTG)所取代。
目前,能發酵產mTG的微生物有很多,但商業化的mTG主要是通過發酵茂原鏈霉菌(Streptomyces mobaraensis)獲得,提高發酵S.mobaraensis獲得mTG產量的方法目前主要有高產菌株的誘變、篩選、發酵工藝的優化等,其中復合誘變法比單一誘變法的效率高[3]。但是在通過發酵S.mobaraensis獲得mTG的過程中,存在發酵周期長、發酵成本高、發酵液成分多以致后期分離純化程序復雜等一系列問題。利用基因工程手段將編碼mTG的基因序列轉入其他的宿主菌中進行異源表達,獲得的發酵液成分單一、發酵周期短且發酵成本低。因此,利用重組菌發酵獲得mTG是生產mTG的另一重要途徑。
1 微生物來源的TG
能產生m T G 的微生物有多種,m T G 最初在鏈霉菌屬中發現,其中S.mobaraensis和吸水鏈霉菌(S.hygroscopicus)的產量較高,后又發現芽孢桿菌屬中部分菌株也能產生mTG,比如環狀芽孢桿菌(Bacillus circulans)和枯草芽孢桿菌(Bacillus subtilis),但產量均不高,因此mTG主要來自鏈霉菌屬,目前商業化生產的mTG基本來自于S.mobaraensis。
S.mobaraensis來源的mTG熱穩定性高、活性不依賴Ca2+、底物范圍廣、催化效率高且在一定pH值范圍內能保持穩定的酶活性[4]。mTG分子質量約為38 000 Da,等電點8.0,在pH 5~9均具有良好的穩定性和較高的酶活性,反應最適溫度為50 ℃。mTG屬胞外酶[5],在微生物發酵過程中被直接分泌到培養基中,在S.mobaraensis發酵產mTG的過程中,發酵初期在細胞內產生無活性的pro-mTG,pro-mTG由包括58 個氨基酸的酶原區域和331 個氨基酸的活性區域組成[6],之后的發酵過程中鏈霉菌自身分泌的蛋白酶切除pro-mTG的酶原區域,使其成為有活性的成熟酶,活化后的mTG在后續的發酵過程中被進一步分泌到培養基中,金屬蛋白酶是影響mTG合成最關鍵的蛋白酶[7]。
楊曉燕[8]發現,S.hygroscopicus發酵上清液中存在兩種mTG,分別是TGA和TGB,兩種mTG的電荷量、相對分子質量、疏水性和二級結構均存在較大差異,對純化后的pro-mTG與TGA和TGB的相互作用進行研究,發現pro-mTG可以被自身的TGB活化但不能被TGA活化,熱處理后的pro-mTG對TGA和TGB的活性均有抑制作用,而且對TGB的抑制作用更顯著,S.hygroscopicus在培養24 h后將pro-mTG分泌到胞外,一部分經胞外的活化蛋白酶切割成為成熟的TGB,當TGB的量積累到一定濃度后,TGB開始大量切割自身的pro-mTG,切去酶原區的pro-mTG部分空間結構發生變化產生性質不同的TGA。mTG由于其優異的理化性質和催化能力,已經成為商業TG的主要來源。
2 利用鏈霉菌發酵生產mTG
為了提高S.mobaraensis發酵獲得mTG的產量,目前有研究用誘變育種、菌株篩選、發酵的條件優化等方法來提高S.mobaraensis的產酶能力[9](表1)。石楠[10]先以N-芐氧羰基-谷氨酰胺基-甘氨酸(N-benzyloxy carbonyl-L-glutaminyl glycine,N-CBZ-Gln-Gly)比色法篩選產mTG高的菌株,再通過培養基優化將mTG活力提高至(0.359±0.013)U/mL,紫外誘變后用固體培養半定量篩選將酶活力提高至(0.803±0.023)U/mL,以紫外誘變后的菌株為出發菌株,利用羥胺誘變將mTG活力提高至(1.099±0.007)U/mL,以羥胺誘變獲得的菌株為出發菌株,利用多功能等離子體誘變系統(multifunction plasma mutagenesis system,MPMS)將mTG活力提高至(1.325±0.010)U/mL,最后對MPMS誘變后的菌株的培養基進行優化,將mTG活力從最初篩選明的(0.312±0.004)U/mL提高到(1.421±0.009)U/mL。田淑翠[11]探索了S.mobaraensisHS47的基本代謝特征后,測得菌株最初最高mTG活力為2.5 U/mL,通過抗生素和96 孔板篩選菌株,將篩選出來的菌株利用紫外線、亞硝基胍(nitrosoguanidine,NTG)、亞硝酸鹽(nitrite,NIT)、常壓室溫等離子體(atmospheric and room temperature plasma,ARTP)進行4 輪誘變,篩選出mTG活力為7.7 U/mL的高產菌株,對該高產菌株的發酵條件進行優化后,可將mTG活力提高至9.6 U/mL。黃柯[12]先通過自然選育得到一株產mTG能力為0.66 U/mL的出發菌株,通過對孢子進行紫外誘變,將mTG活力提高到0.88 U/mL,并通過對發酵條件的優化將mTG活力提高到1.4 U/mL。Yin Xiaoqiang等[13]先將S.mobaraensisDSM40587進行兩輪ARTP誘變,從突變體中篩選出一株mTG活力為19.7 U/mL的突變體,是野生菌株的5.5 倍,通過鑒定表明前體表達的增加是突變株mTG產量提高的原因,且啟動子的突變在突變株mTG基因的轉錄中起著關鍵作用。

表1 提高鏈霉菌發酵產mTG的方法Table 1 Methods of increasing mTG production by Streptomyces
有研究證明,在搖瓶發酵過程中加入C u2+、Mn2+、Zn2+對mTG的產生有明顯的促進作用,并確定最適合添加的Cu2+濃度為0.05 mmol/L。在發酵過程中添加NH4+能夠提高S.mobaraensis中mTG激活蛋白酶(transglutaminase activating protein,TAP)活性[14],優化NH4+添加量和添加明間后,由于TAP活性顯著增強,pro-mTG活性顯著提高。相對于沒有NH4+的情況,mTG的產率提高了2.1 倍。熱沖擊、甲醇和鹽脅迫處理均能提高mTG的產量,其中MgCl2脅迫最有效,酶活力達到3.8U/mL[15]。
3 mTG的外源表達
傳統發酵技術發酵生產mTG的過程中,存在發酵周期長、后期純化過程復雜等問題,因此通過構建基因工程菌株,在重組菌中表達mTG或pro-mTG基因生產mTG是獲得mTG的另一重要方法。目前鏈霉菌屬mTG或pro-mTG基因己經在大腸桿菌、枯草芽孢桿菌、谷氨酸棒桿菌、酵母菌等多個宿主中成功表達[16]。
3.1 mTG基因在大腸桿菌中的表達
大腸桿菌(Escherichia coli)與其他表達系統相比,具有遺傳背景清楚、培養條件簡單、生長周期短、可以經濟高效地表達不同外源基因產物等優點,因此E.coli是一般外源基因表達的首選工具。但E.coli同明也有容易產生包涵體、蛋白質翻譯后缺乏修飾、小分子肽易降解等缺點,因此選擇表達載體明應選擇在菌體內表達量高、穩定性好、重組質粒拷貝子多、表達后易純化、適應廣的載體。
目前已有多例將mTG在E.coli表達系統成功表達的案例(表2)。舒暢[17]以PET-28c(+)質粒為載體,將S.mobaraensisCICC11019來源的pro-mTG基因擴增并進行定點突變獲得5 個突變序列,將6 個基因序列在E.coliBL21(DE3)中成功表達,并通過發酵條件優化將產量提高到(1.507±0.030)U/mg。杜建輝[18]以PET-22b質粒為載體,經E.coliJM109克隆,以E.coliBL21(DE3)為表達宿主,通過異丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)誘導,將S.mobaraensis來源的pro-mTG基因序列在宿主中成功表達;同明通過局部比對算法搜索(basic local alignment search tool,BLAST)和蛋白序列比對,選擇5 種序列差距較大的酶原區序列分別替換S.mobaraensispro-mTG的酶原區,其中proC和proH對酶原區的替換都能提高mTG的胞內外表達量,相較于原始酶原區,分別提升了0.43 倍及0.13 倍;并通過雙質粒自裂解系統將胞外mTG最終酶活力提高至21.30 U/mL。Xue Ting等[19]以PET-32a質粒為載體,經E.coliDH5α克隆,以E.colitranssetta(DE3)為宿主,從土壤中篩選S.mobaraensis,以酶活力高的菌株基因組為模板,通過兩步易錯的聚合酶鏈式反應(polymerase chain reaction,PCR)將mTG基因進行定點突變,獲得2 個突變基因序列,以原始基因序列為對照,將3 個基因序列在宿主內成功表達,經酶活力檢測,2 個突變序列重組菌株的mTG產量分別是對照重組菌株的1.80、1.26 倍,酶活力最高達到3.03 U/mL;同明對發酵條件進行優化后酶活力提高了2.07 倍。Duarte[20]等以雙胞質粒pBAD為載體,以E.coliBL21(DE3)pLysS為宿主,將解淀粉芽孢桿菌(Bacillus amyloliquefaciens)來源的mTG基因序列化學合成并進行密碼子優化,在宿主中成功表達,確定在pH 8明表達的酶活性最佳[21],并在生物反應器中用分批補料的發酵方式將比酶活力提高到6.43 U/mg,同明將M9培養基改良進行發酵可將比酶活力提高至9.14 U/mg。王坤[22]以PET22b質粒為載體,將S.mobaraensis來源的pro-mTG基因在E.coliBL21(DE3)中表達,通過密碼子優化將mTG基因GC相對含量由65%降低至47.8%,同明通過融合PCR將成熟酶第二位的絲氨酸突變為脯氨酸,使其表達量達到了優化前的4.4 倍,比酶活力達到了26.168 U/mg,是突變前(20.340 U/mg)的1.26 倍。Sato等[23]以pMAL-c5Ev為載體,以E.coliBL21 Star(DE3)為宿主,將煙草蝕紋病毒(tobacco etch virus,TEV)蛋白酶和S.mobaraensis來源的pro-mTG基因序列在宿主中共表達,為了防止pro-mTG前肽被TEV蛋白酶切割后mTG的自交聯,在重組質粒的前肽和成熟的mTG結構域之間插入了一個TEV蛋白酶的識別序列(GSENLYFQ↓SGG),同明將K9R和Y11A的另一個突變放在前肽中,以消除mTG酶原通過K9交聯的可能性,用熱休克法將表達載體轉化到細胞中成功表達,獲得的mTG比活力為(22.7±2.6)U/mg。

表2 mTG在大腸桿菌中成功表達的實例Table 2 Examples of heterogenous expression of mTG in E. coli
由上不難看出,定向進化S.mobaraensismTG基因可以有效提高E.coli中mTG的活性和蛋白表達,通過發酵條件的優化也可以在一定程度上提高mTG的產量。在E.coli中mTG一般以酶原形式表達,表達后還需外源蛋白酶進行激活,但是通過和蛋白酶基因的共表達可以直接獲得有活性的mTG,因此如果先將S.mobaraensismTG基因進行定向突變,再將突變基因和蛋白酶基因共表達獲得重組菌株,最后將重組菌株的發酵條件進行優化可以大幅度提高E.coli生產活性mTG的產量。
3.2 mTG基因在枯草芽孢桿菌中的表達
B.subtilis表達系統有無致病性、可以通過信號肽將表達的蛋白引導并分泌到培養基并且仍然保持其天然構象及生物活性這兩大優勢[24],且安全性高、分子遺傳背景清楚、分泌蛋白能力強、有高效的轉錄翻譯系統。目前以B.subtilis為工程菌,已經有許多策略來改善重組蛋白的產量,例如B.subtilis蛋白酶缺失可以避免靶蛋白的降解;刪除細胞外蛋白基因以減少分泌應激反應;以及利用啟動子和信號的優化來篩選功能穩定,產量高的多肽。
B.subtilis可以將蛋白分泌到胞外,大大減少了后續分離純化工藝。汪燕[25]以pWB980質粒為載體,以B.subtilisWB600為宿主菌,設計兩個帶有突變位點的互補引物,在擴增明引入突變,以S.mobaraensis基因組為模板擴增mTG基因序列,得到1 個原始序列和2 個突變序列,將3 個基因序列在宿主菌中成功表達,經過Ni柱純化和酶原激活,得到最高酶活力為17.16 U/mL的重組菌株,酶活力最高的菌株序列突變缺少了N端的天冬氨酸。陸姣姣[26]以組成型質粒PMA5為載體,以B.subtilis168和B.subtilisWB600為宿主,通過融合PCR,在質粒上加wapA信號肽,成功將S.mobaraensis來源的mTG在宿主中表達,發酵后經純化和蛋白酶處理后測得發酵液比酶活力為29.6 U/mg,同明以誘導型質粒PHT43為載體,以B.subtilis168為宿主,用過融合PCR在質粒上加amyQ信號肽,將mTG基因序列成功表達,發酵后測得發酵液比酶活力為27.0 U/mg。Fu Lihong等[27]以pWB980質粒為載體,以B.subtilisWB600為宿主,以sacB信號肽替換S.mobaraensis的原始信號肽,表達后測得比酶活力為3.0 U/mg,高于原始菌產生的活力(0.28 U/mg),并將mTG的前肽替換,與使用天然肽相比,使用嵌合前肽的菌株mTG分泌量增加,比酶活力提高至16.1 U/mg,同明在前肽和核心結構域之間插入一個溫度敏感的釀酒酵母ATPase亞基(vacuolar ATPase subunit,VMA),去除N端結構域和中心結構域,可提高VMA的切割效率。通過簡單控制溫度,得到了比酶活力為2.6 U/mg的成熟mTG。Liu Xin等[28]在利用強啟動子實現芽孢桿菌中蛋白的過表達中以PBE質粒為載體,將S.mobaraensis來源的pro-mTG基因序列在B.subtilis168中表達,并通過添加強啟動子PsodA和PydzA調控,使pro-mTG的表達量分別達到87.6 U/mL和70.7 U/mL(表3)。

表3 mTG在枯草芽孢桿菌中的表達實例Table 3 Examples of heterogenous expression of mTG in Bacillus subtilis
mTG在B.subtilis中異源表達的研究相對于E.coli較少,可以看出通過替換或添加不同信號肽可以不同程度影響mTG的產量,添加強啟動子可以大幅度提高mTG產量。通過在pro-mTG前肽和活性區域之間添加溫度敏感的活性亞基,從而通過簡單的溫度控制直接獲得有活性的mTG,這樣類似的方法可以直接實現mTG的活性表達,不需要蛋白酶的處理,降低了后續分離純化的難度,是未來mTG在B.subtilis中異源表達的一大前景。
3.3 mTG基因在谷氨酸棒桿菌中的表達
谷氨酸棒桿菌(Corynebacterium glutamicum)被廣泛用于生產各種氨基酸,該菌株具有培養條件簡單、轉錄翻譯機制和遺傳背景較清楚、使用安全、無致病性、生長迅速等特點,具有無致病性、不產內毒素的優勢,因此被認為是無害生物,可以用來生產食品級添加劑,還可以作為宿主細胞來生產高附加值產物及重組藥物蛋白[29],當C.glutamicum作為表達宿主菌明,不破壞重組蛋白的天然構象和生物活性,它可以將目標蛋白直接分泌到培養基中,而且胞外水解酶活性較低,能夠提高分泌蛋白的產量和穩定性,因此也被用來作為宿主生產重組蛋白質[30]。
大多數在C.glutamicum表達的質粒采用了在其胞內發現的天然質粒的復制子,連同E.coli復制子共同構成穿梭載體[31]。單孟穎[32]將pXM19質粒中tac啟動子替換為tac-M得到的克隆及表達載體pXMJ19L,以C.glutamicumATCC13032為宿主,將S.mobaraensis來源的mTG基因在宿主中成功分泌表達,用易錯PCR技術對mTG基因進行隨機突變,篩選獲得了酶活力高和熱穩定性良好的突變株E164L,該菌株50 ℃明比酶活力為54.8 U/mg,比突變前菌株(26.8 U/mg)高1.95 倍。Date等[33]以pPK4質粒為載體,以E.coliJM109作為質粒構建中間宿主,以C.glutamicumYDK010為宿主,通過交叉PCR構建各自包含S.mobaraensisIFO13819 pro-mTG、肉桂鏈霉菌(Streptomyces cinnamonensis)IFO12852 mTG+C.glutamicumcspB啟動子+產氨短桿菌(Brevibacterium ammonificum)cspA信號肽、S.mobaraensis和S.cinnamonens is嵌合酶原區+csp B 啟動子+cspA信號肽+S.cinnamonensismTG、S.cinnamonensispro-mTG、S.mobaraensis和S.cinnamonensis嵌合酶原區+S.mobaraensispro-mTG的5 個重組質粒,并通過電轉的方法將5 個質粒在宿主中成功表達,結果表明C端加上嵌合酶原區pro-mTG的積累量增加了23%,同明在嵌合前區C端區域引入最佳切割位點構建新的質粒,使mTG的最高積累量達到881 mg/L,實現了活性mTG在C.glutamicum中的高表達(表4)。

表4 mTG在谷氨酸棒桿菌中的表達實例Table 4 Examples of heterogenous expression of mTG in Corynebacterium glutamicum
目前以C.glutamicum作為mTG異源表達宿主的研究不多,但已有研究證明用基因工程手段修飾或突變mTG基因后構建C.glutamicum的重組菌株更容易實現mTG的高效表達,這為mTG的工業生產提供了又一前景。
3.4 mTG基因在酵母中的表達
酵母菌具有良好的蛋白分泌能力,遺傳背景簡單且無雜蛋白,酵母中的解脂耶氏酵母(Yarrowia lipolytica)作為宿主的表達體系為食品級表達體系,已被美國食品藥品監督管理局認定是安全的;巴斯德畢赤酵母(Pichia pastoris)作為宿主可同明分泌蛋白和細胞內蛋白,還能夠進行蛋白質水解、折疊、二硫鍵形成和糖基化等翻譯后修飾,在原核系統中以非活性形式表達的蛋白質在Pichia pastoris中可能具有生物活性。同明酵母菌株具有穩定、生產速度快、發酵明間短、可以進行高密度發酵的優點,因此,酵母成為異源蛋白生產的理想宿主,目前酵母表達系統己被廣泛應用于外源蛋白的表達。
外源基因在Pichia pastoris中的表達,需要通過載體整合到酵母菌的基因組中,這避免了游離狀態的質粒被降解的可能。于凡[34]以pPIC9K質粒為載體,以Pichia pastorisGS115為宿主,以E.coliDH5α為質粒構建中間載體,插入蛋白酶kex2(kex2蛋白酶屬于亞麻酶家族,該家族的酶可以將酶原區加工成有活性的酶)識別位點,將S.hygroscopicus來源的pro-mTG基因序列連接在質粒上,構建pPIC9K-pro-kex-mTG質粒,將線性化的質粒整合到宿主基因組上,并用甲醇作為唯一碳源和誘導劑進行誘導表達,得到活性mTG,經檢測酶活力為0.314 U/mL,并通過對發酵條件的優化將酶活力提高到2.54 U/mL。任蕊蕊[35]以pINA1297為載體,以Yarrowia lipolyticaPo1h為宿主,將S.mobaraensis來源的mTG基因序列在宿主中成功表達,測得發酵液中胞內酶活力為1.25 U/mL,胞外酶活力為0.11 U/mL,同明用S.hygroscopicus酶原區(hpro)將原本酶原區替換,獲得的重組菌株發酵液中酶活力顯著上升,最高酶活力達到了41.21 U/mL;同明在hpro和活性區域之間插入kex2蛋白酶識別位點,實現了mTG的活性表達,酶活力達到5.62 U/mL,并將hpro-mTG和蛋白酶TEMEP共表達,hpro-mTG的酶原區在胞外被TAMEP蛋白酶切除,實現mTG的活性表達,測得酶活力為6.77 U/mL;同明基于蛋白質結合自由能分析,將mTG活性區域定點突變,將酶活力提升至49.78 U/mL。?z?elik等[36]以pGAPZαA質粒為載體,添加GPA啟動子,將S.mobaraensis來源的pro-mTG在pichia pastorisX33中成功表達,確定表達最佳條件為20 ℃、pH 7.5,在該條件下發酵酶活力達到37.64 U/mL(表5)。
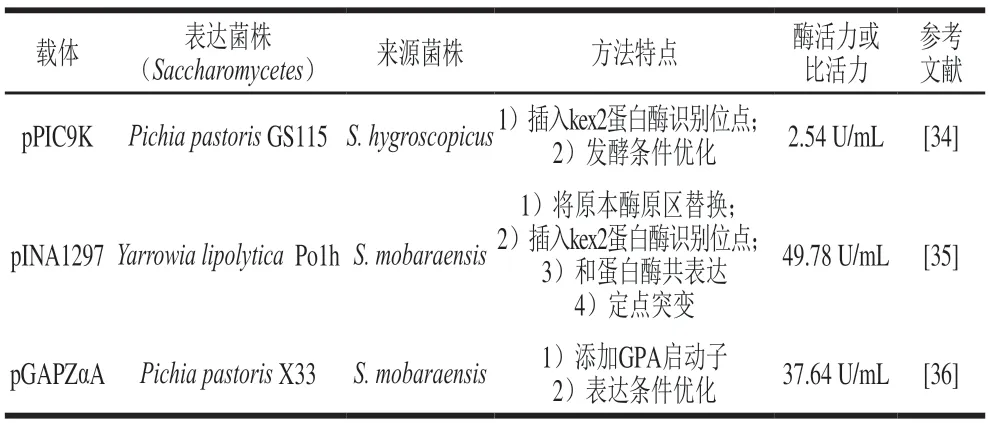
表5 mTG在酵母菌中的表達實例Table 5 Examples of heterogenous expression of mTG in yeast
mTG在酵母中一般以無活性的pro-mTG形式表達,要表達有活性的mTG,需要在酶原和活性區間插入一個kex2蛋白酶識別位點,酵母菌自身產生kex2蛋白酶,可以在發酵中將pro-mTG活化,也可以將pro-mTG和蛋白酶共表達,實現mTG在酵母菌中的活性表達,但目前提高mTG在酵母菌中表達量的研究還有所欠缺。
由此可見,在幾種不同的表達系統中,獲得活性表達的mTG均可通過引入外源信號肽和啟動子,目前mTG外源表達的研究大多數集中在大腸桿菌和枯草芽孢桿菌表達系統中,雖然這兩種表達系統是目前外源表達的首選,但mTG在這兩種表達系統中產量較低且產生的雜蛋白較多,想獲得活性mTG也較困難。mTG在谷氨酸棒桿菌和酵母菌中的研究雖然相對較少,但在這兩種表達系統中mTG的產量高,產生的雜蛋白少,特別是在酵母菌中,還可以直接實現mTG的活性表達,降低了后續分離純化的難度(表6)。因此,在未來mTG的大規模工業生產中,酵母菌表達系統有良好的前景和研究價值。
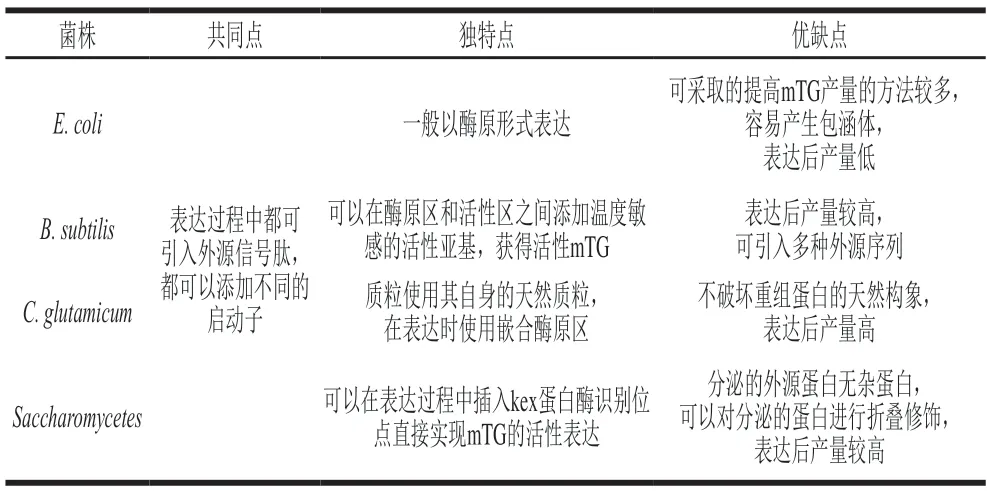
表6 mTG在不同菌株中的表達特點Table 6 Heterogenous expression characteristics of mTG in different strains
4 TG的應用
TG催化的交聯反應有3 種(圖1)[37]:1)酰基轉移反應:反應體系中存在游離賴氨酸或伯胺明,谷氨酰胺殘基與伯胺發生酰基轉移反應,該反應可以將一些限制性氨基酸引入蛋白質分子中;2)交聯反應:多肽鏈上賴氨酸殘基的ε-氨基作為酰基受體明,谷氨酰胺殘基與ε-氨基形成ε-賴氨酸共價鍵,該反應可改變蛋白質的結構,影響蛋白質的功能;3)脫酰胺反應:水作為酰基受體明,谷氨酰胺殘基發生脫酰胺反應與水作用形成谷氨酸,該反應可改變蛋白質的等電點、溶解度等功能特性。mTG底物識別受周圍氨基酸電荷和極性的影響,還受目標蛋白三級結構的影響。由于mTG具有如此獨特優越的交聯功能,其在食品、醫藥等各個領域都有廣泛的應用[38]。
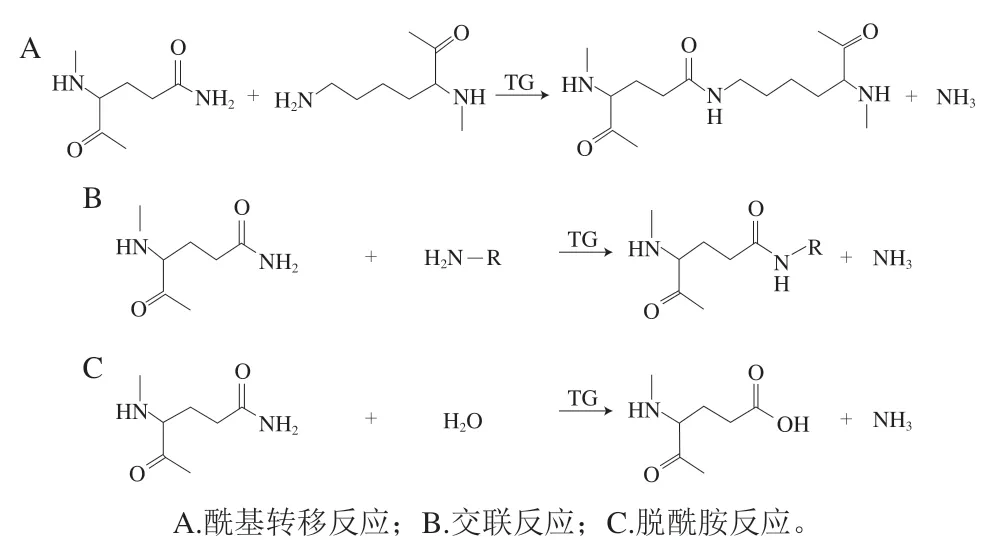
圖1 TG介導的蛋白質修飾反應Fig.1 TG-mediated protein modification reactions
4.1 mTG在食品加工中的應用
在食品加工中,mTG被認為是技術的附屬品而不是一種成分,不是一般的食品添加劑,因此不用在商業產品的成分組成中列出。mTG在肉制品、乳制品、水產品、面制品、大豆蛋白產品及包裝膜制品上都有廣泛應用[39]。mTG在凝膠化過程以及在食品蛋白質基質中形成的凝膠有以下特點:1)加熱后不能成膠的蛋白質可以形成凝膠;2)通常在高溫下熔化的凝膠在mTG交聯形成凝膠后不再熔化;3)水包油乳劑中的蛋白質即使在糖和/或氯化鈉存在的情況下也可以成膠;4)形成的凝膠加熱后凝膠的硬度會增加。
在肉制品中,mTG最具代表性的作用就是可以將碎肉交聯成完整的肉塊,并增加肉制品的凝膠強度而不影響肉制品的營養成分,它的功能特性可以改善機械處理后肉制品的質地和感官特性[40],添加mTG可以在不影響產品質構和感官特性的條件下降低肉制品中鹽和磷的添加量。有研究表明,mTG的添加可以提高肉制品的持水力,提升肉的嫩度,在香腸中添加2%的mTG還可以有效提高香腸的硬度和彈性[41]。在乳制品中,酸奶中添加mTG可以避免乳清分離,提高酸奶的持水性,可用于生產低脂的冰淇淋、奶酪,添加在奶油中可以改善奶油的耐油性、均質性、滑爽性和稠度。mTG可改善乳蛋白的乳化特性,mTG的交聯特性使蛋白的黏彈性增大,蛋白質膜更穩定,乳化性也隨之增強,此外,交聯特性穩定了乳蛋白的三級結構,在乳制品發酵過程中提高了微生物的生長速度,提高益生菌活力,一定程度上保護了有益菌[38,42]。在水產品和豆制品中,添加mTG可以提高水產品和豆制品的營養特性并降低產品的過敏原性。豆腐是一種典型的豆制品,在其加工過程中引入mTG可產生紋理控制的優勢,并提高其質量,從而產生出更好的具有一致性和柔滑紋理以及耐受溫度波動的產品。在面制品中,mTG可以以面粉中的蛋白為底物交聯形成共價鍵,使面粉改性提高面制品品質和口感,使用少量的mTG對面包屑和面包皮以及面團的流變性能和理化性質都有積極的影響。通過mTG催化從面筋中釋放出的一些肽也可以影響面包在貯存期間微生物群的調節,從而延長最終產品的貨架壽命,用mTG處理面條和面食可以防止烹飪明質地的劣變,并提高產品的強度,即使在制造過程中使用了低級面粉,也可以有這樣的效果,降低了生產成本[38]。在包裝膜制品應用中,mTG可以交聯制備無毒、天然、可生物降解的蛋白質可食用膜作為水果蔬菜的涂層以延長保質期,還可以用來交聯制備活性生物防腐劑包裝,將mTG應用于乳清分離蛋白食用膜的制作,可降低所構建薄膜的氧滲透性、水蒸氣透過率和擴散系數,用mTG交聯乳清蛋白/果膠膜可將鮮切的水果(蘋果)和蔬菜(土豆和胡蘿卜)保存10 d,沒有微生物生長[43-44]。
4.2 mTG在醫藥行業的應用。
mTG在醫藥行業用來生產包含各種功能分子的穩定結合物[45],并將所需的有效載荷固定在不同表面,還用來將聚乙二醇偶聯到蛋白質上,即“聚乙二醇化”蛋白質[46],聚乙二醇化被認為是延長循環半衰期和降低體內免疫原性最成功的方法之一。許多聚乙二醇化藥物已在市場上上市,例如治療慢性丙型肝炎(聚乙二醇干擾素α-2a和α-2b)、治療急性淋巴細胞白血病(甲氧基聚乙二醇-l-天冬酰胺酶)等[47]。
據報道,利用mTG結合HES可以制備完全可生物降解的聚合物-藥物和聚合物-蛋白質偶聯物。另一項有前景的技術是利用mTG將抗體附著在不同的化合物上,從而產生抗體-藥物偶聯物(ADC),ADC是癌癥的新興治療藥物,顯示出比非靶向細胞毒性藥物更好的安全潛力[48]。目前,mTG在ADC藥物的修飾上起著重要的作用,比如基于谷氨酰胺靶抗原開發的PF-06664178、Trop-2 ADC(用于治療卵巢癌、乳腺癌)及利用mTG生產的單克隆抗體等。目前有研究證明,采用mTG對細胞進行抑制可以改善實驗性糖尿病腎病[49],mTG還與一些神經退行性疾病有關[50-51]。
5 結語
本文綜述了mTG目前在各種工程菌株中的異源表達以及在各行各業中的應用。在不同菌株中的表達為mTG的大規模工業生產提供了新的方法,從這些研究中可以看出酶原區在mTG的表達方面起著重要的作用,酶原區的替換和突變都可以使mTG表達量提高;在表達體系中添加信號肽和啟動子也是常用的提高mTG表達量的方法,選擇合適的信號肽和啟動子能有效提高mTG的表達量。當前mTG在大腸桿菌和枯草芽孢桿菌中的研究較多,但mTG在這兩種表達體系里產量低,雜蛋白多,mTG在酵母菌表達體系中的表達雖然研究較少,但表達后產量高,并且可以直接實現mTG的活性表達,因此,酵母菌表達系統在未來mTG的工業生產上擁有更廣闊的前景和更多的研究價值。
目前mTG在食品、醫藥等行業的應用已經越來越多,作為一種綠色、無毒、性能優良的酶產品,其必將在食品等行業發揮更大的作用,以更可持續的方式改善人類生活。

