基于“證據推理與模型認知”背景下的沉淀溶解平衡圖像分析與突破
李文星
(江蘇省徐州市第七中學)
新課程標準對沉淀溶解平衡的要求為認識難溶電解質在水溶液中存在沉淀溶解平衡,了解沉淀的生成、溶解與轉化.整理近幾年的高考題,涉及沉淀溶解平衡圖像的高考題多以選擇題的形式來呈現,有時也會以填空題的形式呈現.
1 反比例函數沉淀溶解平衡圖像分析與突破
例1某溫度下,FeS 的水溶液中存在平衡FeS(s)?Fe2+(aq)+S2-(aq),其沉淀溶解平衡曲線如圖1所示.下列說法正確的是( ).
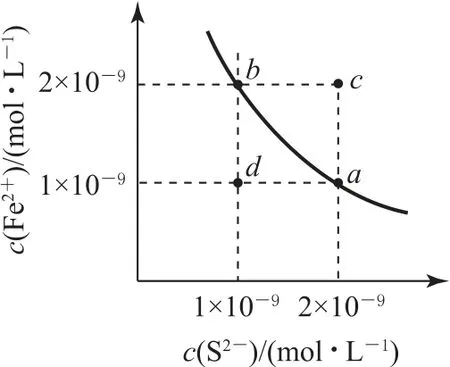
圖1
A.可以通過升溫實現由c點變到a點
B.d點可能有沉淀生成
C.a點對應的Ksp大于b點對應的Ksp
D.該溫度下,Ksp(FeS)=2.0×10-18
從圖像可以看出,從c點到a點,c(S2-)不變,c(Fe2+)變小,而溫度變化時,c(S2-)與c(Fe2+)同時變化,選項A 錯誤.沉淀溶解平衡曲線上方表示過飽和溶液,可析出沉淀,曲線下方表示不飽和溶液,所以d點沒有沉淀生成,選項B錯誤.a、b點處于等溫線上,溫度不變,Ksp不變,選項C 錯誤.由圖知,該溫度下,Ksp(FeS)=2.0×10-18,選項D 正確.答案為D.
2 對數直線沉淀溶解平衡圖像分析與突破
例2常溫下,Ksp(NiS)=1.0×10-21,Ksp(FeS)=6.0×10-18.RS的沉淀溶解平衡曲線如圖2所示(R 表示Ni或Fe).下列說法正確的是( ).

圖2
A.圖中Ⅱ表示FeS溶解平衡曲線
B.常溫下,NiS+Fe2+?FeS+Ni2+的平衡常數K=6000
C.常溫下,與Q點相對應的NiS的分散系固—液共存
D.常溫下,向P點對應的溶液中加適量Na2S固體,可轉化成M點對應的溶液
該題是對數直線沉淀溶解平衡圖像,要判斷曲線Ⅰ和曲線Ⅱ對應的是FeS還是NiS.需要根據Ksp的大小判斷,但要注意圖像的縱坐標是-lgc(R2+),-lgc(R2+)的值越大,金屬離子的濃度越小,-lgc(S2-)的值越大,硫離子的濃度越小,所以曲線Ⅱ的Ksp應該是小的,對應的應該是NiS溶解平衡曲線,選項A 錯誤.常溫下,NiS+Fe2+?FeS+Ni2+的平衡常數,選項B 錯誤.Q點處,平衡常數小于Ksp(NiS),分散系中無固體,選項C錯誤.P點對應的溶液中加適量Na2S 固體,S2-濃度增大,R2+濃度減小,可使溶液由P點轉化成M點對應的溶液,選項D 正確.答案為D.
推理與建模此類試題是把沉淀溶解平衡圖像的反比例函數形式變成直線形式,直線上的點是沉淀溶解平衡的點,解題時要看清坐標,注意數值表示形式的不同,應用圖像中關鍵的點進行Ksp的計算.
3 滴定曲線沉淀溶解平衡圖像分析與突破
例3室溫時,用0.100mol?L-1的標準AgNO3溶液滴定15.00mL 濃度相等的Cl-、Br-和I-混合溶液,通過電位滴定法獲得lgc(Ag+)與V(AgNO3)的關系曲線如圖3 所示(忽略沉淀對離子的吸附作用).若溶液中離子濃度小于1.0×10-5mol?L-1時,認為該離子沉淀完全.已知Ksp(AgCl)=1.8×10-10,Ksp(AgBr)=5.4×10-13,Ksp(AgI)=8.5×10-17.

圖3
下列說法不正確的是( ).
A.a點:有AgI沉淀生成
B.原溶液中Cl-的濃度為0.010mol?L-1
C.當Br-沉淀完全時,已經有部分Cl-沉淀
D.b點:
由題意可知,AgI更難溶,a點先生成AgI沉淀,選項A 說法正確.當滴入4.50mLAgNO3溶液時,3種離子完全沉淀,根據3種離子濃度相等,則每種離子完全沉淀消耗1.5mL0.100mol?L-1的標準AgNO3溶液,則氯離子濃度為
選項B 說法正確.當Br-完全沉淀時,Br-的濃度為1.0×10-5mol?L-1,此時溶液中的Ag+濃度為
若Cl-開始沉淀,則此時Cl-的濃度為
小于溶液中Cl-的濃度,說明已經開始沉淀,選項C說法正確.b點時,AgNO3過量,Ag+濃度最大,此時Cl-、Br-和I-完全沉淀,又因為
所以各離子濃度大小關系為
選項D 說法錯誤.答案為D.
4 其他類型沉淀溶解平衡圖像分析與突破
例4常溫下,向10.0 mL 濃度均為0.1 mol?L-1的AlCl3和FeCl3混合溶液中加入NaOH 固體,溶液中金屬元素有不同的存在形式,它們的物質的量濃度與NaOH 物質的量關系如圖4 所示,測得a、b點溶液的pH 分別為3.0、4.3.
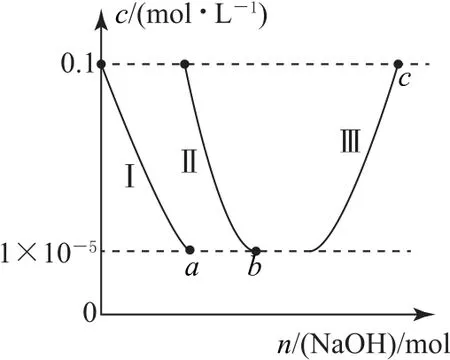
圖4
已知:①Ksp[Al(OH)3]>Ksp[Fe(OH)3];
②Al3+(aq)+4OH-(aq)?[Al(OH)4]-(aq).
下列敘述正確的是( ).
A.曲線Ⅰ代表Al3+
B.常溫下,Ksp[Al(OH)3]=1.0×10-38
C.b點溶液中金屬元素主要存在形式為Fe(OH)3和AlO-2
D.Al(OH)3+OH-=[Al(OH)4]-的平衡常數為1.1×10-1.1
根據a點、b點對應的pH,計算溶度積為
根據信息①可知,前者為Fe(OH)3的溶度積,后者為Al(OH)3的溶度積;溶解度小,優先沉淀,故曲線Ⅰ代表Fe3+,曲線Ⅱ代表Al3+,選項A、B 錯誤.b點恰好2種金屬離子完全沉淀,金屬元素主要存在形式為Fe(OH)3和Al(OH)3,選項C錯誤.平衡常數
選項D 正確.答案為D.
沉淀溶解平衡是電解質溶液中離子平衡的重要內容,也是高考經常考查的內容.在備考時涉及沉淀溶解平衡的圖像分析應該與鹽類的水解與弱電解質的電離平衡一樣受到重視.
(完)

