細讀圖、巧判斷,破解化學平衡圖像題
王程程
(浙江省溫州市第八高級中學)
對比近幾年的高考化學試題,發現化學平衡圖像分析題是高考的高頻考點,說明化學平衡圖像問題確實是高考的重中之重,也是學生必須要掌握的難點問題.試題考查考生的信息提取和加工能力及分析推理與計算能力.
1 提取關鍵信息細計算
例1我國提出二氧化碳排放力爭于2030年前達到峰值,努力爭取2060年前實現碳中和.研發CO2的利用技術,降低空氣中CO2的含量是實現該目標的重要途徑.下面是用H2捕捉CO2時發生的兩個反應:
Ⅰ.CO2(g)+4H2(g)?CH4(g)+2H2O(g)ΔH1;
Ⅱ.CO2(g)+H2(g)?CO(g)+H2O(g)ΔH2.
(1)反應Ⅰ、Ⅱ的lnK隨的變化如圖1所示,則ΔH1______0(填“>”“<”或“=”).有利于該反應自發進行的溫度是________(填“高溫”或“低溫”).
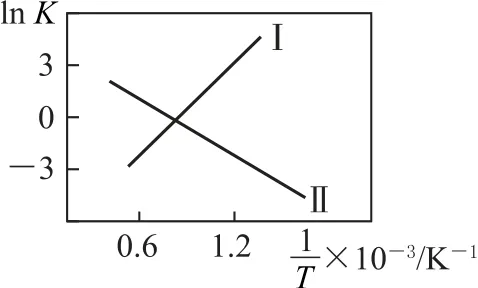
圖1
(2)將一定量CO2和H2的混合氣體充入密閉容器中,c(CO2)、v正(CO2)與溫度的關系如圖2所示,400℃之后c(CO2)降低的原因是________,而速率仍然增大的可能原因是_________.
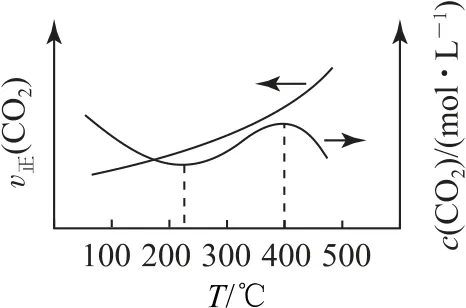
圖2
(3)220 ℃時,將4molH2與1molCO2的混合氣體充入2L反應器中,氣體初始總壓強為p,10min后體系達到平衡,CO2的轉化率為80%,CH4的選擇性為33.3%,則生成CH4的平均速率為________(保留兩位有效數字),反應Ⅱ的平衡常數Kp為_________.
氣體初始總壓強為p,平衡時總壓為
反應Ⅱ的平衡常數
方法總結審題時要先審題干,明確該反應放熱還是吸熱;再研究反應體系是平衡狀態還是非平衡狀態.審圖像時要明確橫縱坐標是什么,圖像中的每一個點都要看清楚,尤其是起點、交點、拐點及圖像坐標上的點,要根據條件的變化看曲線的走勢,根據反應的特點和外界的條件聯想化學平衡移動的規律進行分析.要充分利用題干中給出的數據和信息,計算壓強平衡常數、濃度平衡常數等.
2 多重平衡分主次巧判斷
例2我國科學家成功用二氧化碳人工合成淀粉,其中第一步是利用二氧化碳催化加氫制甲醇.在CO2(g)加氫合成CH3OH 的體系中,同時發生以下反應:
(1)一定條件下使CO2、H2混合氣體通過反應器,測得220 ℃時反應器出口氣體中全部含碳物質的物質的量之比為n(CH3OH)∶n(CO2)∶n(CO)=1∶7.20∶0.11,則該溫度下CO2轉化率為_________(列出計算式即可).
(2)其他條件相同時,反應溫度對CO2的轉化率的影響如圖3-甲所示,實驗中反應均未達到化學平衡狀態的依據是________;溫度高于260 ℃時,CO2平衡轉化率變化的原因是_________.
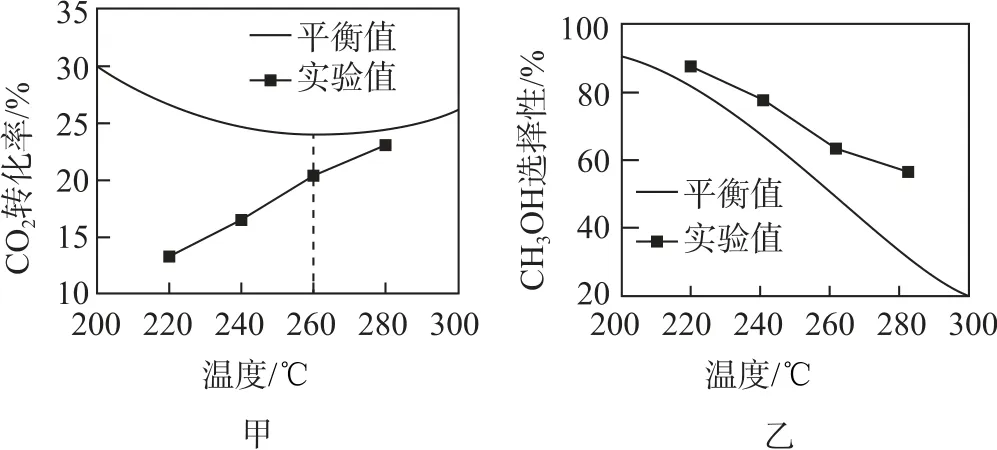
圖3
(3)其他條件相同時,反應溫度對CH3OH 的選擇性的影響如圖3-乙所示[CH3OH 的選擇性=].溫度相同時CH3OH 選擇性的實驗值略高于其平衡值,從化學反應速率的角度解釋其原因是________.
(1)220 ℃時,測得反應器出口氣體中全部含碳物質的物質的量之比
假設生成CH3OH 的物質的量為1 mol,則生成CO的物質的量為0.11mol,剩余CO2的物質的量為7.20 mol,根據碳原子守恒,起始的CO2的物質的量為1mol+7.20mol+0.11mol,則該溫度下CO2轉化率為.
(2)由圖3-甲可知,在不同溫度下,CO2轉化率的實驗值均小于平衡值,說明實驗中的反應均未達到化學平衡狀態;反應ⅰ為放熱反應,反應ⅱ為吸熱反應.溫度升高,反應ⅰ逆向移動,反應ⅱ正向移動,溫度高于260 ℃時,反應ⅱ正向移動的程度大于反應ⅰ逆向移動的程度,所以CO2平衡轉化率隨溫度升高而增大.
(3)由圖3-乙可知,從化學反應速率的角度看,原因是在該反應條件下反應ⅰ的速率大于反應ⅱ,單位時間內生成CH3OH 的量比生成CO 的量多.
方法總結對于有幾個方程式的多重平衡狀態,無非是競爭關系或連續轉換關系,解題時要分清哪些是主反應,哪些是副反應;然后列出體系中所有競爭反應的相關特點:吸熱反應還是放熱反應;是平衡狀態還是非平衡狀態.平衡狀態分析平衡移動的影響,應用勒夏特列原理,根據題目的圖像聯系規律;非平衡狀態分析速率快慢問題,有催化劑就要考慮催化劑的活性問題.
綜上所述,突破化學平衡圖像題,仔細審題是關鍵,要根據提示條件進行分析判斷,然后規范答題,才能取得高分.
(完)

