電解質中“直線”圖像特點分析及解題策略
蔡 莉
(寧夏回族自治區吳忠市青銅峽市第一中學)
電解質圖像中“直線問題”在最近高考中頻繁現身,其題目看似簡單,卻是學生失分的重災區.本文系統分析近年高考對這類問題的考查情況,以促進學生對這類知識的掌握.
1 試題特點
在這類問題中,一般會出現y=kx+b直線的圖像,常見的直線問題,可以分為以下幾類.
1)水的離子積常數衍變直線:向水中加入酸或堿,而后取對數,則可以得到如圖1所示的pOH-pH 圖像.在該圖像中,Q點為中性,M點、N點分別顯酸、堿性.
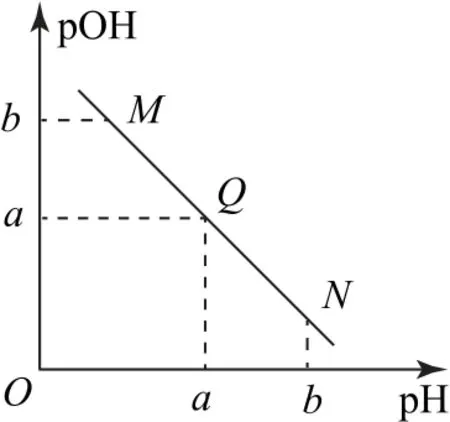
圖1
2)弱電解質電離常數衍變直線:NaOH 滴加到弱酸H2X 中,其pH 與離子濃度關系如圖2所示,其中或越大,電離程度越大,則Ka1遠大于Ka2,所以圖中直線N代表Ka1,M代表Ka2.
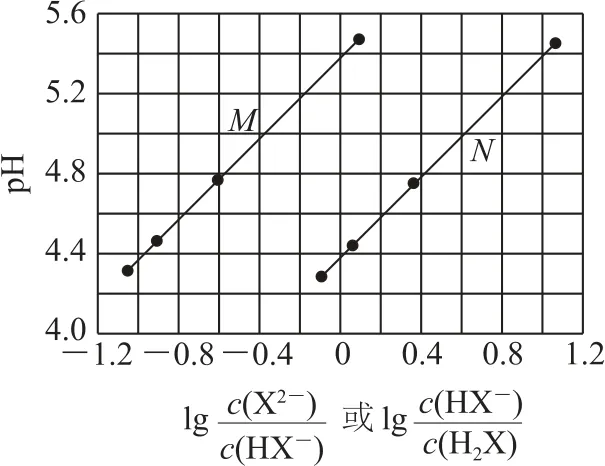
圖2
3)難溶性物質的溶度積常數衍變出的直線圖,如Ksp=c(M+)c(R-),取對數得pM-pR 曲線,如圖3所示,其中pM、pR 為陽離子、陰離子濃度的負對數.由圖可得AB上c(M2+)=c(R2-),溶度積:CaSO4>CaCO3>MnCO3;X點為CaCO3時會析出沉淀,為CaSO4時是不飽和溶液,能夠繼續溶解;Y點上>c(Ca2+),二者溶度積為10-5;Z點上<c(Mn2+),二者溶度積為10-10.6.

圖3
2 真題辨析
例1(雙選)(2022年海南卷)某元素M 的氫氧化物M(OH)2(s)在水中的溶解反應為
25 ℃,-lgc與pH 關系如圖4所示,c為M2+或濃度的值,下列說法錯誤的是( ).

圖4
A.曲線①代表-lgc(M2+)與pH 的關系
B.M(OH)2的Ksp約為1×10-10
C.向c(M2+)=0.1 mol?L-1的溶 液中加 入NaOH 溶液至pH=9.0,體系中元素M 主要以M(OH)2(s)存在
由題給反應可知,pH 增加,c(M2+)減小,增大,即-lgc(M2+)增大,減小,故曲線①為-lgc(M2+)與pH 的關系,選項A 說法正確.由圖可知,pH=7.0時,-lgc(M2+)=3.0,則M(OH)2的Ksp=c(M2+)?c2(OH-)=1×10-17,選項B 說法錯誤.pH=9.0時,、c(M2+)均極小,體系中M 的主要存在形式為M(OH)2(s),選項C 說法正確.由圖可得,=0.1 mol?L-1的溶液中,因為M(OH)2(s)+2OH-(aq)?(aq)的K=,所以溶液中,加入等體積0.4mol?L-1HCl,HCl與OH-發生 中和反 應,但OH-過量反應后仍呈現堿性,M 的主要存在形式為,選項D 說法錯誤.答案為B、D.
例2(2021 年全國甲卷)已知相同溫度下,Ksp(BaSO4)<Ksp(BaCO3),某溫度下,飽和溶液中)的關系如圖5所示,下列說法正確的是( ).

圖5
A.曲線①代表BaCO3的沉淀溶解曲線
B.BaSO4的該溫度下Ksp(BaSO4)值為1×10-10
C.加適量BaCl2固體可使溶液由a點變到b點
D.c(Ba2+)=10-5.1時兩溶液中
BaSO4,BaCO3均為難溶物,飽和溶液中
因為Ksp(BaSO4)<Ksp(BaCO3),則
因此,曲線①代表-lgc(Ba2+)與之間的關系,選項A 錯誤.當溶液中-lgc(Ba2+)=3時,,因此Ksp(BaSO4)=1×10-10,選項B正確.溫度不變,所以Ksp不變,飽和BaSO4溶液中加入適量BaCl2后,c(Ba2+)增加,則減小,此時點a將沿曲線①向左上方移動,選項C 錯誤.當c(Ba2+)=10-5.1時,兩溶液中,選項D 錯誤.答案為B.
例3(2021年全國乙卷)HA 是一元弱酸,難溶鹽MA 飽和溶液中c(M+)隨c(H+)而變化,M+不水解,298K 時,c2(M+)-c(H+)線性關系如圖6中實線所示.下列敘述錯誤的是( ).

圖6
A.pH=4時,c(M+)<3.0×10-4mol?L-1
B.MA 的溶度積常數Ksp(MA)=5.0×10-8
C.溶液的pH=7時,有
D.HA 電離常數Ka(HA)≈2.0×10-4
電解質中“直線”圖像題較難,學生要學會挖掘圖像內容,獲取有用信息,提高解題能力.
(完)

