動物早期胚胎發(fā)育中表觀重編程的機制
張宸藝博,余 彤,任斌斌,鄭睿智,朱文治,蘇建民
(西北農(nóng)林科技大學(xué)動物醫(yī)學(xué)院,家畜生物學(xué)重點實驗室,楊凌 712100)
最近幾年,表觀遺傳學(xué)研究在發(fā)育生物學(xué)、再生醫(yī)學(xué)等領(lǐng)域備受關(guān)注,特別是胚胎發(fā)育過程中的表觀遺傳現(xiàn)象。不同于有絲分裂中子細胞直接繼承母細胞的表觀遺傳印記,在動物早期胚胎發(fā)育期間,胚胎表觀基因組的重編程是一個極其重要的表觀遺傳學(xué)事件。重編程的目的是清除受精前雌雄配子既有的分化記憶,從而使受精后的合子獲得全能性。在早期胚胎發(fā)育過程中,表觀遺傳重編程的關(guān)鍵事件包括消除附植前胚胎雌雄原核中的大部分表觀遺傳標記,以及在附植后建立胚胎表觀遺傳模式。哺乳動物胚胎表觀遺傳重編程過程受到多種機制的嚴格調(diào)控。如果該過程發(fā)生異常,常導(dǎo)致胚胎發(fā)育相關(guān)基因的異常表達,繼而阻滯胚胎發(fā)育,甚至導(dǎo)致胎兒發(fā)育異常或死亡[1]。因此,了解哺乳動物胚胎重編程過程中的動態(tài)變化及其調(diào)控機制具有十分重要的意義。本文將綜述近年來國內(nèi)外在哺乳動物胚胎重編程方面的研究進展,以小鼠的重編程模式為主要線索,同時比較不同物種間重編程機制的差異。
1 DNA甲基化
5-甲基胞嘧啶(5-methyl-cytosine, 5-mC)是一種可逆的表觀遺傳標記,通過DNA甲基轉(zhuǎn)移酶(DNA methyl-transferase, DNMT)將S-腺苷甲硫氨酸(SAM)提供的甲基基團轉(zhuǎn)移到胞嘧啶第五個碳原子而形成,常出現(xiàn)在CpG島并抑制基因的表達[2]。在哺乳動物早期胚胎中,DNA甲基化主要由DNMT3A/B和DNMT1催化,而TET酶則通過一系列反應(yīng)去除胞嘧啶上的甲基基團[3]。
1.1 受精后發(fā)生的大范圍去甲基化
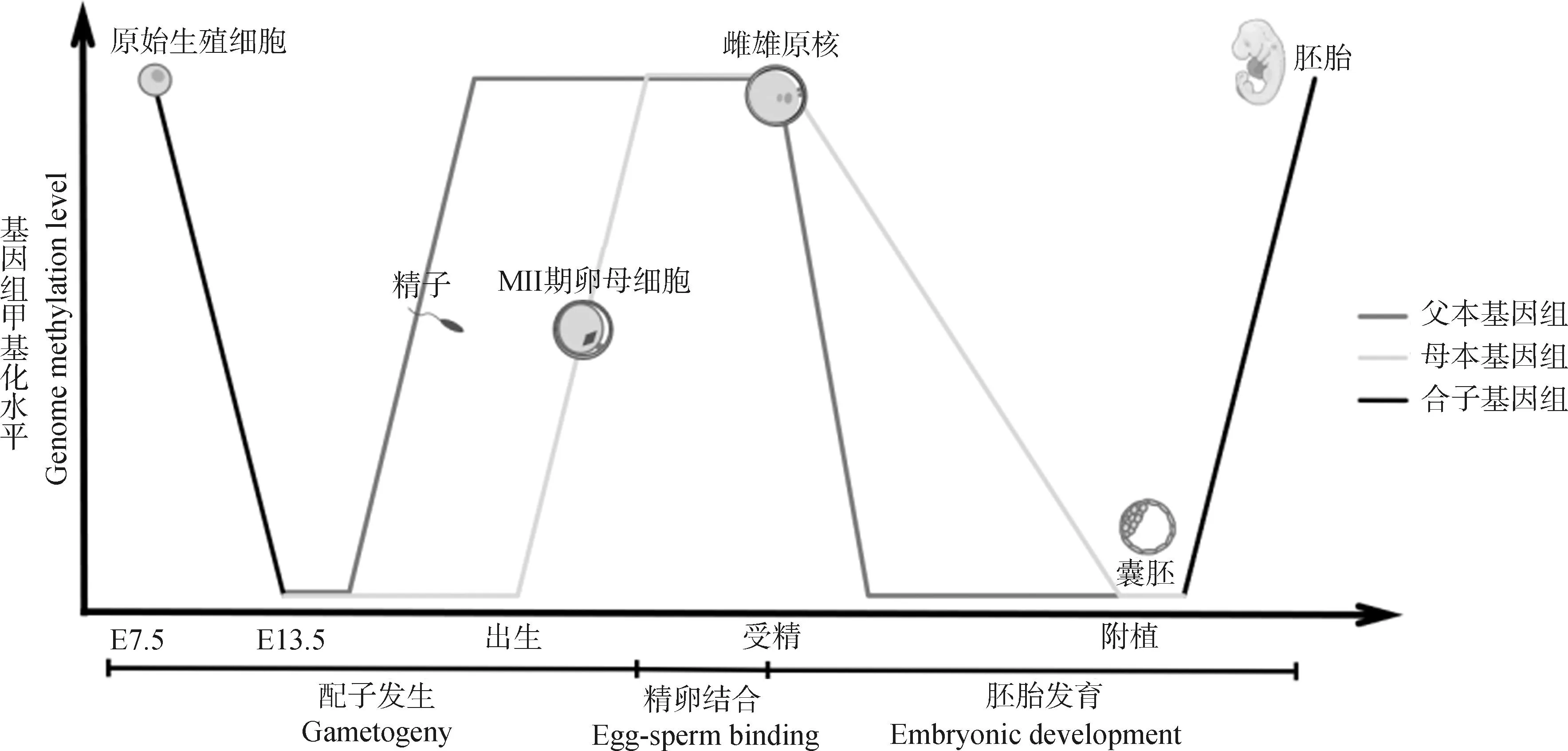
在小鼠早期胚胎第一次卵裂之前,除了印跡控制區(qū)(imprinting control regions,ICRs)和一些逆轉(zhuǎn)錄轉(zhuǎn)座子外,父本與母本基因組都經(jīng)歷了廣泛的主動和被動去甲基化,其中父本基因組的去甲基化過程更加迅速。在受精卵DNA第一次復(fù)制之前,TET3會將DNMT3A和DNMT1新合成的5 mC轉(zhuǎn)化為5-羥甲基胞嘧啶(5-hydroxy-methyl-cytosine, 5hmC),使得父本基因組中5hmC的含量逐漸增加,而5 mC含量急劇減少[3]。相比之下,由于DNMT1無法進入細胞核,母本基因組在DNA復(fù)制的過程中發(fā)生被動去甲基化,甲基化水平變化程度相對于父本基因組較為緩和[3-4],這種變化可能與H3K9me2招募母源因子STELLA有關(guān)[5],但一些新發(fā)現(xiàn)使這種機制的有效性存疑。例如,當缺少STELLA時,由DNMT1介導(dǎo)的從頭甲基化導(dǎo)致小鼠受精卵中5 mC水平顯著升高[6],而STELLA過表達則會導(dǎo)致胚胎干細胞中的DNA低甲基化[7]。因此,STELLA對母體基因組DNA甲基化的保護作用有待進一步驗證。此外,在卵裂過程中,從成熟精子中遺傳而來的父本基因組高CpG甲基化水平迅速下降,表明其發(fā)生主動去甲基化[4]。這一過程由DNA甲基氧化酶Tet1、Tet2或Tet3聯(lián)合胸腺嘧啶DNA糖基化酶(thymine DNA glycosylase, TDG)及DNA堿基修復(fù)途徑共同作用,最終去除5 mC標記[8-9]。與之相反,母本基因組初始甲基化水平較低[10],在隨后的卵裂過程中,由于維持DNA甲基化的酶DNMT1表達降低,母本基因組中新合成的DNA無法被甲基化,5 mC水平隨著細胞分裂而降低,即被動去甲基化[3]。這種差異化的去甲基化模式使得早期胚胎基因組呈現(xiàn)明顯不對稱的甲基化變化模式,并且在一定程度上受到H3K9me3的調(diào)節(jié)[11]。在豬的早期胚胎中,其整體的去甲基化模式呈現(xiàn)與小鼠相似的變化[12],而牛與人類的去甲基化模式更接近[13-14](圖1)。

圖1 不同物種從配子到囊胚的全基因組甲基化的變化(改自文獻[13])Fig.1 Whole-genome methylation changes in various animals from gametes to blastocysts (adapted from[13])
1.2 甲基化的重新建立
在早期胚胎發(fā)育過程中,維持基因組的初始低甲基化狀態(tài)確保了將來分化調(diào)控的準確性,同時也是維持原始多能態(tài)的必要條件。進入囊胚階段后,DNMT3和TET酶的表達共同影響DNA甲基化的重新建立;隨著DNA甲基化水平的增加,胚胎的全能性逐漸消失,并開始出現(xiàn)細胞分化。DNMT3A能夠促進父本DNA甲基化的增加,這與它快速進入雄原核的時間一致;如果父本基因組未能正常建立甲基化,就會導(dǎo)致父本等位基因的表達異常[4]。在牛和豬的胚胎中,除了DNMT3L的轉(zhuǎn)錄物缺失外,DNMT3A、DNMT3B的mRNA以及DNMT1都有明顯表達[13]。TET酶能夠通過將5 mC轉(zhuǎn)變?yōu)?hmC來輕微降低合子基因組的甲基化水平,但是如果缺乏TET酶,胚胎發(fā)育就會停滯在2細胞階段[15]。在豬中,TET3主要存在于卵母細胞和第一卵裂階段,并逐漸被TET1和TET2替代,這與小鼠胚胎發(fā)育中的情況相似[13]。此外,在小鼠中,缺失DNMT1會導(dǎo)致多能性標記無法被正常抑制,而3種TET酶均缺失的細胞表現(xiàn)出造血干細胞調(diào)控缺陷[16],這表明DNA甲基化的動態(tài)變化可能影響早期細胞命運決定。
顯而易見的是,DNA甲基化重編程異常可以導(dǎo)致胚胎發(fā)育障礙甚至死亡。例如,在體細胞核移植(somatic cell nuclear transfer, SCNT)的過程中,由于現(xiàn)有技術(shù)手段難以完全去除供體細胞核中原有的表觀遺傳修飾,克隆胚胎的死亡率通常高于體內(nèi)受精胚胎,其中一個重要的原因是克隆胚胎中的DNA甲基化長時間維持在較高水平[17-18](圖2)。因此,研究SCNT胚胎中異常的DNA甲基化模式及其糾正措施,將有助于加深對于自然受精胚胎基因組甲基化重編程機制的理解。
圖中展示了哺乳動物個體發(fā)育周期中全基因組DNA去甲基化和再甲基化的兩個波。受精后不久,從配子遺傳的甲基化標記被清除,父系基因組經(jīng)歷主動去甲基化,母系基因組經(jīng)歷被動去甲基化。附植后,從頭甲基化建立了最初的胚胎甲基化模式The graph shows the two waves of whole-genome DNA demethylation and re-methylation during the mammalian ontogeny cycle. Shortly after fertilization,methylation markers inherited from gametes are eliminated with the paternal and maternal genome undergoing active and passive demethylation, respectively. After implantation, the initial embryo methylation pattern was established by de novo methylation圖2 哺乳動物發(fā)育過程中DNA甲基化的動態(tài)變化(引自文獻[19])Fig.2 Dynamic changes of DNA methylation during mammalian development (quoted from[19])
2 組蛋白修飾
核小體是染色體結(jié)構(gòu)與功能的基本單位,由一個組蛋白八聚體、連接組蛋白H1和約150 bp的DNA構(gòu)成。組蛋白八聚體由H2A、H2B、H3和H4各兩個分子組成,其N末端突出于核小體外,可發(fā)生多種蛋白質(zhì)翻譯后修飾,包括甲基化、乙酰化、磷酸化、泛素化、類泛素蛋白化、ADP-核糖基化以及生物素化等,本文將主要討論在胚胎發(fā)育過程中最為重要的兩種修飾:組蛋白甲基化和乙酰化。這些修飾可以影響轉(zhuǎn)錄因子與染色質(zhì)的結(jié)合,進而調(diào)控發(fā)育相關(guān)基因的表達。在附植前胚胎的發(fā)育過程中,父系和母系遺傳的組蛋白修飾會經(jīng)歷不同的重編程過程:父源組蛋白修飾通常在受精卵DNA復(fù)制之前被快速清除,而母源組蛋白修飾則有部分通過母源遺傳而得以保留。
2.1 H3K4me3
H3K4me3是組蛋白第三亞基四號賴氨酸的三甲基化,主要由混合系白血病(mixed lineage leukeMia, MLL)蛋白家族的組蛋白賴氨酸甲基轉(zhuǎn)移酶(histone methyltransferase,HKMTs)催化,包括MLL1~MLL4、SET1A和SET1B[20-23],能夠促進染色質(zhì)維持松散狀態(tài),從而活化發(fā)育相關(guān)基因的啟動子。精卵結(jié)合后,小鼠父本基因組中的H3K4me3水平迅速降低,在合子基因組激活(zygotic genome activation, ZGA)期間逐漸恢復(fù),并在胚胎植入后達到與母本基因組相似的水平[5];而在小鼠的母本基因組中,啟動子和遠端位點存在大量非典型H3K4me3(noncanonical H3K4me3, ncH3K4me3)[24-25]。這些非典型標記與成熟卵母細胞中部分DNA甲基化區(qū)域重疊[26];直到受精卵的ZGA主波階段,ncH3K4me3才被典型H3K4me3替換,并在4細胞時期基本消失[24]。ncH3K4me3水平的變化似乎僅出現(xiàn)在卵母細胞和早期胚胎中,其調(diào)控可能與多種組蛋白去甲基化酶(lysine(K)demethylase, KDM)有關(guān)。例如,KDM5A和KDM5B過表達會激活成熟卵母細胞的轉(zhuǎn)錄組,而KDM5A敲降會導(dǎo)致胚胎發(fā)育異常[27]。近期另一項研究指出,牛早期胚胎中組蛋白去甲基化酶KDM5A、KDM5B和KDM5C的缺失均會增加H3K4me3水平,從而降低8/16細胞期胚胎的發(fā)育率[28]。在豬附植前胚胎中,KDM5B表達與H3K4me3去甲基化有關(guān),其敲低不僅會增加H3K4me3水平,還會破壞囊胚期H3K4me3與H3K27 me3的平衡,這表明KDM5B對早期胚胎H3K27 me3重編程至關(guān)重要[29]。上述研究表明,ncH3K4me3可能引起胚胎基因組沉默,但在豬SCNT胚胎中,存在過量H3K4me3的位點似乎并未出現(xiàn)基因表達異常,表明豬可能存在不同的機制維持這些位點的轉(zhuǎn)錄[9]。此外,在小鼠的父本基因組中還存在一類富集于拓撲關(guān)聯(lián)域(topologically associating domains,TADs)的穩(wěn)定的H3K4me3,其與ZGA期間胚胎轉(zhuǎn)錄激活有關(guān)。考慮到CCCTC結(jié)合因子(CCCTC-binding factor, CTCF)在染色質(zhì)高級結(jié)構(gòu)的形成中具有重要作用[30],這類穩(wěn)定的H3K4me3可能通過對TADs中的CTCF結(jié)合位點提供正向調(diào)控,進一步促進染色質(zhì)高級結(jié)構(gòu)的形成,從而促進胚胎的轉(zhuǎn)錄激活[31]。
在2細胞階段,典型H3K4me3在啟動子區(qū)建立[31],啟動子區(qū)廣泛的H3K4me3標記可能有助于關(guān)鍵細胞類型特異性因子的穩(wěn)定轉(zhuǎn)錄[32]。這一過程的調(diào)控機制可能涉及多種信號分子。最近的研究顯示,在小鼠胚胎干細胞中,Dppa3敲降會導(dǎo)致H3K4me3水平下降,并對異染色質(zhì)標記物(如H3K9me3和H3K27 me3)也產(chǎn)生負調(diào)節(jié)作用,表明Dppa3可能參與促進包括H3K4me3在內(nèi)的表觀遺傳重塑[7]。另外,由于DNMT的功能與SAM密切相關(guān),SAM由甲硫氨酸經(jīng)甲硫氨酸腺苷轉(zhuǎn)移酶(methionine adenosyltransferase, MAT)催化生成[33],因此MAT可能間接影響組蛋白甲基化水平。在哺乳動物中,MAT存在3種不同的表達形式,分別是MAT1A、MAT2A和MAT2B[34]。在小鼠胚胎中敲降MAT2A并未顯著改變H3K4me3和H3K9me3水平,盡管這會使胚胎發(fā)育停滯在2細胞期[35],這可能與受精卵胞質(zhì)中的母源性SAM尚未完全消耗有關(guān)。此外,共激活因子相關(guān)的精氨酸甲基轉(zhuǎn)移酶1(coactivator-associated arginine methyltransferase 1, CARM1)可以催化H3第26位精氨酸殘基的對稱性二甲基化(H3R26 me2s)[36],當CARM1被抑制時,小鼠附植前胚胎中的H3K4me3水平降低[37],牛和豬的早期胚胎也顯示出類似結(jié)果[38-39],這可能是由于CARM1影響了核組織結(jié)構(gòu),并且對染色質(zhì)結(jié)構(gòu)有重要作用[40]。WD重復(fù)蛋白5(WD repeat-containing protein 5, WDR5)作為MLL/SET甲基轉(zhuǎn)移酶復(fù)合物的中心成分,在豬的早期胚胎發(fā)育過程中起到重要作用。WDR5敲降會增加H3K4me3水平,并導(dǎo)致囊胚質(zhì)量下降和胚胎發(fā)育潛力減弱[41]。雖然MLL3可能介導(dǎo)了WDR5蛋白對H3K4me3的調(diào)節(jié)作用,但是MLL3缺失并不影響小鼠早期胚胎中H3K4me3水平或HKMTs活性,這表明WDR5與催化H3K4me3相關(guān)的HKMTs之間的關(guān)系仍需進一步闡釋[42]。
2.2 H3K27me3
H3K27me3是一種由多梳抑制復(fù)合體2(polycombrepressive complex 2,PRC2)催化的甲基化修飾,它主要富集于母本基因組上,能夠抑制編碼多能性因子、發(fā)育因子和譜系特異性轉(zhuǎn)錄因子等基因的表達[43-44]。例如,在哺乳動物克隆胚胎中,H3K27me3異常高表達導(dǎo)致重編程不完全和胚胎發(fā)育障礙。小分子抑制劑GSK126能夠特異性抑制EZH2的甲基化功能,另一個小分子抑制劑GSK-J4能夠特異性抑制KDM6B,有研究表明,經(jīng)過低濃度(0.1 μmol)GSK126抑制H3K27甲基化酶處理后,豬的克隆胚胎中H3K27me3水平顯著降低,同時囊胚率也有所提高,而相同濃度GSK-J4抑制去甲基化酶處理的豬胚呈現(xiàn)相反的變化[45]。卵母細胞中PRC1介導(dǎo)的組蛋白H2A賴氨酸119位點單泛素化(H2AK119ub1)修飾也參與了H3K27me3在受精卵中的遺傳[46]。在小鼠早期胚胎發(fā)育過程中,遺傳自配子的H3K27me3早在PN5時期就出現(xiàn)廣泛的丟失,直到植入后才重新建立[47]。這一過程涉及父本基因組中H3K27me3的整體去除和母本基因組上啟動子區(qū)域H3K27me3的選擇性去除[5]。而在豬早期胚胎發(fā)育過程中,從1細胞期到桑椹胚階段,H3K27me3豐度逐步下降至最低水平,但在孵化后的囊胚中重新增加[48]。有研究指出,在小鼠胚胎單細胞期后,啟動子區(qū)域富集了H2AK119ub1修飾,并可能促進了多梳結(jié)構(gòu)域的形成和H3K27me3的重新建立[49,46]。然而,在去除H2AK119ub1后,4細胞期前并未出現(xiàn)H3K27me3的明顯減少[50],表明H3K27me3和H2AK119ub1在小鼠早期胚胎重編程中的相互作用值得進一步研究。此外,H3K27me3的水平與組蛋白甲基化轉(zhuǎn)移酶PRC2和組蛋白去甲基化酶KDM6A的動態(tài)變化相一致[51-52]。例如,在牛和豬的SCNT胚胎中,過表達KDM6A可以降低過高的H3K27me3水平從而提高SCNT胚胎的重編程效率[53]。在豬的胚胎中,過表達KDM4A有利于降低SCNT胚胎的H3K27me3水平,而KDM5B的缺失也可能通過影響KDM6A的表達而降低H3K27me3的豐度[9,29]。總之,雖然H3K27me3及其相關(guān)酶在胚胎重編程中的具體作用機制還不清楚,但已有研究證明了H3K27me3對于維持和改變?nèi)旧|(zhì)狀態(tài)的重要性。
2.3 H3K9me3
H3K9me3修飾在小鼠植入前胚胎中調(diào)控重復(fù)序列元件和部分蛋白編碼基因的表達。與H3K4me3和H3K27me3不同的是,H3K9me3主要富集于早期胚胎中的LTR,這表明其可能參與LTR的調(diào)節(jié)[54]。在2細胞期,雙親基因組中從頭建立的H3K9me3結(jié)構(gòu)域顯著增多,但在LTR與啟動子上呈現(xiàn)出不同模式:LTR上以H3K9me3標記的區(qū)域逐漸增多并維持在較高水平,而啟動子上的H3K9me3結(jié)構(gòu)域則在受精后減少,在植入后恢復(fù),表明不同位點上存在不同的機制調(diào)控H3K9me3的重編程[54]。此外,在牛的受精卵中,親本基因組上的H3K9me3呈不對稱分布,并且在雌原核上水平更高[55]。這說明親代之間不對稱的組蛋白信號既可能源于配子的表觀遺傳,也可能受合子階段的重編程影響。
H3K9me3通常被認為是細胞命運變化的障礙之一,因為它可以阻止轉(zhuǎn)錄因子Oct4、Sox2、Klf4、c-Myc與胚胎干細胞中一些涉及多能性的染色質(zhì)區(qū)域結(jié)合,并且抑制附植前胚胎中富含CpG的基因組位點發(fā)生去甲基化,從而阻礙正常的重編程進程[11,56-57]。H3K9me2/3由組蛋白甲基轉(zhuǎn)移酶GLP、G9a催化形成,與異染色質(zhì)蛋白1(heterochro matin protein 1, HP1)的染色質(zhì)結(jié)構(gòu)域結(jié)合,從而促進胚胎干細胞中異染色質(zhì)的形成。而在構(gòu)建克隆胚胎時,H3K9me3重編程不完全會導(dǎo)致早期克隆胚胎囊胚發(fā)育率降低[58-59]。因此,調(diào)控H3K9me3修飾水平對于提高克隆效率具有重要意義。研究表明,在小鼠和豬等物種中,過表達KDM4d、KDM4e或敲降供體細胞中的Suv39h1/h2(H3K9me3甲基轉(zhuǎn)移酶)均可降低H3K9me3對發(fā)育基因轉(zhuǎn)錄的抑制[59-62]。本課題組前期研究發(fā)現(xiàn),在牛的早期胚胎中,microRNA-125b通過直接結(jié)合SUV39H1,從而抑制其表達產(chǎn)物介導(dǎo)的H3K9me3生成[63];在羊早期克隆胚胎中,注射人源重組KDM4d蛋白也可以降低H3K9的甲基化水平[64]。但在豬早期克隆胚胎中,KDM4d的過表達并不能改變高H3K9me3修飾狀態(tài)[62],而過表達KDM4A則能顯著增加豬早期克隆胚胎的囊胚率[62,65]。敲除KDM4A會導(dǎo)致H3K4me3所屬位點被異常的H3K9me3入侵,使得大多數(shù)修飾的基因表達下調(diào),表明KDM4A對H3K9me3的去甲基化是確保合子基因在ZGA期間正確激活的必要機制[66]。另一方面,盡管過表達KDM4b有利于提高克隆效率[61],但注射過高劑量的KDM4b mRNA會抑制滋養(yǎng)外胚層(trophectoderm, TE)的分化[67],這表明H3K9me3在適度水平上的維持對于保障胚胎的正常發(fā)育至關(guān)重要[5]。值得注意的是,有研究指出,在附植前胚胎中,由SUV39H2催化從頭合成的H3K9me3不具有調(diào)控整體基因表達水平的作用,且為非抑制性標記;隨著卵裂的進行,親本基因組間的轉(zhuǎn)錄活性差異逐漸消失,表明早期的H3K9me3標記在發(fā)育后期傾向于產(chǎn)生抑制作用[68](圖3)。

小鼠胚胎中全基因組沉默從配子發(fā)育晚期開始,一直持續(xù)到ZGA時期。卵母細胞中ncH3K4me3、H3K27me3與H3K9me3的廣泛結(jié)構(gòu)域可遺傳至胚胎,其中ncH3K4me3在ZGA之前被H3K4從頭甲基化取代,H3K27me3可維持至囊胚期并最終被重編程為其典型模式,H3K9me3則被重編程為非典型形式并一直持續(xù)到囊胚期。父源性組蛋白修飾H3K4me3、H3K27me3與H3K9me3則在2細胞期前被從頭甲基化的廣泛結(jié)構(gòu)域取代,其中H3K4me3在ZGA前被重編程為典型模式,H3K27與H3K9的甲基化結(jié)構(gòu)域則可以維持到囊胚,并在附植后重編程為典型模式In mouse eggs, genome-wide silencing begins during late gametogenesis and lasts until ZGA. Broad domains of maternal ncH3K4me3, H3K27me3 and H3K9me3 are inherited to the embryo, where ncH3K4me3 is replaced by H3K4 de novo methylation before ZGA, H3K27me3 persists until blastocyst and is eventually reprogrammed to its canonical pattern, and H3K9me3 is reprogrammed to a noncanonical form and maintains until blastocyst. Paternal histone modifications H3K4me3, H3K27me3 and H3K9me3 are replaced by broad domains of de novo methylation before 2-cell stage, where H3K4me3 is reprogrammed to a canonical pattern before ZGA, while H3K27 and H3K9 methylation domains endure until blastocyst and are reprogrammed to canonical patterns after implantation圖3 小鼠早期胚胎發(fā)育過程中的H3組蛋白甲基化變化(改自文獻[69])Fig.3 Changes in H3 histone methylation during early mouse embryo development (adapted from[69])
2.4 組蛋白乙酰化
組蛋白乙酰化是一種發(fā)生在組蛋白N端賴氨酸殘基的ε-氨基上的表觀遺傳修飾,主要集中在H3和H4組蛋白上[70]。組蛋白乙酰化在基因轉(zhuǎn)錄、DNA復(fù)制及細胞周期調(diào)控等方面發(fā)揮著重要作用。通常情況下,組蛋白乙酰化如H3K122ac和H3K64ac與轉(zhuǎn)錄激活有關(guān),而組蛋白去乙酰化與基因沉默相關(guān)[71]。根據(jù)Ziegler-Birling等[72]的研究,在附植前胚胎發(fā)育過程中,3個關(guān)鍵的組蛋白乙酰化位點(H3K56、H3K64、H3K122)均有表達,但是表現(xiàn)出不同的重編程模式。其中,H3K56ac和H3K64ac在附植前便富集于核心核小體中,而H3K122ac雖然在成熟卵母細胞中存在,但水平極低,這可能與增強子使用或調(diào)節(jié)頻率較低有關(guān)。
組蛋白乙酰化與去乙酰化分別由兩種作用相反的酶進行調(diào)控,即組蛋白乙酰化轉(zhuǎn)移酶(histone acetyltransferases, HATs)和組蛋白去乙酰化酶(histone deacetylases, HDACs)。HATs通過乙酰輔酶將一個乙酰基連接到賴氨酸側(cè)鏈的ε-氨基上,從而中和了賴氨酸的正電荷,降低了組蛋白和DNA結(jié)合的緊密程度,使染色質(zhì)結(jié)構(gòu)松弛,便于轉(zhuǎn)錄因子結(jié)合。與之相反,HDACs去除組蛋白尾部乙酰化修飾后,賴氨酸的正電荷恢復(fù),使得染色質(zhì)結(jié)構(gòu)重新穩(wěn)定[73]。在小鼠受精卵中,H3K27ac等組蛋白乙酰化位點在雌雄原核中大量存在,其信號在ZGA主波發(fā)生前急劇減弱。這種過程在牛、豬等多個物種的早期胚胎中均有發(fā)生,表明組蛋白乙酰化對于哺乳動物早期胚胎的正常發(fā)育具有重要意義[74-77]。在小鼠和牛的早期胚胎中,HDAC1與HDAC2是高度同源且表達量最高的兩種組蛋白去乙酰化酶。盡管相比于HDAC1對附植前胚胎的重要作用而言,HDAC2主要調(diào)控卵母細胞的正常發(fā)育,但二者對早期胚胎發(fā)育的調(diào)控呈現(xiàn)出互補作用[74,78]。單獨敲降HDAC1或HDAC2均不會對小鼠附植前胚胎發(fā)育產(chǎn)生明顯影響,但當兩者均被敲降后,小鼠胚胎發(fā)育停滯在桑椹胚期。這可能是由于高乙酰化水平導(dǎo)致TRP53上調(diào)、TE與內(nèi)細胞團(inner cell mass, ICM)譜系特異性分化受阻,以及全基因組DNA甲基化水平升高的共同作用所致[79]。此外,HDACs還可以將廣泛分布的H3K27ac還原成典型分布模式,從而通過阻止發(fā)育基因過早表達確保ZGA的正常進行[80]。綜上所述,在囊胚前階段,通過直接或間接地調(diào)控胚胎干細胞譜系特異性分化、DNA甲基化等過程,組蛋白乙酰化模式對于維持正常的胚胎發(fā)育至關(guān)重要。
3 染色質(zhì)開放性
染色質(zhì)開放性(chromatin accessibility)又稱為染色質(zhì)可及性。在真核細胞的細胞核中,DNA與組蛋白結(jié)合形成核小體,并經(jīng)過進一步折疊在細胞核中形成高度壓縮的染色質(zhì),這對DNA的復(fù)制與表達有一定的限制作用。開放的染色質(zhì)在早期胚胎發(fā)育過程中發(fā)揮重要的調(diào)控作用,不僅影響ZGA的進程,還參與細胞命運決定與譜系特異性分化。
早期胚胎的發(fā)育過程伴隨著染色質(zhì)開放性的顯著變化,不同物種的早期胚胎也呈現(xiàn)出不同的染色質(zhì)可及性重編程模式。例如,小鼠受精卵中較高的染色質(zhì)可及性在1細胞期末期降低,然后在2~4細胞期重新升高[16]。在牛的早期胚胎中,2~4細胞期胚胎的染色質(zhì)可及性較低,但在8細胞期明顯增高[81]。精卵結(jié)合后,父本基因組上包裹的魚精蛋白被置換為組蛋白,雄原核的染色質(zhì)相對于雌原核更加緊密,呈現(xiàn)出不對稱的染色質(zhì)開放模式[82]。隨后父本染色質(zhì)被迅速重編程,在PN3期與母本基因組的染色質(zhì)開放性接近。這個過程與親本基因組之間DNA甲基化和組蛋白修飾的重編程模式非常不同[83],這種差異的產(chǎn)生可能與不同表觀遺傳方式的來源有關(guān)。在小鼠2細胞期自然受精胚胎中,轉(zhuǎn)錄因子Nfya促進了ZGA的發(fā)生,以及開放染色質(zhì)在活躍轉(zhuǎn)錄基因啟動子和轉(zhuǎn)錄起始位點的建立[82,84];同時逆轉(zhuǎn)錄轉(zhuǎn)座子LINE1的表達也高度上調(diào),過早敲降或長時間激活LINE1都會對染色質(zhì)可及性的正常形成產(chǎn)生不利影響[85]。在8細胞期染色質(zhì)開放性變化最為劇烈,此時Oct4表達也高度上調(diào),表明Oct4可能促進染色質(zhì)開放[82]。除此以外,還有多種因素被認為參與早期胚胎松弛染色質(zhì)結(jié)構(gòu)的形成,包括轉(zhuǎn)錄因子DUX、染色質(zhì)組裝因子CAF-1等[86-88]。這些研究揭示了復(fù)雜的染色質(zhì)開放性調(diào)控網(wǎng)絡(luò),但其潛在的調(diào)控機制以及各種因素間的相互關(guān)系仍需進一步研究。
除了轉(zhuǎn)錄因子外,表觀遺傳修飾也被證明與染色質(zhì)開放性有關(guān)。一般來說,去甲基化或具有中等程度羥甲基化水平的DNA以及乙酰化的組蛋白通常具有更高的可及性[84,89]。在小鼠原始生殖細胞中,H3K4me3標記的區(qū)域比H3K27ac位點的染色質(zhì)具有更高的開放性,而H3K27me3與染色質(zhì)開放性關(guān)聯(lián)較弱[84]。在牛早期胚胎中,microRNA-125b過表達導(dǎo)致H3K9me3水平降低,并伴隨著異染色質(zhì)的松弛[63]。上述研究表明,在哺乳動物早期胚胎中,DNA甲基化和組蛋白修飾協(xié)同參與染色質(zhì)開放性重編程的正常進行。
4 染色質(zhì)三維結(jié)構(gòu)
真核細胞中,染色質(zhì)形成復(fù)雜而有序的三維結(jié)構(gòu),包括染色質(zhì)疆域(chromosome territories)、區(qū)室(compartments)、拓撲關(guān)聯(lián)域(topologically associating domains,TADs)、染色質(zhì)環(huán)等層級[90-91]。染色質(zhì)疆域是指不同的染色質(zhì)在核內(nèi)折疊并占據(jù)的特定區(qū)域;區(qū)室是指具有相似基因表達活性的染色質(zhì)區(qū)域,分為活性區(qū)室和惰性區(qū)室;TADs是指染色質(zhì)上一段線性連續(xù)且內(nèi)部相互作用更為頻繁的區(qū)域;染色質(zhì)環(huán)是指由CTCF和cohesin蛋白介導(dǎo)的DNA上的環(huán)狀結(jié)構(gòu),通常包含調(diào)控元件如啟動子、增強子和沉默子等[91]。這些染色質(zhì)三維結(jié)構(gòu)在受精后也經(jīng)歷了顯著的重編程。精子基因組中與體細胞相似的TADs和區(qū)室在魚精蛋白被置換后消失,卵母細胞基因組中原先存在的三維結(jié)構(gòu)也在卵泡發(fā)育的過程中逐漸均一化,受精后兩個親本基因組都呈現(xiàn)相似的松散狀態(tài)[92-94]。隨著小鼠早期胚胎發(fā)育,受精卵中分散的染色質(zhì)逐漸形成且聚集成致密的區(qū)塊,并在核膜附近堆積,在8細胞期出現(xiàn)了較為典型的區(qū)室和TAD結(jié)構(gòu)[94-95]。值得注意的是,父本基因組中的染色質(zhì)區(qū)室更加明顯,而母本基因組上則幾乎不存在,表明染色質(zhì)高級結(jié)構(gòu)重編程具有等位基因特異性,這與DNA甲基化和組蛋白修飾類似[92-93]。在豬的早期胚胎中,拓撲關(guān)聯(lián)域等三維結(jié)構(gòu)以與小鼠相似的模式在附植前建立[96]。綜上所述,受精后染色質(zhì)結(jié)構(gòu)高度松弛,之后隨著早期胚胎發(fā)育而緩慢地重新變得緊密,但是誘導(dǎo)染色質(zhì)折疊的因素有待更深入研究。
與染色質(zhì)開放性類似,早期胚胎染色質(zhì)三維結(jié)構(gòu)的重編程與表觀遺傳修飾的重編程密切相關(guān)。例如,基因組整體低甲基化水平的狀態(tài)與染色質(zhì)結(jié)構(gòu)重塑在時間上重合,且活性區(qū)室中DNA去甲基化速率大于惰性區(qū)室[10,92]。同時,非典型的組蛋白標記也逐漸被典型標記替代[97]。這些現(xiàn)象表明,表觀遺傳修飾可能是調(diào)控染色質(zhì)三維結(jié)構(gòu)重編程的重要因素。但是,這種調(diào)控是否必需?是否有特定的分子機制將這兩種過程耦合起來?這些問題有待進一步研究。
5 展 望
在哺乳動物早期胚胎的發(fā)育過程中,親本基因組經(jīng)歷了多種表觀修飾的重編程,包括DNA去甲基化、組蛋白修飾重塑、染色質(zhì)開放性增加以及染色質(zhì)高級結(jié)構(gòu)的變化。近期的研究揭示了這些重編程過程的潛在調(diào)控機制,然而許多這樣的機制有待進一步研究與驗證。早期哺乳動物胚胎發(fā)育中與全能性轉(zhuǎn)變和細胞命運決定之間相互作用的分子細節(jié),將是未來研究的一個重要方向。
早期胚胎發(fā)育過程中的表觀遺傳重編程是一個精細調(diào)控的過程。隨著基因組學(xué)技術(shù)的不斷深入發(fā)展,研究者對附植前發(fā)育的表觀遺傳重編程景觀的理解有了很大的提高。然而,重編程是如何在不同的基因組位點上被調(diào)控的仍然是未知的。對這些因素和潛在機制的識別將提高人們對細胞命運轉(zhuǎn)變和哺乳動物早期胚胎發(fā)育的理解。盡管基因組學(xué)技術(shù)的發(fā)展提高了人們對表觀遺傳重編程景觀的認識,但是不同基因組位點上重編程的調(diào)控機制仍不清楚。未來研究需要采用多組學(xué)方法來闡明表觀遺傳重編程與全能性轉(zhuǎn)變和細胞命運決定之間的分子聯(lián)系。
表觀遺傳重塑的機制在不同物種中遵循相似的模式,但在一些細節(jié)上有所不同。揭示不同哺乳動物早期胚胎發(fā)育的表觀遺傳調(diào)控機制將是一個重要的研究領(lǐng)域,其結(jié)果將有助于體細胞核移植技術(shù)的發(fā)展,進而提高良種畜禽種質(zhì)資源的利用效率。遺憾的是,目前大多數(shù)研究集中在小鼠與人類的早期胚胎,而其它家畜早期胚胎重編程的研究則相對較少。隨著單細胞多組學(xué)技術(shù)的發(fā)展,以及單細胞轉(zhuǎn)錄組、染色質(zhì)組圖譜的繪制,表觀遺傳研究已逐漸深入到單細胞水平,這有助于更微觀地解析其作用機理[98]。這些突破也可能為附植前胚胎發(fā)育的研究提供新的見解。

