左歸丸上調ALKBH5對小鼠BMSCs成骨分化的作用
劉慧雯 劉昊 尚奇 陳桂鋒 陳弘林 伍子賢 余富勇 顏先偉 秦威城 沈耿楊 任輝* 江曉兵*
1.廣州中醫藥大學,廣東 廣州 510405 2.廣州中醫藥大學嶺南醫學研究中心,廣東 廣州 510405 3.黔西南州中醫醫院,貴州 黔西南州 562499 4.廣州醫科大學附屬第二醫院,廣東 廣州 510260
骨髓來源的間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)是多功能祖細胞,可以自我更新并分化成不同的細胞譜系包括成骨細胞、軟骨細胞和脂肪細胞發揮功能[1],關于BMSCs分化方向的調控一直以來都是骨修復研究的熱點。烷基化修復同系蛋白5(ALKBH5)是一種關鍵的RNA去甲基化酶,現有對 ALKBH5影響成骨分化的機制研究結論不一[2-3],其作用仍存在爭議。左歸丸出自《景岳全書》,是滋陰補腎、益精填髓的代表方藥。現有研究表明,左歸丸能夠改善年齡相關性骨質流失,在參與骨形成、促進骨修復方面具有一定的潛能[4-5],然其在細胞和分子水平上的作用機制尚未完全闡明。左歸丸對ALKBH5的影響尚不明確。因此,本研究擬從去甲基化酶ALKBH5探討左歸丸對小鼠BMSCs成骨分化的作用,以期為左歸丸應用于臨床防治骨質疏松癥提供一定的理論依據。
1 材料與方法
1.1 實驗動物
2月齡C57BL/6小鼠22只,SPF級,體重20~25 g,雌性,由廣州中醫藥大學實驗動物中心提供[動物使用許可證號SYXK(粵)2018-0092]。
1.2 實驗藥物
左歸丸(熟地黃24 g、山藥12 g、枸杞子12 g、山萸肉12 g、川牛膝9 g、菟絲子12 g、鹿角膠12 g、龜甲膠12 g,參考《藥典2020》標準),藥物均購于廣州中醫藥大學第一附屬醫院。
1.3 主要試劑及儀器
β-甘油磷酸鈉(BGP)(Merck公司,G9244-50G),維生素C(Solarbio公司,A8100),胎牛血清(Cyagen公司,FBSAD-01011-500),地塞米松(Aladdin公司,50-02-2D),α-MEM培養基(Servicebio公司,G4551-500),BCIP/NBT堿性磷酸酶顯色試劑盒(Beyotime公司,C3206),茜素紅染色液(Cyagen公司,ALIR-10001),RT-qPCR試劑盒(TAKARA公司,RR420 L),EvoM-mLV反轉錄試劑(艾科瑞公司,AG11706),RIPA裂解液(Solarbio公司,R0020),siRNA(銳博生物公司,siG2207050849395006)、riboFECTTMCP Transfection Kit(166T)(銳博生物公司,C10511-05)、ALKBH5抗體(Affinity公司,DF2585),BMP4抗體(Abcam公司,ab39973),RUNX2抗體(CST公司,12556),BMP2抗體(Abcam公司,ab14933),HRP羊抗兔IgG(Affinity公司,S0001)、HRP羊抗鼠IgG(Affinity公司,S0002),全波長酶標儀、超凈工作臺、CO2細胞培養箱(美國Therom公司)、Western blot電泳轉膜系統(美國Bio-Rad公司)、實時熒光定量PCR儀(美國Bio-Rad公司,CFX96型)。
1.4 實驗方法
1.4.1藥物制備:左歸丸:熟地、山藥、枸杞子、山萸肉、川牛膝、菟絲子煎煮、過濾、濃縮至5000 mL時加入鹿角膠和龜膠烊化,液氮冷凍、凍干機-50℃干燥、粉碎后低溫干燥保存凍干粉。將左歸丸凍干粉用PBS溶解,過濾備用。成骨誘導液:維生素C:88.6 mg+10 mL PBS;BGP:4.32 g+10 mL PBS;地塞米松:19.623 mg+10 mL無水乙醇。-20℃保存。過濾備用,使用時終濃度:維生素C:8.86 μg/mL,BGP:4.32μg/mL,地塞米松:0.196 μg/mL。
1.4.2細胞提取與培養:BMSCs分離、培養和傳代 2月齡C57BL/6小鼠2只,脫頸椎處死后置于75%乙醇中5 min,分離雙下肢股骨和脛骨,無菌條件下暴露骨髓腔,用完全培養基沖洗骨髓腔,隨后將沖洗液輕輕吹打混勻,無菌培養瓶中培養,置于37℃、5%CO2細胞培養箱中,待生長至80%融合度時進行傳代。細胞傳至第3代時鋪板,進行后續干預。
1.4.3細胞轉染:采用設計合成的siRNA轉染小鼠BMSCs,以1.5×104個/cm2的密度將小鼠BMSCs接種于6孔板中,待6孔板內的細胞融合度達30%~50%時開始轉染。以riboFECTTMCP Reagent 轉染siRNA于6孔板。配制轉染復合物,過程中輕輕混勻,室溫孵育0~15 min。將轉染復合物逐滴加入適量無雙抗的成骨誘導培養基中輕輕混勻。細胞置于37℃、5%CO2培養箱中培養48 h后通過RT-qPCR法檢測其沉默效率。按相同操作構建空載體轉染的對照組(si-NC),ALKBH5沉默成功后,應用左歸丸混懸液(1000 μg/mL)干預。
1.4.4ALP與ARS染色:將小鼠BMSCs按6000個/mL種入48孔板中。①用配置好的成骨誘導培養基分別干預0、3、7 d;②對照組用含10%FBS的α-MEM完全培養基進行干預,實驗組細胞加入1000 μg/mL濃度的左歸丸混懸液進行干預,放置于恒溫培養箱中7 d。③細胞分組:對照組(si-NC)、左歸丸組(si-NC+ZGW)、沉默組(si-ALKBH5)、沉默+左歸丸組(si-ALKBH5+ZGW)。對對數生長期的細胞進行siALKBH5轉染,構建ALKBH5沉默的小鼠BMSCs,同時構建空載體轉染對照組,左歸丸混懸液(1000 μg/mL)在轉染48 h后加入,放置于恒溫培養箱中3 d。準備染色時,PBS輕柔洗滌,4%多聚甲醛固定、PBS洗板,將孔板置于室溫中分別以ALP染色液和茜素紅染色液染色,PBS洗滌3次。染色后用掃描儀拍攝。
1.4.5RT-qPCR檢測:①成骨誘導培養基干預小鼠BMSCs 0、3、7 d;②參照1.4.3分別用si-ALKBH5和si-NC轉染細胞48 h。上述樣本用Trizol法提取BMSCs的RNA。測量RNA濃度,-80℃保存。將提取的RNA樣品按1 μg/20μL體系配制反應溶液,反轉錄得到cDNA模板。12.5 μL/孔TB Green Premix Ex Taq(2×)及2 μL/孔cDNA,上、下游引物各0.5 μL,并參照25 μL體系配平后按SYBR法開始RT-qPCR反應程序。引物由生工生物工程股份有限公司合成,引物序列見表1。
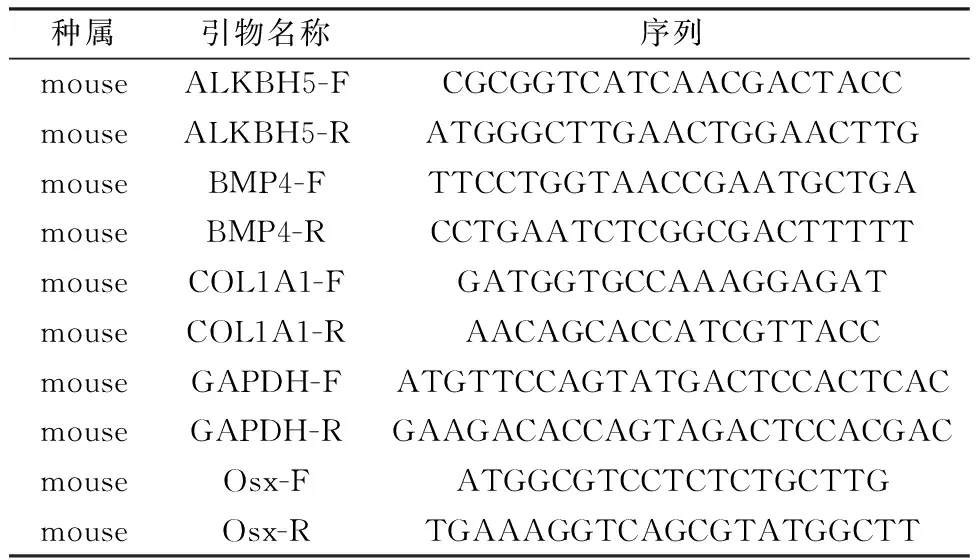
表1 RT-qPCR引物序列Table 1 Primer sequence of RT-qPCR
1.4.6Western-blotting(WB)檢測:①成骨誘導培養基干預小鼠BMSCs 0、3、7 d,檢測各組ALKBH5、BMP4蛋白表達。②空白組BMSCs不做處理,藥物組用左歸丸混懸液(1000 μg/mL)干預7 d,檢測兩組ALKBH5、Runx2蛋白表達。③將細胞隨機分為對照組(si-NC)、左歸丸組(si-NC+ZGW)、沉默組(si-ALKBH5)、沉默+左歸丸組(si-ALKBH5+ZGW),參照1.4.3分別用si-ALKBH5和si-NC轉染細胞48 h,而后用左歸丸混懸液(1000 μg/mL)干預3 d,檢測各組ALKBH5、BMP2蛋白表達。裂解細胞提取蛋白,BCA法測定濃度。加入5×loading buffer,100℃變性10 min,上樣。電泳、轉膜、封閉、洗膜。一抗4℃孵育過夜,室溫下二抗孵育1 h,洗膜,最后顯影分析。
1.5 統計學處理
采用Graphpad Prism 8.0統計軟件對本研究數據進行分析。本研究數據均為計量資料,實驗數據以均數±標準差表示,各組間比較應用獨立樣本t檢驗分析,P<0.05為差異具有統計學意義。
2 結果
2.1 小鼠BMSCs成骨分化過程中ALKBH5的表達
ALP染色結果顯示,隨著時間延長,ALP染色逐漸深染,成骨誘導液成功誘導mBMSCs成骨分化。見圖1。
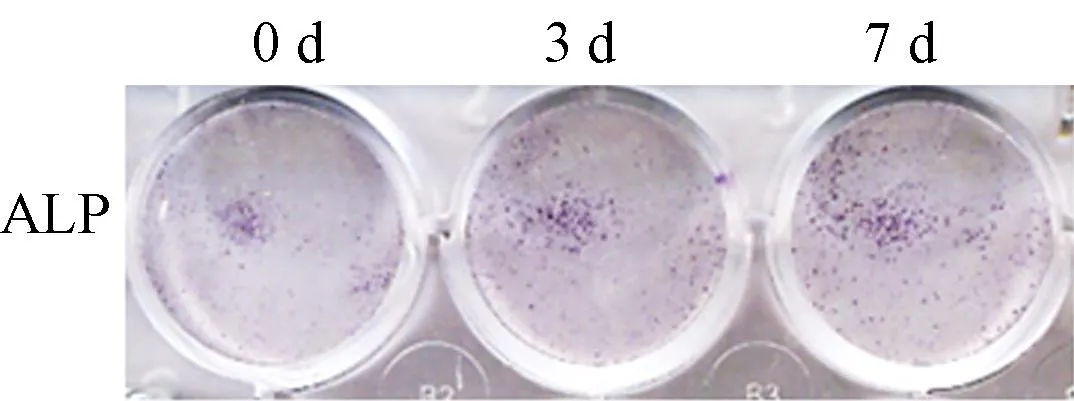
圖1 成骨誘導條件下ALP染色結果的變化Fig.1 Changes of ALP staining after osteogenic stimulation
RT-qPCR結果顯示,與0 d相比,成骨誘導3 d的 BMSCs COL1A1 mRNA表達上調(P<0.001),成骨誘導7 d的 BMSCs ALKBH5、COL1A1、BMP4 mRNA表達均上調(P<0.01),說明成骨分化過程中,ALKBH5 mRNA的表達上調。見圖2。
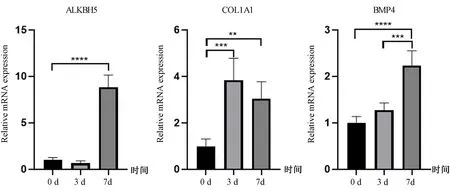
圖2 成骨誘導條件下成骨相關基因和ALKBH5 mRNA表達的變化Fig.2 The mRNA expression changes of osteogenesis-related genes and ALKBH5 after osteogenic stimulation注: **P<0.01,***P<0.001,****P<0.0001。
WB結果顯示,與0 d相比,成骨誘導3、7 d后ALKBH5、BMP4的蛋白表達水平均上調,說明成骨分化過程ALKBH5的蛋白表達水平逐漸上調。見圖3。
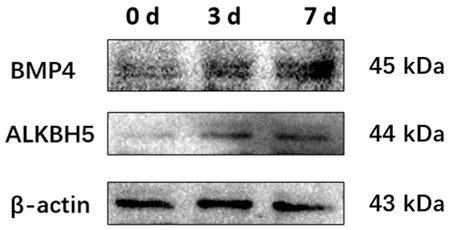
圖3 成骨誘導條件下成骨標志物和ALKBH5的蛋白表達的變化Fig.3 The protein expression changes of osteogenic markers and ALKBH5 after osteogenic stimulation
2.2 左歸丸對小鼠BMSCs成骨分化及ALKBH5的調控作用
ALP染色結果顯示,與對照組相比,左歸丸組的ALP染色陽性率顯著升高,顏色深染;ARS染色結果顯示,左歸丸組的ARS染色陽性率明顯高于空白組,礦化結節明顯增多。說明左歸丸能夠增加小鼠BMSCs成骨分化能力和礦化能力。見圖4。
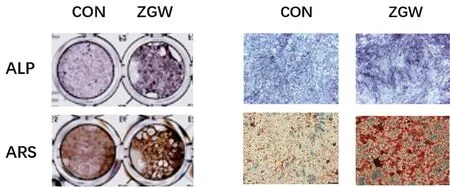
圖4 ALP和ARS染色評估左歸丸干預對BMSCs成骨分化的影響Fig.4 Effects of ZGW on the osteoblast differentiation ability of BMSCs by ALP staining and ARS staining注:右為×100鏡下圖。
WB結果顯示,與對照組相比,左歸丸組的ALKBH5、Runx2的蛋白表達水平均上調(P<0.05),說明左歸丸能夠上調ALKBH5的表達,促進成骨分化。見圖5。
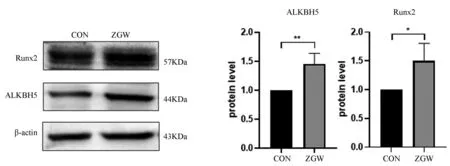
圖5 左歸丸干預對成骨標志物和ALKBH5的蛋白表達的影響Fig.5 Effects of ZGW on the protein expression of osteogenic markers and ALKBH5注:*P<0.05,**P<0.01。
2.3 小鼠BMSCs沉默ALKBH5后對成骨分化的影響及左歸丸的干預作用
2.3.1小鼠BMSCs沉默ALKBH5的鑒定及成骨相關因子的表達變化:RT-qPCR結果顯示,與對照組相比,沉默組ALKBH5表達下調(P<0.01),沉默效率約為50%,同時成骨分化相關因子Osx、Runx2均表達下調(P<0.05)。見圖6。
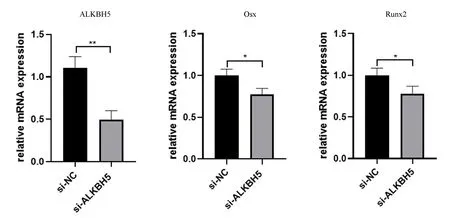
圖6 siALKBH5沉默效率及ALKBH5沉默后成骨相關因子的變化Fig.6 Efficacy of siALKBH5 knockdowm and the expression of osteogenesis-related genes changes after ALKBH5 knockdown注:*P<0.05,**P<0.01。
2.3.2小鼠BMSCs沉默ALKBH5后左歸丸的干預作用:WB結果顯示,與對照組(si-NC組)相比,左歸丸組(si-NC+ZGW組)上調ALKBH5(P<0.001)、成骨標志物Runx2(P<0.01)、BMP2(P<0.01)的蛋白表達;沉默組(si-ALKBH5)相較于對照組ALKBH5(P<0.01)蛋白表達下調,Runx2(P<0.05)、BMP2(P<0.05)的蛋白表達相應下調,ALKBH5沉默+左歸丸組(si-ALKBH5+ZGW組)相較于沉默組則又上調了ALKBH5(P<0.001)的蛋白表達,逆轉了沉默組Runx2(P<0.05)、BMP2(P<0.05)的蛋白表達下調。說明左歸丸能夠促進ALKBH5的蛋白表達,促進成骨分化相關蛋白Runx2和BMP2的表達,將ALKBH5敲降后,成骨分化相關蛋白Runx2和BMP2表達減少,左歸丸干預能夠上調ALKBH5的表達,逆轉ALKBH5敲降后Runx2和BMP2表達下調。見圖7。ALP染色結果顯示,與對照組相比,左歸丸組染色陽性率顯著升高,顏色深染。沉默組染色陽性率較對照組下降,染色變淺,左歸丸干預后染色陽性率明顯升高。說明左歸丸能夠促進小鼠BMSCs成骨分化;將ALKBH5沉默后,小鼠BMSCs成骨分化能力下降,在此基礎上加入左歸丸能夠抑制小鼠BMSCs的成骨分化能力下降。見圖8。
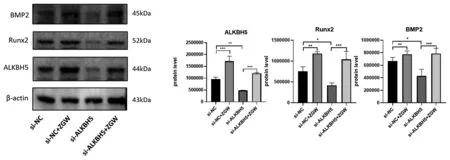
圖7 ALKBH5敲降后左歸丸干預對成骨標志物和ALKBH5蛋白表達的影響Fig.7 Effects of ZGW on the protein expression of osteogenic markers and ALKBH5 after ALKBH5 knockdown注:*P<0.05,**P<0.01,***P<0.001。
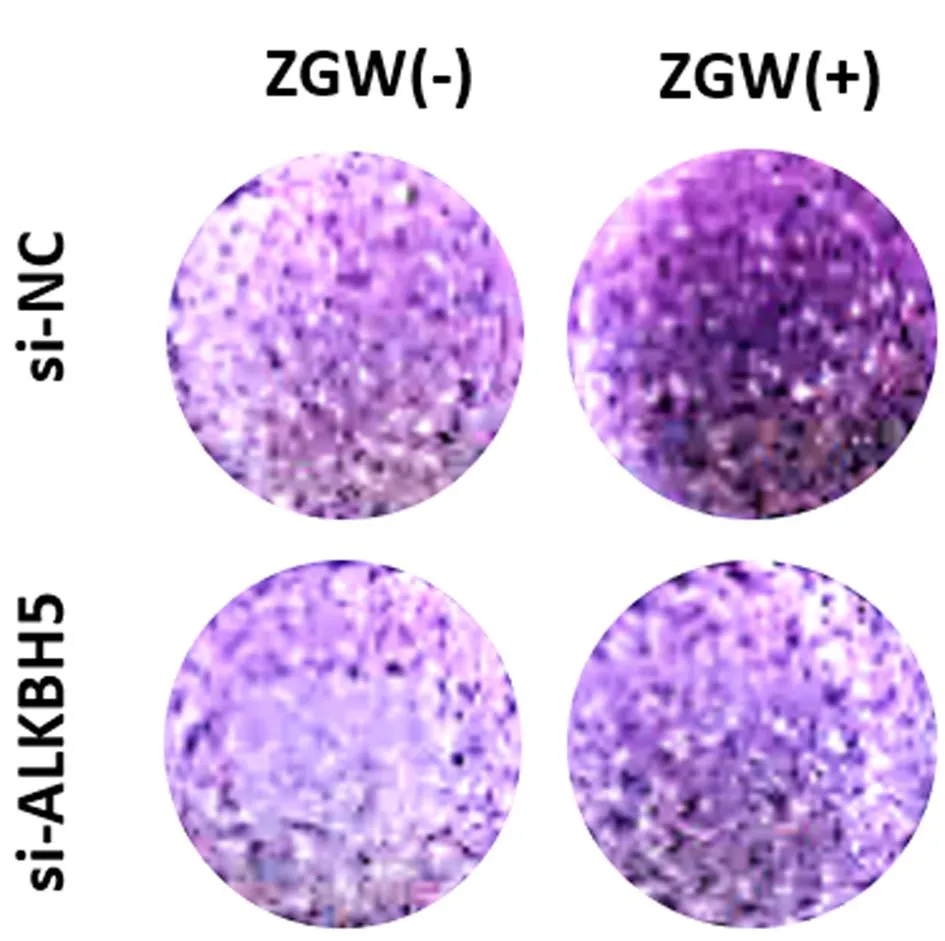
圖8 ALP染色評估ALKBH5沉默后左歸丸干預對小鼠BMSCs成骨分化的影響Fig.8 Effects of ZGW on the osteoblast differentiation ability of mouse BMSCs after ALKBH5 knockdown with ALP staining注:“-”代表無,“+”代表有。
3 討論
負責骨形成的成骨細胞長期以來一直被認為是治療骨質疏松癥或者骨質疏松骨折修復等骨病的重要媒介[6-7]。而BMSCs不僅能夠分化為成骨細胞,且能一定程度上維系其壽命,參與到骨組織的生長和修復過程中來,維持骨穩態[8]。BMSCs的成骨分化過程包括一系列事件。祖細胞經歷連續的分化階段,增殖潛力降低,從而產生前成骨細胞。隨后,成骨細胞前分化為成熟的成骨細胞,沉積形成骨基質所需的成分,然后礦化。最終,成熟的礦化成骨細胞嵌入新分泌的骨基質中,并進行終末分化以形成骨細胞[9]。分化過程中伴隨著堿性磷酸酶(ALP)活性的增加[10]。其他成骨標志物如Runt相關轉錄因子2(Runx2)[11]、成骨細胞特異性轉錄因子Osx[12]、α1-1型膠原基因(COL1A1)[13]、骨形態發生蛋白4[14]、骨形態發生蛋白2[15]也在成骨分化過程中逐漸表達上調。
m6A是真核生物體內一種動態可逆的RNA修飾,主要受甲基化轉移酶“writer”、去甲基化酶“eraser”調控,結合蛋白“reader”識別其作用[16]。ALKBH5作為重要的去甲基化酶之一,可通過調控mRNA穩定性影響成骨分化,但存在積極作用、消極作用兩種結果。Yu等[17]研究發現,ALKBH5可以逆轉甲基化轉移酶METTL3激活NF-κB通路產生的成骨抑制作用;Feng等[18]研究發現,ALKBH5 mRNA和蛋白質表達在成骨細胞分化過程中上調,并且ALKBH5沉默后成骨細胞分化收到抑制,礦化和成骨生物標志物的表達。本文通過在成骨誘導條件下檢測ALKBH5和成骨標志物的mRNA和蛋白表達水平,發現在第7天時成骨標志物表達上調,此時ALKBH5表達明顯上調。為進一步明確ALKBH5在小鼠BMSCs成骨分化過程中的作用,作者應用細胞轉染技術將BMSCs中的ALKBH5敲降,發現ALKBH5敲降后成骨生物標志物的表達下調,成骨細胞分化能力下降,又一次證實ALKBH5在小鼠BMSCs成骨分化過程中起著正向調控作用。
左歸丸出自《景岳全書》卷五十一,為補益劑,具有壯水之主,培腎之元陰之功效。關于左歸丸促進BMSCs的成骨分化治療骨質疏松癥的作用雖已多次得到證實[19-20],其作用機制大部分是關于 Wnt/β-catenin、AMPK/mTOR等信號通路的研究,目前關于左歸丸通過調控RNA修飾影響小鼠BMSCs成骨分化的研究尚無文獻報道。本課題組前期研究發現[21],左歸丸可以通過激活let-7f抑制自噬來促進BMSC的成骨分化,從而改善糖皮質激素導致的激素性骨質疏松。其中,左歸丸的最佳干預濃度為1000 μg/mL。因此,本研究在此基礎上采用1000 μg/mL的左歸丸混懸液干預小鼠BMSCs,研究去甲基化酶ALKBH5在其成骨分化過程中的作用機制。研究表明左歸丸促進成骨分化過程中,ALKBH5表達上調,為進一步證實左歸丸通過上調ALKBH5對小鼠BMSCs成骨分化產生影響,作者對ALKBH5沉默的小鼠BMSCs加入左歸丸干預,結果表明左歸丸能夠逆轉ALKBH5沉默導致的小鼠BMSCs成骨分化能力下降。
綜上所述,本研究證實左歸丸能夠促進小鼠BMSCs的成骨分化,并發現上調去甲基化酶ALKBH5的表達可能是其發揮作用的機制之一。然而,本研究尚存在不足,尚未明確左歸丸通過上調ALKBH5的去甲基化作用影響調控的mRNA,下一步將繼續進行研究。

