Mertk 介導NF-κb 通路影響雪旺細胞炎癥反應的作用
付怡丹 ,陳文婷 ,蘇曉楊 ,趙 燕 ,蘭丹鳳 ,楊秋萍
(1)昆明醫科大學第一附屬醫院干療科;2)重癥醫學科;3)糖尿病科,云南 昆明 650032;4)云南省第一人民醫院消化內科,云南昆明 650032;5)昆明醫科大學第一附屬醫院內分泌一科,云南 昆明 650032)
糖尿病(diabetes mellitus,DM)是一組以慢性高血糖為特征的代謝性疾病。糖尿病周圍神經病變(diabetic peripheral neuropathy,DPN)是糖尿病最常見的并發癥之一,國內患病率達67.6%,其中重度 DPN 患病率達19.3%[1]。雪旺細胞作為周圍神經系統中最重要的髓鞘細胞,參與維持周圍神經的正常結構和功能[2-3],炎癥反應對雪旺細胞的損傷是DPN 發生發展的重要因素[4]。核因子κB(nuclear factor kappa-b,NF-κb)級聯反應是炎癥反應的調控中心,抑制NF-κb 通路,有望降低炎性細胞因子的表達,最終改善神經損傷[5]。
Mer 受體酪氨酸激酶(Mer receptertyroshin kinase,Mertk)是受體酪氨酸激酶家族TAM 成員之一,作為一種單跨膜受體可以通過結合多種配體將信號從細胞外基質轉導至細胞質,調節眾多生理過程[6-8]。現有文獻顯示[9-10],Mertk 能夠抑制促炎性細胞因子IL-12、干擾素和NF-κb 的表達,從而抑制炎癥信號轉導。本課題前期利用公共數據庫,發現并報道[11]Mertk 基因表現出糖尿病周圍神經病變的疾病特異性,但Mertk 在雪旺細胞中的可能作用及其調控機制尚不清楚。為此,本研究通過沉默大鼠雪旺細胞內Mertk 基因,探究Mertk 是否通過調控炎癥反應NF-κb 通路相關蛋白B 細胞κ 輕肽基因增強子抑制因子激酶ε(inhibitor kappa B kinaseβ,Ikbkb)、P65、TNFα,從而影響雪旺細胞炎癥反應。
1 材料與方法
1.1 主要儀器與試劑
AI1600 超靈敏化學發光成像儀(GE 公司,美國)和正置熒光顯微鏡(Olympus 公司,日本)來源于昆明醫科大學科技成果孵化中心,垂直電泳及濕式轉膜系統購自北京六一生物科技公司。葡萄糖濃度為4.5 g/L(25 mmol/L)的DMEM 培養基、胎牛血清、青霉素-鏈霉素雙抗和含EDTA 的0.25%胰蛋白酶消化液均購自美國GIBCO 公司,無水葡萄糖購自廣州光華科技有限公司,BCA 蛋白濃度測定試劑盒購自上海碧云天公司,Mertk、Ikbkb抗體購自美國Abcam 公司,P65 抗體、TNF-α抗體、β-actin 抗體、IgG 抗體、抗兔/抗鼠第二抗體購自武漢Proteintech 公司,免疫熒光試劑盒購自北京索萊寶科技有限公司,免疫共沉淀試劑盒購自上海愛必信科技有限公司。
1.2 細胞培養
大鼠雪旺氏細胞株(RSC96)來自昆明醫科大學科技成果孵化中心,生長所需細胞培養基配比是DMEM 培養基∶胎牛血清∶雙抗=100∶10∶1,放置在37℃、5% CO2飽和濕度的細胞培養箱中靜置培養。
1.3 Mertk 在高糖環境雪旺細胞中表達
將RSC96 細胞隨機分為對照組(25 mmol/L 組)和處理組(50、75、100 及125 mmol/L 組)。首先使用不添加胎牛血清的培養基進行饑餓處理4 h,再將DMEM 培養基中葡萄糖濃度分別調整至50 mmol/L、75 mmol/L、100 mmol/L 及125 mmol/L,繼續培養48 h,Western blot 檢測細胞內Mertk 蛋白表達水平。
1.4 免疫共沉淀檢測內源性Mertk、Ikbkb 相互作用
培養3 瓶RSC96 細胞。以Lysis buffer∶PMSF=100∶1 配制裂解液,將RSC96 細胞裂解、超聲、離心、留取Input 蛋白,所得產物分別加入Mertk、Ikbkb、IgG 一抗1~5 μg,4℃孵育過夜后加入5 μL Protein A 與Protein G,再經過孵育、洗滌、離心、SDS 緩沖液重懸、變性得到終產物,最后利用免疫印跡法檢測Mertk 與Ikbkb 的相互作用。
1.5 免疫印跡法檢測沉默Mertk 后RSC96 內Ikbkb、P65、TNF-α 表達水平
將3 種Mertk siRNA 試劑(siRNA1/siRNA2/siRNA3)及空載對照(NC)利用GP-Transfect-Mate試劑轉染進入RSC96 細胞。48 h 后根據BCA 試劑盒說明書所述提取總蛋白,免疫印跡法檢測Mertk、Ikbkb、P65、TNF-α 表達水平。siRNA核苷酸序列見表1。
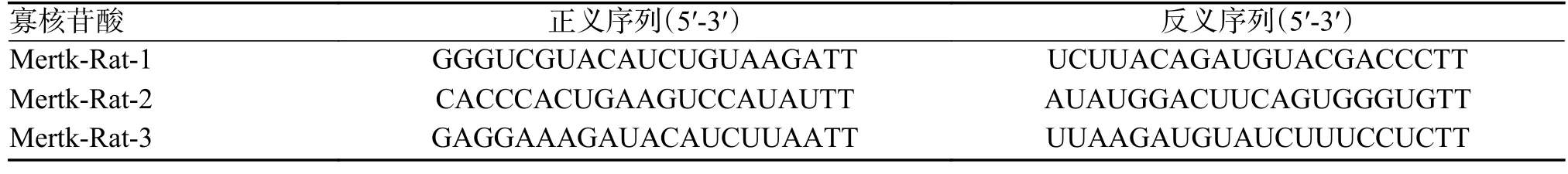
表1 Mertk 小干擾核苷酸序列Tab.1 Mertk-RNA oligo sequences
1.6 免疫熒光法檢測沉默Mertk 后炎癥因子TNFα 表達
在玻璃爬片上培養RSC96 細胞,隨機分為對照組(Con 組)和實驗組(siRNA3 組),按組別處理細胞。48 h 后細胞經過固定、通透、封閉等步驟后,分別加入Mertk(1∶200)、Ikbkb(1∶200)、P65(1∶200)一抗4℃孵育過夜,第2 天加入相對應種屬的熒光二抗暗室內孵育;DAPI 染細胞核10 min 后,將細胞爬片倒扣在滴有熒光淬滅劑的載玻片上,使用正置熒光顯微鏡觀察并拍照。
1.7 統計學處理
采用SPSS23.0 統計軟件。計量資料采用Kolmogorov-Smirnov 法檢驗數據正態性,符合正態分布時以均數±標準差()表示,多組間單因素比較采用單因素方差分析。P< 0.05 為差異有統計學意義。
2 結果
2.1 Mertk 在雪旺細胞的表達
首先明確Mertk 在雪旺細胞中是否表達,以及模擬糖尿病高糖環境下Mertk 表達水平的變化情況。免疫印跡結果顯示,Mertk 在雪旺細胞中存在表達,且隨葡萄糖濃度增加,細胞Mertk 表達水平增加(P< 0.05),見表2 和圖1。
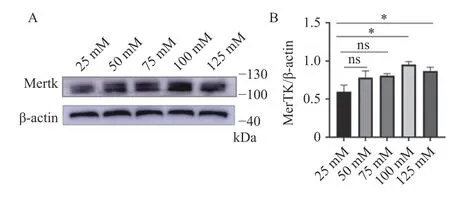
圖1 不同葡萄糖水平RSC96 內Mertk 蛋白表達Fig.1 Mertk protein expression within RSC96 at different glucose levels

表2 不同葡萄糖水平RSC96 內Mertk 蛋白表達Tab.2 Mertk protein expression within RSC96 at different glucose levels
2.2 Mertk 與Ikbkb 內源性相互作用
以非特異免疫的同源抗體IgG 作為陰性對照,以Input 作為陽性對照,免疫共沉淀結果顯示,RSC96 細胞內同時表達Mertk、Ikbkb,且二者之間存在相互作用關系,見圖2。

圖2 Mertk 與Ikbkb 免疫共沉淀Fig.2 Co-Immunoprecipitation of Mertk with Ikbkb
2.3 沉默Mertk 對雪旺細胞Ikbkb、P65、TNF-α蛋白表達的影響
免疫印跡實驗結果顯示,3 種siRNA 均使Mertk 表達含量下降(P< 0.05),同時Ikbkb、P65、TNF-α 表達水平隨Mertk 表達水平的降低而升高(P< 0.05),見表3 和圖3。
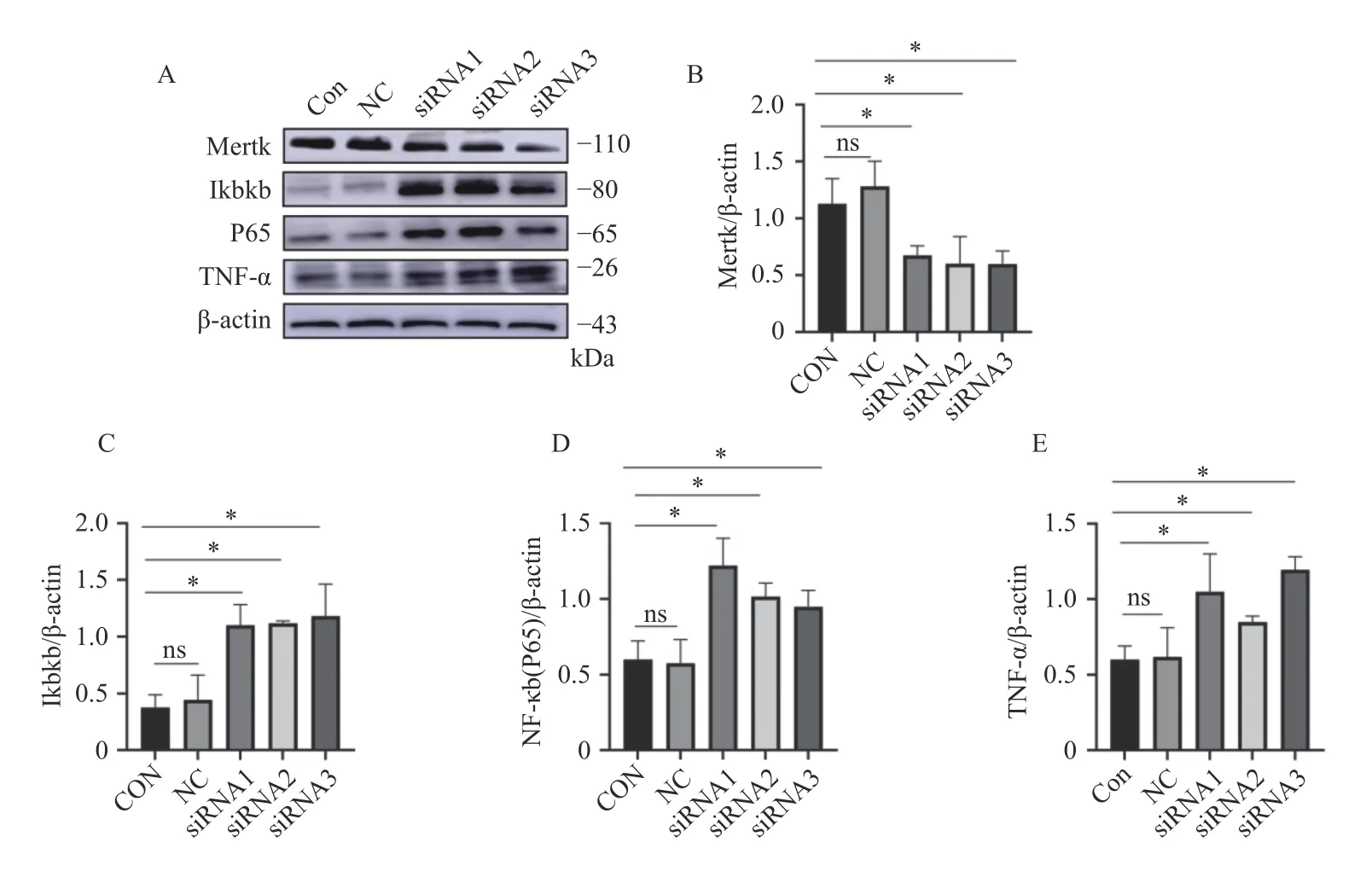
圖3 沉默Mertk 后Ikbkb、P65、TNF-α 蛋白表達水平Fig.3 Ikbkb,P65,and TNF-α protein expression levels after silencing Mertk

表3 沉默Mertk 后Ikbkb、P65、TNF-α 蛋白表達量Tab.3 Ikbkb,P65,and TNF-α protein expression after silencing Mertk
2.4 免疫熒光檢測Mertk、Ikbkb、P65 蛋白
以siRNA3 轉染RSC96 細胞后,Mertk、Ikbkb、P65 蛋白免疫熒光結果與免疫印跡實驗一致,見圖4。
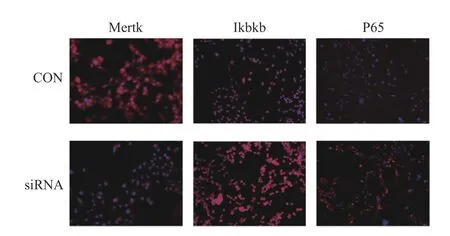
圖4 免疫熒光檢測siRNA3 轉染后Mertk、Ikbkb、P65 蛋白表達(200x)Fig.4 Immunofluorescence detection of Mertk,Ikbkb,and P65 protein expression after siRNA3 transfection(200x)
3 討論
糖尿病周圍神經病是糖尿病患者最常見的慢性并發癥,是導致糖尿病患者截肢,生活質量下降及死亡的主要原因之一,加重社會負擔[12]。糖尿病周圍神經病變以神經纖維脫髓鞘、神經傳導速度受損為特征[13],而雪旺細胞正是周圍神經系統中最重要的髓鞘細胞;雪旺細胞損傷與凋亡是糖尿病周圍神經病變的重要病理學特征之一,也是導致糖尿病髓鞘功能不良的主要因素[14]。因此,本研究以大鼠雪旺細胞作為研究對象,以此作為糖尿病周圍神經病變研究的重要切入點,并且首先明確了Mertk 在雪旺細胞中的表達,即隨著細胞生長環境內葡萄糖濃度的提高,Mertk 表達量也隨之提高。
蛋白質通常不是作為單一物質發揮作用,而是以蛋白質-蛋白質相互作用的方式在活細胞生物過程中發揮作用。本研究結果通過免疫共沉淀實驗,驗證了雪旺細胞內Mertk 與Ikbkb 的內源性相互作用。Ikbkb(也稱IKKβ、IKK2)是IKK 復合體的催化亞基之一,而IKK 復合體是NF-κb信號轉導通路的關鍵調節因子,可迅速激活NFκb,以協調大多數靶基因的表達[15-16]。因此,本實驗試圖進一步探究Mertk 是否間接調控NFκb 通路,對雪旺細胞炎癥反應產生影響。
為達到這一目的,本研究使用siRNA 敲減沉默表達Mertk 后,發現P65 及其下游炎癥因子TNF-α 表達水平升高,表明NF-κb 通路受到正向調控,雪旺細胞內炎癥反應加重。經典的NFκb 系統是由亞基p50 和P65 組成的復合體,在大多數靜息細胞中,NF-κb 以抑制物IκB 的形式存在。糖尿病病理過程產生的刺激,可導致IKK 特異性地磷酸化IκB,進而允許p50 和P65向細胞核發出信號,激活大量有關基因[17]。NFκb 通路調控的促炎細胞因子是神經血管損傷和神經傳導速度受損的主要原因,抑制NF-κb 通路,有望降低炎性細胞因子的表達,最終改善神經損傷[5]。由此,課題組推測,以Mertk 基因為靶點進行研究可能為糖尿病周圍神經病的治療提供新的思路。
綜上所述,本研究以雪旺細胞為研究對象,發現Mertk 與Ikbkb 相互作用,沉默Mertk 可上調Ikbkb,繼而激活NF-κb 信號轉導通路,上調P65 及其下游炎癥因子TNF-α 表達水平。本研究對糖尿病周圍神經病變的發病機制、臨床藥物的治療、靶向藥物的研發都有非常積極的作用,這些體外細胞實驗也為進一步的動物體內實驗以及臨床血清分子標記驗證打下了基礎。

