馬鈴薯試管苗薊馬防治的研究
李東玉,相叢超,封志明,張淑青,樊建英,賈明飛,胡金雪
(石家莊市農林科學院,河北 石家莊 050025)
在組培室中開展馬鈴薯試管苗培育是馬鈴薯育種的主要手段之一,通常采用馬鈴薯莖尖脫毒、組培快繁進行馬鈴薯種質資源保存及組培苗批量生產[1-9]。組培工作包括培養基的制備,無菌苗、脫毒苗的獲得、培養、保存與擴繁,接種室、培養室的管理消毒及污染瓶苗處理等流程,為達到預期的培養效果均需執行嚴格的操作程序,其目的:一方面是保證組培材料無病毒、細菌、真菌及蟲害的污染;另一方面是保證所培育種薯種性純正。為避免病毒病,開展了大量有關試管苗病毒、細菌、真菌污染和防治研究,并形成了較為成熟的技術[10-14]。近年來,組培室受蟲害污染逐漸頻繁,但試管苗蟲害情況及對策的相關研究仍較缺乏,對試管苗相關的科研生產造成了較大的影響[15-20]。
薊馬(ThripstabaciLindeman)是副新翅類纓翅目昆蟲的統稱,是試管苗最為常見的一種典型蟲害,其個體小、易隱藏、繁殖快、飛行能力強、寄主植物廣且對農藥抗性強,對蔬菜、花卉、水果等作物的危害很大。組培室一旦發生薊馬蟲害且沒有得到及時、有效控制,會快速在組培瓶苗內傳播[21-23],嚴重為害試管苗的生長。其成蟲、若蟲以銼吸式口器銼破植物表皮吸取汁液,取食植物組織,為害植物[24-25]。薊馬可侵染組培苗葉片及莖稈,主要對葉片造成損壞,它常沿著葉脈銼食組織、吸取汁液。試管苗受到侵染后,葉片上出現透明、銀白色的斑點或條帶,并伴隨大量薊馬糞便黑點。侵染嚴重時斑點連接成片,進而導致葉片失綠、變黃,植株停止生長,直至干枯死亡。由于試管苗在封閉的培養瓶內培育,薊馬往往會在瓶中不斷地繼代擴繁,最終形成較大的蟲口密度。在同一組培室內,蟲體可在瓶苗間迅速擴散,在短期內危及整個組培室[26-28]。試管苗受薊馬侵染后極易出現真菌、細菌污染或在繼代培養中產生二次污染。綜上所述,為保證馬鈴薯組培苗規模化生產的有效開展,薊馬蟲害防治工作十分重要。
吡蟲啉和噻蟲嗪屬新煙堿類殺蟲劑,源于天然煙堿殺蟲劑,通過破壞昆蟲神經中樞系統使其麻痹進而死亡,具有高效、廣譜、哺乳動物毒性低和環境安全的特點[26,29]。該類殺蟲劑可有效防治鞘翅目、鱗翅目、纓翅目等昆蟲,適用于種子處理、莖葉處理和土壤處理等多場合,是薊馬蟲害防治的首選手段。本文通過以石薯1號組培苗為試驗材料,探究不同新煙堿殺蟲劑的蟲害防治效果,并評估其對試管苗生長的負作用,旨在探索一種針對馬鈴薯試管苗典型蟲害——薊馬的防治方法,從而促進馬鈴薯產業健康、可持續發展。
1 材料和方法
1.1 供試材料及地點
試驗在石家莊市農林科學研究院馬鈴薯無菌組培室中開展,以石薯1號馬鈴薯組培苗為試材。石薯1號是石家莊市農林科學研究院最新培育的早熟馬鈴薯新品種,2014年通過河北省農作物品種審定,是河北省首個審定本省中南部二季作區春播早熟品種。
采用了2種典型新煙堿類殺蟲劑:70%吡蟲啉水分散粒劑,由上海滬聯生物藥業(夏邑)股份有限公司生產;25%噻蟲嗪水分散粒劑,由山東惠民中聯生物科技有限公司生產。MS培養基由MS干粉(北京易生組培有限公司生產)配制。
1.2 試驗方法
1.2.1 薊馬防治試驗方法
本試驗采用隨機區組設計,設6個處理,1個對照處理。在MS培養基中加入不同濃度、不同種類殺蟲劑,以未加入藥劑的試管苗為對照,每個組培瓶中接入5棵試管苗,3次重復,其他培養條件均保持一致(表1)。
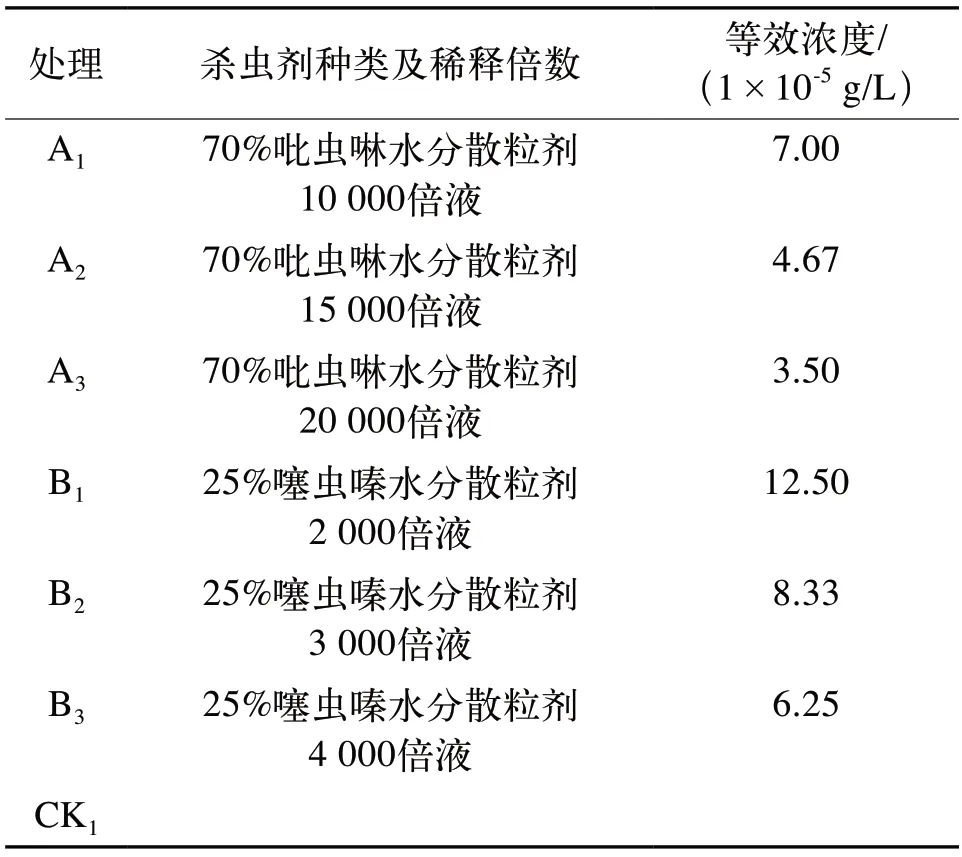
表1 防治試驗處理
1.2.2 藥劑解除試驗方法
本試驗采取隨機區組設計,將生長在不同殺蟲劑培養基中的組培苗擴繁3次后,移栽至未加入藥劑的MS培養基,再進行擴繁0~2次,共設7個處理,見表2。

表2 藥劑解除試驗處理
1.3 測定項目及方法
1.3.1 藥劑防治試驗
試管苗生長15 d后,隨機選取幼苗并測量其根長、株高、單株葉片數、鮮質量。記錄病葉數,并計算發病率(發病率=病葉數/單株葉片數×100%)。
1.3.2 藥劑解除試驗
組培苗生長15 d后,隨機選取瓶中組培苗,測量幼苗根長、莖粗、株高、單株葉片數、節間距。
1.4 數據統計
采用DPS 9.50和WPS Office(10.1.07468)軟件進行數據分析。
2 結果與分析
2.1 不同藥劑處理對試管苗生長情況的影響
2.1.1 不同藥劑處理的試管苗根長及株高生長情況
由表3可知,試驗處理15 d后,A處理組(70%吡蟲啉水分散粒劑)和B處理組(25%噻蟲嗪水分散粒劑)均可降低試管苗根長,其中B1處理(25%噻蟲嗪水分散粒劑2 000倍液)對試管苗生長抑制最明顯,根長為40.73 mm,顯著低于CK1處理的根長(62.30 mm)。除A3處理(70%吡蟲啉水分散粒劑20 000倍液)的株高較CK1處理高外,其余處理均低于CK1,其中B1處理(25%噻蟲嗪水分散粒劑2 000倍液)抑制植株株高最明顯,為66.50 mm,顯著低于CK1處理的株高(97.87 mm),A2株高(70%吡蟲啉水分散粒劑15 000倍液)與CK1差異不顯著,A1(25%噻蟲嗪水分散粒劑10 000倍液)、B2株高(25%噻蟲嗪水分散粒劑3 000倍液)、B3(25%噻蟲嗪水分散粒劑4 000倍液)之間株高差異不顯著,且均顯著低于CK1。
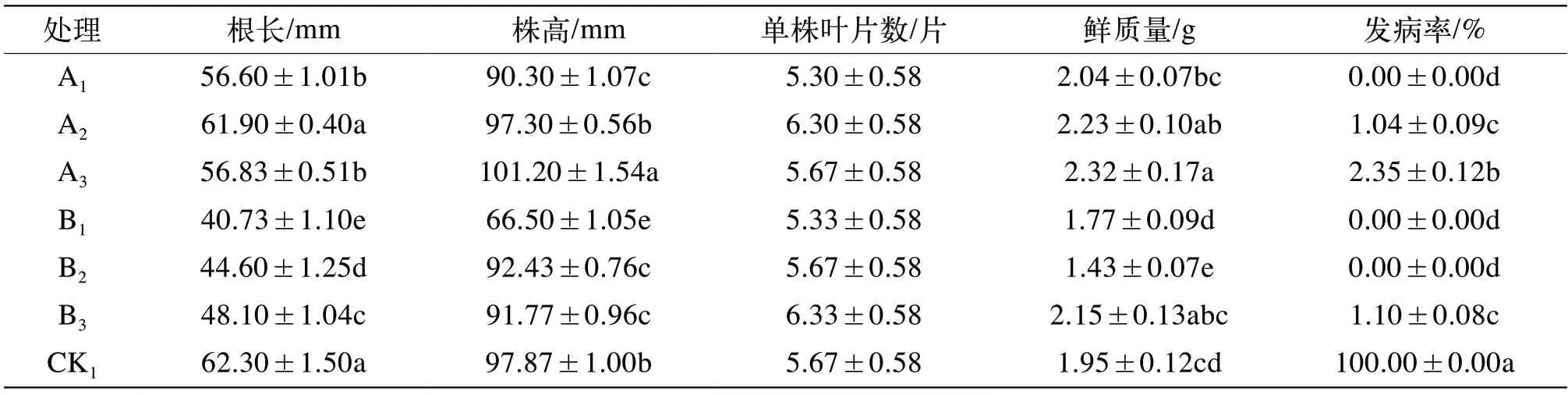
表3 不同藥劑處理對試管苗生長情況的影響
2.1.2 不同藥劑處理的試管苗單株葉片數情況
由表3可知,整體來看,7個處理間無顯著差異,且以B3(25%噻蟲嗪水分散粒劑4 000倍液)最高,其次為A2(70%吡蟲啉水分散粒劑15 000倍液)。隨著70%吡蟲啉水分散粒劑藥劑濃度的升高,試管苗單株葉片數呈現先升高后降低的趨勢;隨著25%噻蟲嗪水分散粒劑濃度的升高,試管苗單株葉片數也隨之升高,且B3最高,經線性分析,25%噻蟲嗪水分散粒劑濃度與單株葉片數之間回歸方程式為:Y=0.3X+5.2,R2=1,說明25%噻蟲嗪水分散粒劑濃度與單株葉片數存在線性正相關關系。
2.1.3 不同藥劑處理的試管苗鮮質量情況
由表3可知,整體來看,A處理組(70%吡蟲啉水分散粒劑)的鮮質量高于B處理組(25%噻蟲嗪水分散粒劑)和CK1,且以A3(70%吡蟲啉水分散粒劑20 000倍液)處理最高,為2.32 g,A2(70%吡蟲啉水分散粒劑15 000倍液)次之,且A2、A3(70%吡蟲啉水分散粒劑20 000倍液)與CK1均達到了顯著差異水平;隨著70%吡蟲啉水分散粒劑濃度的升高,試管苗鮮質量呈現升高的趨勢,經線性分析,70%吡蟲啉水分散粒劑濃度與試管苗鮮質量呈現正相關關系,回歸方程式為:Y=0.14X+1.92,R2為0.959。隨著25%噻蟲嗪水分散粒劑濃度的升高,試管苗鮮質量呈現先降低后升高的趨勢,其中B3處理(25%噻蟲嗪水分散粒劑4 000倍液)的鮮質量高于CK1處理,但差異不顯著;B1(25%噻蟲嗪水分散粒劑2 000倍液)、B2(25%噻蟲嗪水分散粒劑3 000倍液)均顯著低于CK1。
2.1.4 不同藥劑處理的試管苗發病情況
由表3可知,A處理組和B處理組試管苗發病率均顯著低于CK1,其中A1(70%吡蟲啉水分散粒劑10 000倍液)、B1(25%噻蟲嗪水分散粒劑2 000倍液)、B2(25%噻蟲嗪水分散粒劑3 000倍液)處理發病率均為0.00%,其他3個處理的試管苗發病率表現A3(70%吡蟲啉水分散粒劑20 000倍液)>B3(25%噻蟲嗪水分散粒劑4 000倍液)>A2(70%吡蟲啉水分散粒劑15 000倍液)。
2.2 生長抑制作用解除試驗
由表4可知,在使用70%吡蟲啉水分散粒劑10 000倍液和25%噻蟲嗪水分散粒劑2 000倍液培養基進行擴繁3次后,試管苗生長出現了顯著抑制作用,通過使用無藥物培養基擴繁可以顯著解除抑制作用。在采用無藥劑培養基擴繁后,C2、C3處理根長較C1處理分別顯著提高了51.43%、123.96%,株高較C1處理分別顯著提高了85.41%、198.97%,最長節間距較C1處理分別顯著增加280.00%、746.60%,最短節間距較C1處理分別顯著增加42.92%、128.76%,但單株葉片數較C1處理分別顯著減少28.51%、21.44%,莖粗較C1處理分別顯著減少11.92%、35.10%,C2處理莖粗和最短節間距均與C1處理差異不顯著。D2處理根長、莖粗、株高、最長節間距、最短節間距均與D1處理差異不顯著,葉片數較D1處理顯著減少18.56%;D3處理根長、株高、最長節間距較D1處理分別顯著提高161.27%、228.52%、960.96%,莖粗較D1處理顯著減少28.40%,葉片數、最短節間距均與D1處理差異不顯著。而C3處理的根長、株高、莖粗、葉片數、節間距均與CK2處理差異不顯著;C3、D3處理的根長、株高、莖粗、葉片數、節間距均與CK2處理差異不顯著。綜上所述,在使用70%吡蟲啉水分散粒劑10 000倍液和25%噻蟲嗪水分散粒劑2 000倍液培養基擴繁3次后,再采用無藥劑培養基擴繁2次均可以更有效解除殺蟲劑生長抑制作用。
3 結論
3.1 薊馬防治試驗
在培養基中添加70%吡蟲啉水分散粒劑和25%噻蟲嗪水分散粒劑的藥劑,可以有效抑制試管苗生長,且B1處理(25%噻蟲嗪水分散粒劑2 000倍液)對試管苗生長抑制最顯著,根長為40.73 mm,株高為66.50 mm,均顯著低于其他處理及對照。在培養基中添加70%吡蟲啉水分散粒劑10 000倍液和25%噻蟲嗪水分散粒劑2 000倍液、3 000倍液有效防治了薊馬,組培苗發病率均為0.00%。
3.2 藥劑解除試驗
C3處理(藥劑培養基擴繁3次后,無藥劑培養基擴繁2次)根長較C1處理(藥劑培養基擴繁3次)顯著提高了123.96%,株高較C1處理顯著提高了198.97%,C3處理之后的根長、株高均高于CK2處理,但與CK2處理差異均不顯著;D3處理的根長、莖粗、單株葉片數、株高、節間距均與CK2差異不顯著,且D3處理的根長、株高均顯著高于D1處理;說明在藥劑培養基擴繁3次后,再采用無藥劑培養基擴繁2次可以快速解除殺蟲劑生長抑制作用,達到與正常植株同等的生長狀況。
因此,70%吡蟲啉水分散粒劑10 000倍液和25%噻蟲嗪水分散粒劑2 000倍液藥劑均可以防治試管苗中的薊馬,且在采用無藥劑培養基擴繁2次可以快速解除殺蟲劑生長抑制作用。
4 討論
薊馬物種豐富多樣,嚴重為害農作物的健康、可持續發展。防治方法包括化學防治、物理防治、生物防治和農業防治。目前,化學防治是防治薊馬的主要手段,方法多樣、見效塊、使用便捷。
本試驗通過利用不同濃度的吡蟲啉、噻蟲嗪藥劑對馬鈴薯試管苗薊馬進行防治,70%吡蟲啉水分散粒劑10 000倍液和25%噻蟲嗪水分散粒劑2 000倍液藥劑加入MS培養基中均可以有效防治馬鈴薯試管苗薊馬,且可以通過降低試管苗株高、根長等生理指標,進而降低試管苗生長速度。同時,在進行藥劑培養基擴繁3次后,使用無藥劑培養基培養試管苗可以較快恢復試管苗的生長,對試管苗生長并未產生影響。本試驗同羅智敏等[29]的研究結果一致。
在使用化學藥劑防治薊馬時,應該注意科學用藥,防止薊馬對化學藥劑產生抗性。本試驗采用單一農藥對馬鈴薯試管苗薊馬進行防治研究,后續可以采用機制不同的幾種農藥輪換使用,以降低馬鈴薯薊馬對化學藥劑的抗性。

