銀耳多糖對人軟骨細胞的增殖效應和抗炎作用
譚敏穎,戴川景,盧學敏,王毅剛,關 磊,程 勇,
(1.浙江理工大學生命科學與醫藥學院,浙江杭州 310018;2.浙江天草生物科技股份有限公司,浙江湖州 313399)
骨關節炎(Osteoarthritis,OA)是一種出現在關節結構中非常普遍的骨組織慢性[1]和退行性疾病,表現為關節組織的代謝異常,骨關節的磨損、撕裂[2]和滑膜液炎癥因子的增加[3]。近年來發現髖關節和膝關節OA 是導致殘疾的主要原因,人們普遍認為OA會日益增加人們生活的負擔,這會導致醫療系統的壓力不斷增加。在全球范圍內影響約5 億人口且女性發病率高于男性[4]。它可以導致關節功能障礙、疼痛、僵硬,限制正常的組織功能,嚴重降低人們的生活質量[5]。關節炎的發生是多種潛在因素共同的作用結果[6],其中人口老齡化[7-8]、肥胖(BMI≥30 kg/m2)[8],或者骨組織異常負荷受損[9]、肌肉無力和關節松弛,頻繁下蹲等都可能是骨關節炎發生的重要風險因素。巨噬細胞是維持組織穩態的關鍵媒介[10],在OA 關節中巨噬細胞受到球蛋白誘導后,會產生許多促炎細胞因子和生長因子,如白介素6(Interleukin-6,IL-6)[3]、單核化學吸引蛋白。促炎細胞因子會上調細胞外合成基質(Extracellular cartilage matrix,ECM)金屬蛋白酶和蛋白聚合酶(MMP-3 和MMP-13,以及ADAMTS-4 和ADAMTS-5)來抑制細胞基質合成,從而破壞關節組織[3]。
目前對于骨關節炎的治療大致可分為藥理學、非藥理學和手術干預。骨關節炎臨床經濟學會(European Society for Clinical and Economic Aspects of Osteoporosis,Osteoarthritis and Musculoskeletal Diseases,ESCEO)建議使用低劑量、短期的乙酰氨基酚、藥用級氨基葡萄糖和硫酸軟骨素用于緩解OA 帶來的疼痛[11]。天然化合物硫酸軟骨素和葡萄糖胺已經被多個研究證明具有抑制OA 的效果[12-13],并證明它有利于人類關節中蛋白聚糖合成,改善細胞外軟骨基質的代謝紊亂[14]。其他常見的藥理學手段包括使用非甾體抗炎藥(NSAIDs)、撲熱息痛(對乙酰氨基酚)[15]等,這些藥物在治療OA 中被頻繁使用,并且其作用效果在臨床中得到了驗證[16]。但是非甾體抗炎藥具有強烈的毒性,可導致胃出血,腎臟血流減少等風險[17],而除了非甾體類藥物以外,還有內皮質類固醇注射[16]和關節內透明質酸的方式可以幫助患者減輕疼痛[18]。有研究表明,隨著注射時間的增加,類固醇的效果會減小,而且可能會對軟骨產生有害影響。此外,有研究者使用間充質干細胞在動物模型中治療OA[19],但目前還沒有在臨床進行驗證和治療。目前,對于OA 的臨床治療面臨著艱巨的挑戰。
在這些治療藥物中大部分副作用強,服用后會產生胃出血潰瘍等毒副作用。銀耳多糖作為一種具有藥用價值的食物,副作用小,是一種具有潛力的抗炎藥材。銀耳是一種真菌,通常被用來入藥或者直接食用。其中的有效生物活性成分是銀耳多糖,包括甘露糖、葡萄糖、半乳糖、酸性低聚糖和酸性雜多糖等[20]。研究者對銀耳多糖的藥用價值在不斷挖掘,發現銀耳多糖具有免疫調節[21]、抗氧化、降血糖、降血脂和抗腫瘤的作用,而且具有低副作用。銀耳提取物可以抑制LPS 刺激引起的炎癥反應[22]、雙環素硫酸鈉引起的結腸炎[23]、成纖維細胞損傷[24]等諸多炎癥反應,并且可以促進抗炎因子白介素-2(Interleukin-2,IL-2)的增加[25],說明銀耳多糖是一種有效的炎癥抑制劑。但是對于在關節炎方面,銀耳多糖的藥用價值仍不明確。
本研究擬通過銀耳多糖處理骨關節炎細胞模型—人軟骨細胞T/C-28a2 后,檢測銀耳多糖對T/C-28a2 細胞的增殖效應和細胞毒作用,以及促炎因子IL-6、相關骨保護因子(Osteoprotegerin,OPG)、促凋亡蛋白Bax、細胞外信號調節激酶(Extracellularsignal-regulated kinases,ERK-MAPK)和核內轉錄因子κB(Nuclear factor-kappaB,NF-κB)的表達,進一步檢測活性氧(Reactive oxygen species,ROS)的水平,以探究銀耳多糖促進人軟骨細胞T/C-28a2 的增殖、抑制骨關節炎的形成、保護軟骨組織并抵抗細胞凋亡的作用,為開發銀耳多糖作為抗炎藥物提供一定的實驗依據。
1 材料與方法
1.1 材料與儀器
脂多糖(Lipopolysaccharide,LPS)、活性氧(ROS)檢測試劑盒、D-氨基葡萄糖、硫酸軟骨素Sigma 公司;氨糖軟骨素鈣片 湯臣倍健;銀耳多糖、硫酸化銀耳多糖 分析純,杭州天草生物公司;IL-6 ELISA 試劑盒 義翹神舟;胎牛血清(FBS)、胰酶消化液(0.25% Tryspin-EDTA(1×))、青-鏈霉素溶液 Gibco 公司;人軟骨細胞T/C-28a2 ATCC、DMEM高糖培養基 Hyclone 公司;鼠抗體、兔抗體 Santa Cruz 公司;β-actin ERK-MAPK CST 公司;OPG NF-κB BAX 華安生物公司;噻唑藍(MTT)、結晶紫 麥克林公司。
ELx800 多功能酶標分析儀 美國 Biotek 公司;4J1093 倒置熒光顯微鏡 Nikon 公司;Nu425-400e細胞生物安全柜 Nuair 公司;V6B5R3 流式細胞儀NovoCyte? Advanteon 公司。
1.2 實驗方法
1.2.1 細胞培養 將軟骨細胞T/C-28a2 培養于DMEM 高糖培養基中,培養基中補充10%的胎牛血清(FBS),以及培養基總體積1%的10000 unites/mL青霉素和10000 μg/mL 的鏈霉素,細胞在5%的CO2,37 ℃的恒溫培養箱中培養。
1.2.2 MTT 法檢測不同藥物對軟骨細胞存活率的影響 細胞以5×103個/孔的密度接種到96 孔板中,12 h 后每孔加入100 μL 濃度為0、1、10、100 μg/mL D-氨基葡萄糖,硫酸軟骨素,銀耳多糖,硫酸化銀耳多糖和氨糖軟骨素等的完全培養基并單獨設置只加磷酸緩沖液的調零組分別刺激細胞。將處理后的細胞置于37 ℃,5% CO2培養箱里培養。分別在藥物刺激1、3、6 d 后檢測細胞存活率。采用MTT 測定法,每孔加入20 μL 的濃度為5 mg/mL 的噻唑藍溶液,置于37 ℃培養箱中孵育4 h,吸盡上清,隨后加入150 μL DMSO(分析純)溶解甲臜結晶,搖床上600 r/min 振蕩10 min,在酶標儀中測定OD490的數值。再根據以下公式計算細胞存活率,公式為:
1.2.3 結晶紫染色測定不同藥物對軟骨細胞增殖的影響 取對數生長期的T/C-28a2 軟骨細胞,按1×104個細胞/孔鋪于24 孔板中。細胞貼壁后,棄去舊培養基,加入含不同藥物的完全培養基刺激細胞:D-氨基葡萄糖、氨糖軟骨素鈣片、硫酸軟骨素、硫酸化銀耳多糖和銀耳多糖;每種藥物設置濃度為1 μg/mL,同時設置僅含細胞不加任何藥物的陰性對照組,每個組設3 個復孔。3 d 后去除原細胞培養基,后用PBS 輕柔地洗2 次,每孔加入200 μL 配制好的結晶紫溶液,室溫靜置15 min。將孔板浸入蒸餾水多次,清洗24 孔板直至水變成無色,再將24 孔板倒置于37 ℃生化培養箱中烘干水分。在光源充足的條件下將24 孔板置于白色卡紙上拍攝結晶紫染色結果照片。后加入33%的乙酸溶液溶解結晶紫,600 r/min 振蕩10 min 后,使用酶標儀以490 nm 波長檢測。
1.2.4 酶聯免疫吸附法測定不同藥物處理軟骨細胞后的IL-6 表達 為了定量檢測細胞因子表達水平,收集不同藥物處理的細胞上清,樣品制備方法如下:
無LPS 刺激細胞上清樣品的制備:取對數生長期的T/C-28a2 軟骨細胞,5×106個細胞/孔鋪于6 孔板中。將細胞置于37 ℃,5% CO2培養箱里培養過夜。細胞貼壁后,棄去舊培養基,用PBS 清洗細胞2 次,隨后分別在孔內加入使用無血清DMEM 稀釋的1 μg/mL D-氨基葡萄糖、1 μg/mL 氨糖軟骨素、1 μg/mL 硫酸軟骨素、1 μg/mL 硫酸化銀耳多糖和1 μg/mL 銀耳多糖以及正常培養基。48 h 后,收集含不同藥物刺激細胞的上清,7000 r/min 離心10 min,收取細胞上清液并將其分裝到1.5 mL EP 管中,-20 ℃保存備用。
LPS 刺激細胞上清樣品的制備:取對數生長期的T/C-28a2 軟骨細胞,5×106個細胞/孔鋪于6 孔板中。將細胞置于37 ℃、5% CO2培養箱中培養過夜,待細胞貼壁后,棄去舊培養基,用PBS 清洗細胞2 次,隨后加入不含血清的DMEM 高糖培養基,饑餓培養24 h。除盡無血清培養基,用PBS 清洗2 次,分別在孔內加入使用無血清DMEM 稀釋的1 μg/mL的LPS,培養24 h。除去含有LPS 的培養基,分別在孔內加入使用無血清DMEM 稀釋的1 μg/mL 的D-氨基葡萄糖、氨糖軟骨素、硫酸軟骨素、硫酸化銀耳多糖和銀耳多糖及正常培養基,培養48 h。收集含不同藥物刺激細胞的上清,7000 r/min 離心10 min,收取細胞上清液并將其分裝到1.5 mL EP 管中,-20 ℃保存備用。
將收集的細胞上清稀釋10 倍并儲存于-80 ℃,使用ELISA 試劑盒測定IL-6(pg/mL)的濃度。具體為:將100 μL 一抗加入96 孔板,4 ℃孵育過夜,第二天使用pH7.5 的1×磷酸緩沖溶液沖洗3 次,每孔加入封閉液350 μL,室溫孵育 120 min。孵育結束后進行洗板,分別將 100 μL 樣品加入到相應的反應孔中,用封板膜封住反應孔并室溫孵育120 min。洗板后每孔加入250 μL 二抗孵育90 min,用磷酸緩沖溶液沖洗3 次,每孔加入 150 μL 顯色液。室溫下避光孵育 27 min,使用酶標儀測定450 nm 波長的吸光度,繪制標準曲線并得到回歸方程為Y=0.0108X+0.0792,(R2=0.9989),式中:Y 為樣品在450 nm 波長吸光值;X 為樣品IL-6 濃度(pg/mL)。
1.2.5 Western blot 檢測不同藥物處理后骨關節炎相關蛋白的表達 取對數生長期的人軟骨細胞T/C-28a2,以5×106個細胞/孔鋪于6 孔板中。置于37 ℃、5% CO2培養箱里培養過夜。細胞貼壁后,將培養基換成含有1 μg/mL 的D-氨基葡萄糖、氨糖軟骨素、硫酸軟骨素、硫酸化銀耳多糖和銀耳多糖的完全培養基以及無藥物的完全培養基,培養48 h。棄去培養基,每孔加入150 μL 蛋白質裂解緩沖液(1×,靜置3 min),用槍頭順時針攪動提取蛋白,收到的蛋白樣品100 ℃金屬浴10 min 使蛋白變性。配10%的分離膠,每孔15 μL 上樣跑SDS-PAGE 電泳。將電泳凝膠轉印至0.45 μm PVDF 膜,350 mA 2 h。5%脫脂奶粉室溫封閉2 h,洗脫后孵育一抗4 ℃過夜,洗脫后孵育二抗2 h,清洗之后滴加ECL 顯影液與化學發光成像儀曝光顯影,使用Image J 對蛋白條帶進行定量分析。
1.2.6 流式細胞術檢測不同藥物對ROS 釋放的影響取對數生長期的T/C-28a2 軟骨細胞,按3×106個細胞/孔鋪于12 孔板中。將細胞置于37 ℃,5% CO2培養箱里培養過夜。去除細胞上清,用冰PBS 沖洗細胞2 次,按照活性氧(ROS)檢測試劑盒說明,將試劑盒中Master Reaction Mix 以每孔450 μL 加入12孔板中,放置于5% CO2,37 ℃ 恒溫培養箱中孵育1 h,每孔加入50 μL 含有DMEM 無血清培養基稀釋的藥物,使其終濃度為1 μg/mL。設空白對照加入對應量PBS 處理,5% CO2,37 ℃ 孵育2 h。最后收集細胞進行流式檢測。
1.3 數據處理
每組試驗重復3~5 次,采用Graphpad Prism 9軟件繪圖,數據以平均值±標準偏差(Mean±SD)表示,并進行單因素方差分析(One-way ANOVA),使用Waller-duncan(W)進行多重比較分析。P>0.05表示無顯著性差異,P<0.05 表示差異有統計學意義,P<0.01 表示有顯著性差異,P<0.001 表示極顯著性差異。
2 結果與分析
2.1 銀耳多糖促進人軟骨細胞T/C-28a2 的增殖活性
分別用完全培養基稀釋的0(對照組)、1、10、100 μg/mL D-氨基葡萄糖、氨糖軟骨素、硫酸軟骨素、硫酸化銀耳多糖和銀耳多糖刺激T/C-28a2 細胞,以及在孔板中只加入磷酸緩沖溶液(調零組),分別在第1、3、6 d 通過MTT 的方式檢測藥物對細胞增殖的影響。結果如圖1 所示,加入上述5 種藥物后,硫酸化銀耳多糖對T/C-28a2 細胞有一定的細胞毒性作用,當藥物濃度1 μg/mL 時銀耳多糖能刺激T/C-28a2 細胞增殖。在處理3 d 后,銀耳多糖和硫酸軟骨素對T/C-28a2 細胞的增殖作用更加明顯。藥物濃度1 μg/mL 與10、100 μg/mL 相比,能明顯促進細胞增殖,因此確定1 μg/mL 為實驗濃度中相對合適作為進一步研究的濃度。
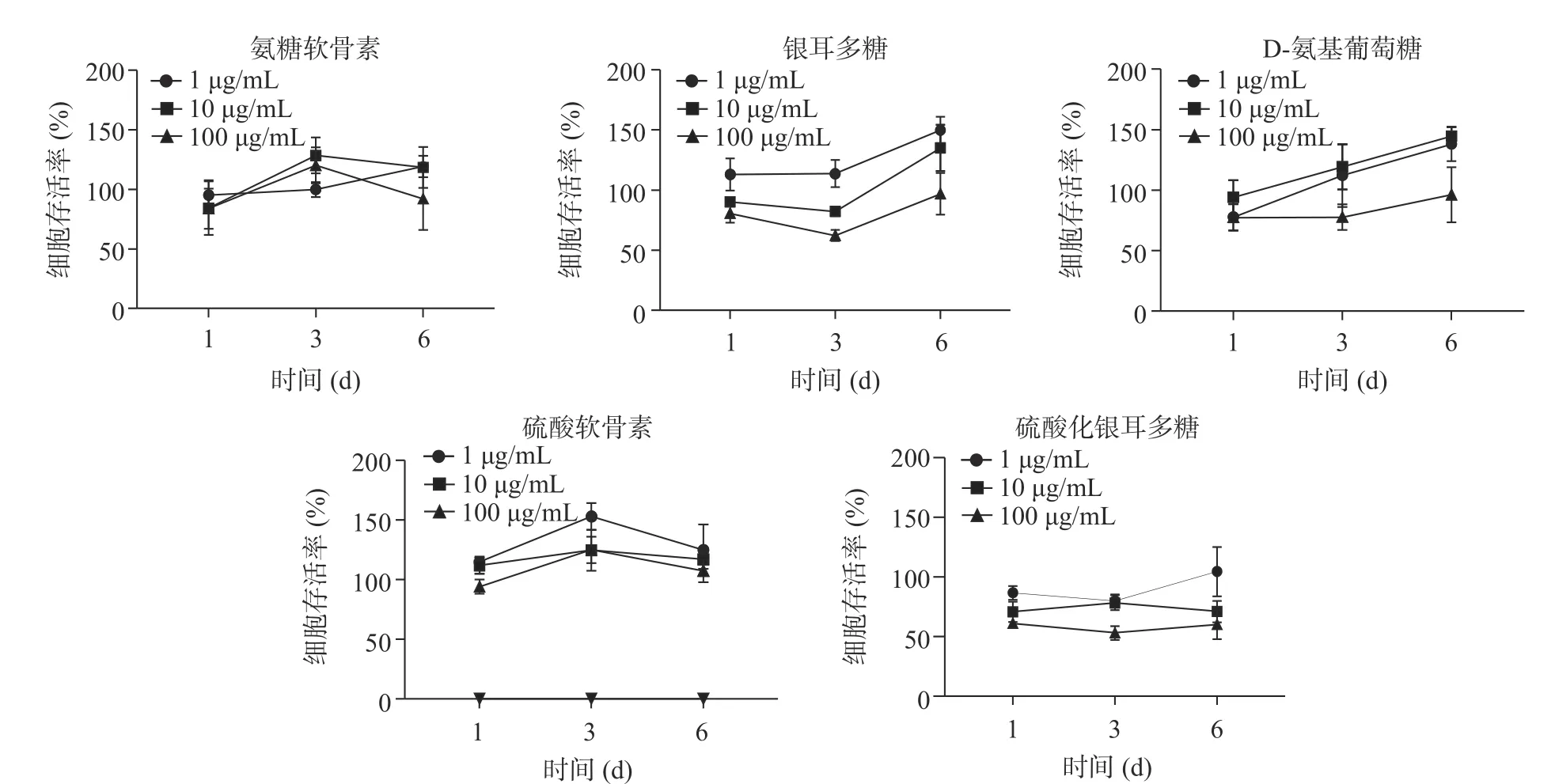
圖1 不同藥物在不同濃度作用下對人軟骨細胞T/C-28a2 的增殖活性Fig.1 Effect of different drugs at different concentrations on human chondrocyte T/C-28a2 cell viability
2.2 銀耳多糖對人軟骨細胞T/C-28a2 的細胞毒性效應
由于硫酸軟骨素對軟骨細胞T/C-28a2 的增殖作用有助于修復軟骨損傷。本實驗通過結晶紫染色進一步探究1 μg/mL D-氨基葡萄糖、氨糖軟骨素、硫酸軟骨素、硫酸化銀耳多糖和銀耳多糖對軟骨細胞的增殖作用,結果表明1 μg/mL 銀耳多糖、D-氨基葡萄糖、硫酸軟骨素、氨糖軟骨素均能刺激軟骨細胞T/C-28a2 的增殖(圖2)。其中,硫酸軟骨素(P<0.001)與銀耳多糖(P<0.05)處理人軟骨細胞,細胞增殖差異性更顯著。
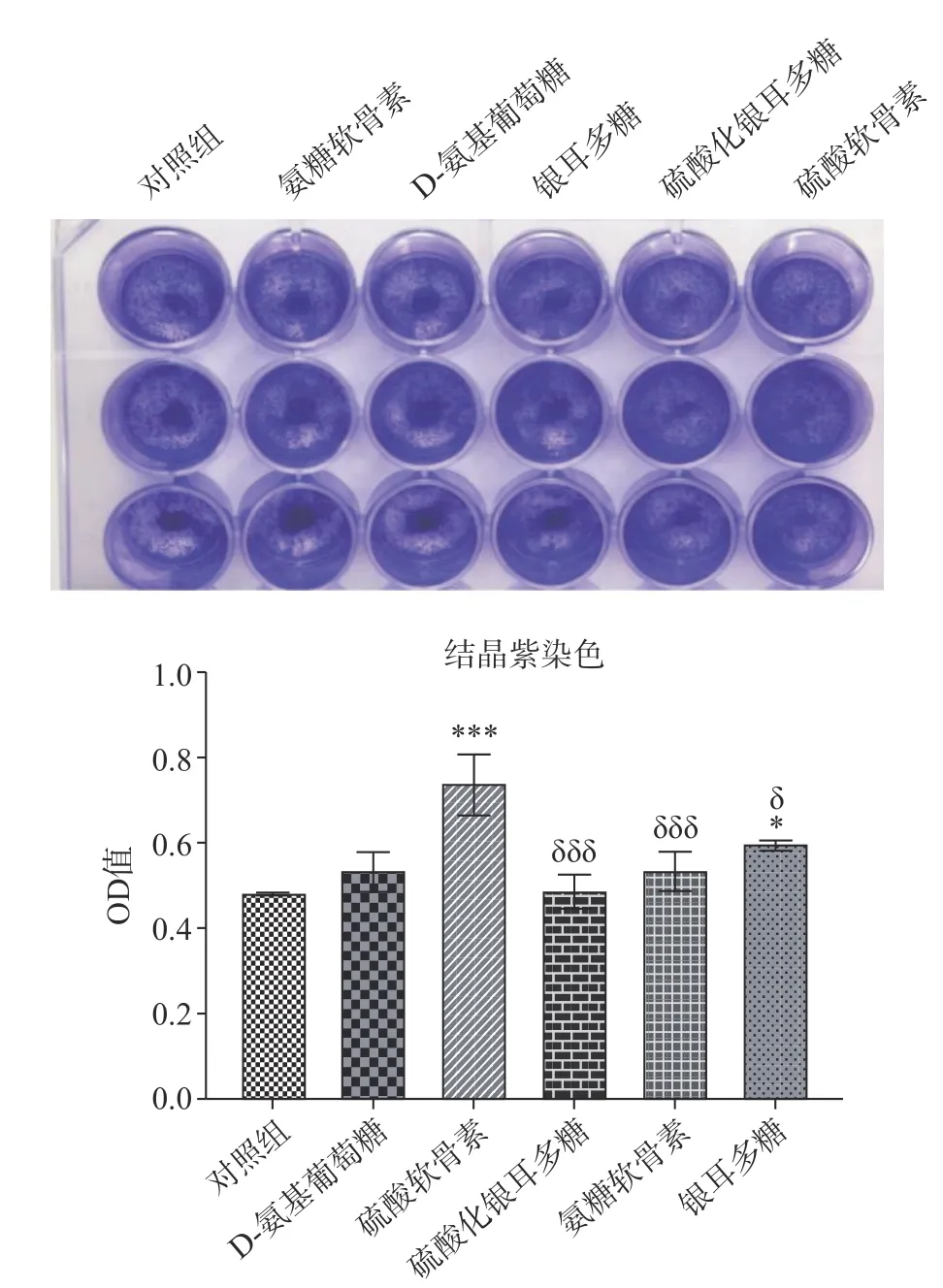
圖2 銀耳多糖對人軟骨細胞T/C-28a2 的毒性效應Fig.2 Toxic effects of Tremella fuciformis polysaccharide on T/C-28a2 in human chondrocytes
2.3 銀耳多糖抑制骨關節炎的炎癥水平
據報道,硫酸軟骨素(軟骨素4,6-硫酸鹽)已經用于治療人骨關節炎(OA),并取得了較好的治療效果[26-27]。研究顯示,在沒有加入脂多糖的情況下,所有藥物的加入均使IL-6 表達水平與對照組相比差異不顯著(P>0.05)(圖3a),在LPS 處理組中,硫酸化銀耳多糖(P<0.01)、氨糖軟骨素(P<0.001)與硫酸軟骨素處理組之間作用有顯著性或極顯著差異,銀耳多糖和氨糖軟骨素處理組之間有顯著性差異(P<0.01)(圖3b),這表明硫酸軟骨素的抑制炎癥的效果要高于以上幾種藥物。此外,銀耳多糖和硫酸軟骨素處理組之間IL-6 的表達沒有統計學差異,說明銀耳多糖和硫酸軟骨素藥效相近,而且銀耳多糖相對于其他藥物處理方式對于防止炎癥反應的發生更有效,這與已有文獻綜述植源性多糖可以緩解炎癥的發生[28]的結果一致。
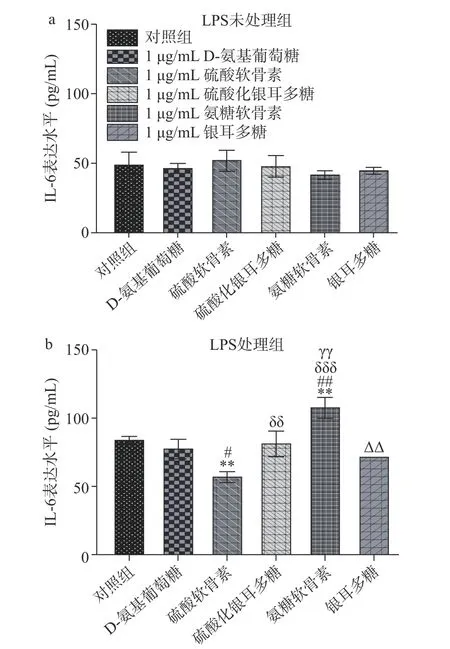
圖3 銀耳多糖對炎癥標志物IL-6 含量的影響Fig.3 Effect of Tremella fuciformis polysaccharide on the content of inflammatory marker IL-6
2.4 銀耳多糖促進骨保護和抑制骨關節炎的機制分析
為進一步研究藥物在分子水平上的作用機制、對骨組織的保護作用和藥物刺激對細胞凋亡的影響,利用Western blot 技術檢驗了相關蛋白的表達水平(圖4)。結果顯示,銀耳多糖和硫酸軟骨素處理能增加骨保護因子OPG 的表達,表明銀耳多糖和硫酸軟骨素具有骨組織保護作用。進一步檢測了NF-κB 和凋亡信號Bax 蛋白的表達量,發現使用銀耳多糖和硫酸軟骨素處理后它們的表達量相對對照組減少,這說明OA 發生發展中NF-κB 信號被抑制,且這兩種藥物可以有效的抑制細胞凋亡。

圖4 銀耳多糖對OA 相關蛋白表達的影響Fig.4 Effect of Tremella fuciformis polysaccharide on expression of OA-related proteins
2.5 銀耳多糖抑制軟骨細胞ROS 活性氧水平
為檢測銀耳多糖對軟骨細胞的氧化損傷和藥物安全性,進行了活性氧(ROS)釋放實驗[29]。結果表明,與無藥物處理的對照組相比,藥物處理組細胞的ROS 相對釋放量更少,特別是銀耳多糖(P<0.01)和硫酸軟骨素(P<0.001)處理組(圖5),這說明銀耳多糖和硫酸軟骨素可以阻礙大量ROS 產生,這可能進一步阻礙炎癥的發展。
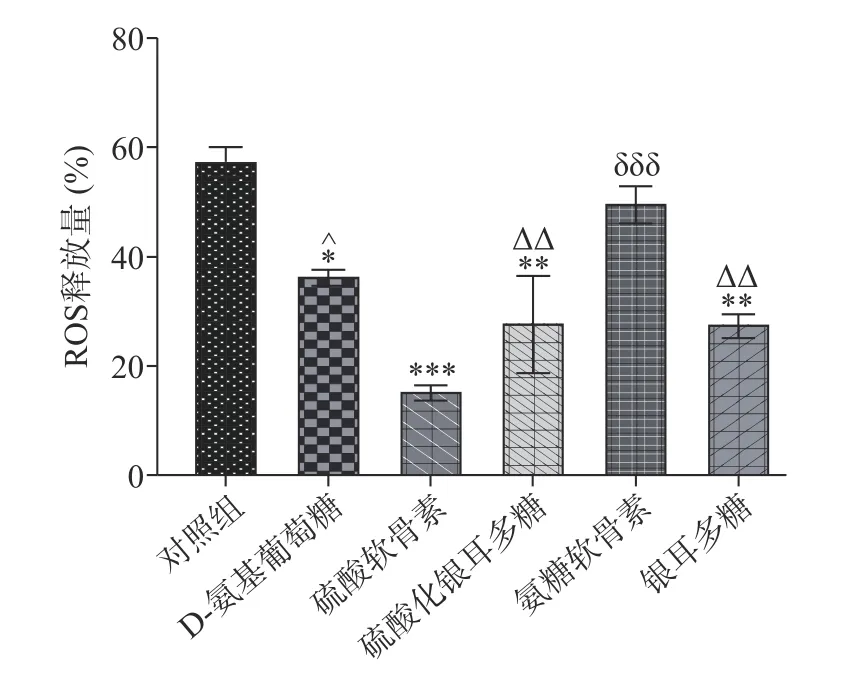
圖5 銀耳多糖處理人軟骨細胞后ROS 的釋放Fig.5 ROS release from human chondrocytes treated with Tremella fuciformis polysaccharide
3 討論與結論
目前,骨組織在早期骨關節炎中的變化原因尚不完全清楚,當軟骨細胞被內源或外源性的因素刺激時,通常會表現為軟骨細胞的凋亡[30-31]、細胞內炎癥因子的變化[32]和ECM 降解[33]等。本研究使用銀耳多糖刺激軟骨細胞發現,銀耳多糖促進了軟骨細胞的增殖,表現出了對軟骨細胞活力的促進作用。此外,研究發現骨關節炎軟骨細胞的凋亡與細胞凋亡因子Bax 上調有關[31],與本研究發現銀耳多糖刺激軟骨細胞Bax 表達下調一致,這表現出了銀耳多糖的抗凋亡效應。更進一步地,ERK1/2-MAPK 和JNK 途徑的激活會使細胞外基質(Extracellular cartilage matrix,ECM)的蛋白酶表達上調[31,34],骨微裂會刺激損傷區域的骨細胞產生NF-κB 信號[35]。當NF-κB 上調時,軟骨細胞會無法補償降解的ECM,導致細胞基質平衡障礙[36],細胞炎癥和骨組織結構退化[31,37],從而促進炎癥的發生。此外,當受體骨保護素OPG 失活時會導致骨吸收的發生[38-39]。本研究發現骨銀耳多糖處理軟骨細胞后,保護因子OPG 表達上調,而NF-κB、ERK1/2-MAPK 表達下調,因此推測銀耳多糖對軟骨細胞具有保護作用,并對骨關節炎具有抑制作用。
先前研究發現,退化軟骨組織或軟骨損傷環境中IL-6 水平增高,在IL-6/Stat3 模型中,IL-6 主要通過Stat3 信號誘導軟骨細胞分解代謝和軟骨細胞凋亡[40]。本實驗通過在軟骨細胞中加入LPS 模擬炎癥環境,對比了炎癥產生前后加入藥物后促炎因子IL-6的變化,發現在非炎癥環境下藥物刺激軟骨細胞產生的IL-6 水平沒有顯著性差異,而加入LPS 誘導后,硫酸軟骨素和銀耳多糖組與對照組相比IL-6 產生水平顯著降低。這表明在沒有發生炎癥反應時,藥物對細胞的作用相差不明顯,當炎癥發生時,銀耳多糖可以通過下調炎癥因子表達來發揮抗炎作用,因此推測銀耳多糖具有良好的抗炎活性,有效減緩骨關節炎的炎癥反應。
在OA 治療中,銀耳多糖對軟骨再生和清除自由基具有重要意義。高水平的ROS 可能會阻礙炎癥中骨軟骨組織的自然再生過程[33]。此外,活性氧(ROS)水平可能導致廣泛的氧化應激反應,高水平的ROS 可以導致細胞損傷[41]。本研究通過檢測不同藥物刺激下活性氧的變化,發現銀耳多糖的ROS釋放量顯著降低(P<0.05),說明銀耳多糖對軟骨細胞清除自由基具有影響,具有高抗氧化性和低細胞損傷的效用,并可能進一步抑制炎癥的發生。
綜上,本研究探討了銀耳多糖對骨關節炎的潛在影響,發現銀耳多糖具有抑制骨關節炎的效用,可以通過降低IL-6 產生的水平減少骨關節炎癥反應,OPG 的增加表明銀耳多糖可以在一定程度上保護軟骨組織,抵抗細胞凋亡。本研究發現銀耳多糖的抗炎作用及機制,為探索銀耳多糖作為抗炎藥物和OA治療提供了新的思路。

