北京地區醬香型白酒第四輪次入窖酒醅中微生物及風味物質的變化
黃慧芹,徐友強,2, ,李微微,2,張成楠,2,朱 華,王紅安,李秀婷,2
(1.北京工商大學食品營養與人類健康高精尖創新中心,北京 100048;2.北京市食品添加劑工程技術研究中心,北京 100048;3.北京華都釀酒食品有限責任公司,北京 102212)
傳統發酵白酒是中國特色蒸餾酒,生產歷史悠久[1]。由于自然環境、原料、發酵劑的種類和生產工藝不同,白酒形成了許多風格獨特的香型[2]。隨著白酒研究的不斷深入,人們也認識到不同香型白酒風味的形成與發酵微生物的組成和演替變化是緊密相關的。作為三大基本香型之一,醬香型白酒以優雅獨特的醬香味著稱[3],發酵過程需要一年時間,期間需要經歷7 輪次取酒[4]。普遍認為,第一輪、第二輪的基酒澀味大,這很可能是由于原料高粱中的化學物質單寧和多酚引起的,這些化學物質可以通過蒸餾遷移到基酒中,第三、第四和第五輪的基酒質量較好[5],又稱為“大回酒”,而第六輪和第七輪基酒質量再度變差,有苦味和焦糊的味道[6]。綜合比較,第四輪次的基酒風味最為突出[7-8],作為醬香型白酒勾調過程中最重要的組成部分,具有較高的研究價值。
微生物的代謝是醬香型白酒釀造過程物料轉化的內在動力[9],在整個釀造周期中,微生物種類和豐度處于動態變化之中,影響最終風味化合物的形成。醬香型白酒釀造工藝復雜,條件獨特,釀造過程的微生物來源主要包括大曲、酒醅和環境微生物三部分。在堆積發酵的整個過程中,酒醅暴露在開放式環境中,富集了許多環境中的微生物,這些微生物參與到后續入窖發酵過程中,賦予輪次酒獨特風味[10]。例如,王琳等[11]對茅臺鎮醬香型白酒的七個輪次發酵的釀造環境進行細菌菌群分析,在第四輪次中發現特殊菌屬Corynebacterium(棒狀桿菌屬),可利用環境中的碳源發酵產生賴氨酸改善酒的風味;張春林等[12]對第二輪次堆積發酵酒醅進行研究,發現對風味形成影響最大的微生物為Bacillus(芽孢桿菌屬)、Emericella(裸胞殼屬)、Oceanobacillus(海洋芽孢桿菌屬);胡小霞等[13]對堆積和窖池發酵過程的細菌菌群結構進行分析發現,入窖發酵過程中細菌多樣性和豐度均低于堆積發酵,即堆積發酵中富集的微生物需要在入窖發酵過程中進一步演替。這些研究表明,分析入窖之后酒醅發酵過程中微生物及風味物質變化具有重要意義,有助于合理調節白酒發酵過程,提高醬香型白酒產品質量。團隊前期研究[14]發現第五、六輪次酒醅中的優勢細菌屬均為Lactobacillus(乳芽孢桿菌屬)、Oceanobacillus(海洋芽孢桿菌屬)、Virgibacillus(枝芽孢桿菌屬),但入窖發酵過程中豐度并不一致,第六輪次優勢真菌屬為Issatchenkia(伊薩酵母屬)、Thermoascus(嗜熱子囊菌屬)和Byssochlamys(絲衣菌屬),而Thermoascus(嗜熱子囊菌屬)和Aspergillus(曲霉屬)的對應豐度遠低于第五輪,并提出第六輪次入窖酒醅中酯合成真菌的減少可能是酯類風味物質濃度下降的原因。團隊近期研究[15]通過分析前三輪次入窖酒醅的微生物和風味物質,發現第三輪入窖酒醅中的風味物質濃度有所提高,提出風味物質的變化是第三輪次基酒質量提高的重要原因。然而,總體來講目前對于醬香型白酒入窖酒醅發酵過程的研究較少,限制了人們對發酵過程的科學認知,特別是對于關鍵輪次第四輪次入窖酒醅發酵過程中微生物和風味物質的變化尚未見報道。
本文通過高通量測序技術對北京地區醬香型白酒第四輪次入窖發酵過程中酒醅微生物群落結構進行了研究,分析了微生物菌群的演替變化;利用頂空固相微萃取-氣相色譜-質譜聯用技術對酒醅的揮發性風味成分進行了定性和相對定量分析。通過分析白酒發酵過程中微生物及風味物質的變化,定位核心微生物,探討微生物與風味物質的相互關聯,從中挖掘與風味相關的功能微生物,有助于為后續通過功能微生物理性擾動發酵體系,為提高北京地區醬香型白酒的產品品質提供基礎數據依據。
1 材料與方法
1.1 材料與儀器
磷酸緩沖液、Taq DNA 聚合酶試劑盒 北京全式金生物技術有限公司;4-辛醇(色譜級)天津福晨化學試劑有限公司;瓊脂糖 南京生興生物技術有限公司;50×TAE 緩沖液 北京索萊寶科技有限公司;DNA Marker Takara;核酸染料Gengreen 上海賽百盛有限公司;引物 上海捷瑞生物工程股份有限公司;E.Z.N.A.Soil DNA Kit 試劑盒 Omega Bio-Tek公司。
CP153 電子天平 奧豪斯儀器(上海)有限公司;T100-Thermal Cycler PCR 儀 美國Bio-Rad 公司;EPS301 瓊脂糖凝膠電泳儀 北京六一儀器廠;YXQ-LS-50SII 立式壓力蒸汽滅菌器 上海博迅實業有限公司醫療設備廠;Aquaplore3S 超純水系統美國艾科浦公司;KQ5200DA 超聲波清洗儀 上海超聲儀器廠;GC 7890-5975 MSD 氣相色譜-質譜聯用儀 美國安捷倫科技有限公司。
1.2 實驗方法
1.2.1 抽樣方法 酒醅樣品采自北京華都酒廠窖池發酵生產車間2020 年第四輪次12 號南池入窖發酵酒醅,入窖前已提前進行5 d 的薄層堆積發酵。根據前期研究基礎[15],入窖酒醅選取入窖0、7、14、21、30 d 為取樣時間點,15 點取樣,窖池發酵周期為30 d。在每個取樣時間點取樣時,按酒醅上、中、下三個層面,每個層面選擇中間及四周邊緣位置采取樣品,取樣位點參考圖1,各層樣品混勻后作為一個時間點的取樣樣品。將采集的樣品分為兩份:一份用于提取總DNA,另一份儲存在-80 ℃用于進行微生物群落結構分析。
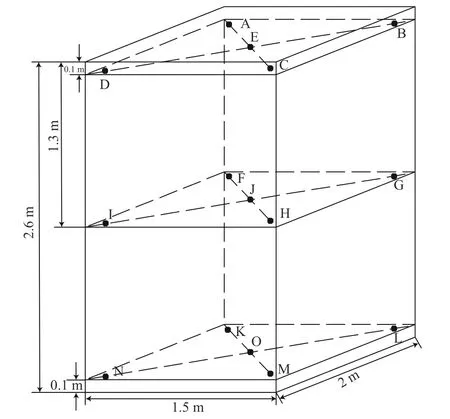
圖1 醬香型白酒第四輪次入窖酒醅取樣位點參考Fig.1 Sampling sites of Sauce-flavored Baijiu in the fourthround of cellar
1.2.2 樣品DNA 提取和PCR 擴增 通過E.Z.N.A.Soil DNA Kit 提取試劑盒提取酒醅樣品中的微生物宏基因組,提取步驟參照說明書。根據前期研究方法[16]進行基因擴增,細菌擴增16S rRNA 基因所用引物,338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTA CHVGGGTWTCTAAT-3');真菌擴增18S rRNA 基因所用引物,ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3'),使用1%瓊脂糖凝膠電泳檢測目的條帶大小。
基因PCR 體系如表1 所示;基因擴增方法如表2 所示。

表1 PCR 反應體系Table 1 PCR reaction system
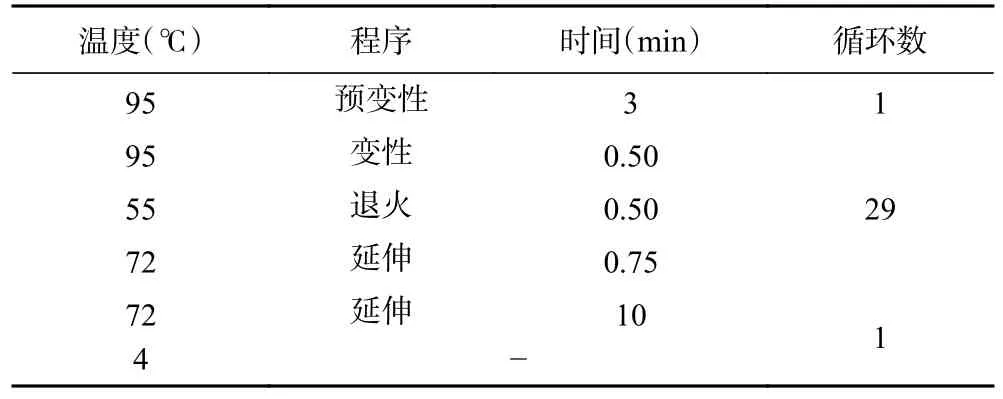
表2 PCR 反應程序Table 2 PCR reaction procedure
1.2.3 Illumina 公司MiSeq 測序 將純化的擴增產物等分子量匯集在Illumina MiSeq PE300 平臺/NovaSeq PE250 平臺(Illumina,上海),并根據上海Majorbio生物制藥科技有限公司(中國,上海)的標準方案進行配對端測序。原始測序數據已提交到NCBI SRA 數據庫,提交編號為SUB8652827。
1.2.4 揮發性化合物的提取與分析 結合宮俐莉等[17]的研究,本研究通過頂空-固相微萃取分析揮發性化合物。樣品前處理方法參照李鳳蘭等[5]的研究進行:準確稱取2.00 g 酒醅樣品于20 mL 頂空瓶中,向其中加入5 mL 的飽和氯化鈉溶液,加入6 μL 4-辛醇(0.5 mg/mL)作為內標物,以90 W 功率超聲10 min。頂空-固相微萃取使用TG-5MS 色譜柱(30 m×0.25 mm×0.25 μm,J&W Science,Folsom,CA,USA),通過火焰電離檢測器分析風味化合物。氣相色譜條件:溫度以2 ℃/min 的速率升至100 ℃并保持5 min,然后以2 ℃/min 的速率升至150 ℃并保持2 min,最后以10 ℃/min 速率升至230 ℃并保持5 min。氦氣載氣的流速為1.5 mL/min。質譜采用電子轟擊電離(EI)離子源,離子源溫度230 °C,電子能量70 eV,離子掃描范圍為35~450 m/z。風味成分的鑒定通過與NIST 11 a.L 數據庫(安捷倫科技公司)中的標準質譜圖進行比對,使用內標法對風味化合物進行相對定量分析。通過自動積分程序獲得各色譜峰的面積,計算樣品中各組分峰面積分別與內標物質峰面積之比,定量各風味組分的含量。酒醅中風味物質的定量數據處理主要采用Microsoft Office Excel 2021 應用程序進行數據計算,通過TBtools、R 語言完成相關圖形的繪制。
1.3 數據處理
所有測定平行三次進行,結果表示為平均值±標準差。方差分析使用SPSS 26.0 軟件(SPSS Inc.,美國伊利諾伊州芝加哥)進行。使用Origin 8.5 軟件進行揮發性成分分析和微生物圖譜分析。采用Pheatmap 軟件包進行相關性分析,使用相關熱圖進行可視化,分析風味物質與微生物之間的關聯性。
2 結果與分析
2.1 第四輪次釀造過程中微生物群落結構多樣性
2.1.1 細菌多樣性 稀釋曲線可以比較不同的測量數據樣本的物種豐富度,也可以說明樣本的測序數據量是否合理,圖2 中稀釋性曲線趨于平坦,說明測序的數據量和豐富度是合理的[18]。圖2a 展示了醬香型白酒第四輪次入窖酒醅細菌樣本的稀釋曲線在測序數5000 時驟增,后逐漸趨于平坦,這表明本實驗的各細菌樣本測序數據量合理,測序深度達到要求,與實際生物信息相符合。利用Shannon 曲線對不同樣本的物種多樣性進行了比較,如圖2b 所示,所有樣本中細菌的Shannon 曲線在測序數1000 左右時驟增,后變得平坦,說明測量數據的量可以覆蓋樣本中絕大多數細菌多樣性信息,測序數據量和深度是可靠的。實際測量結果可以代表樣本的實際情況。
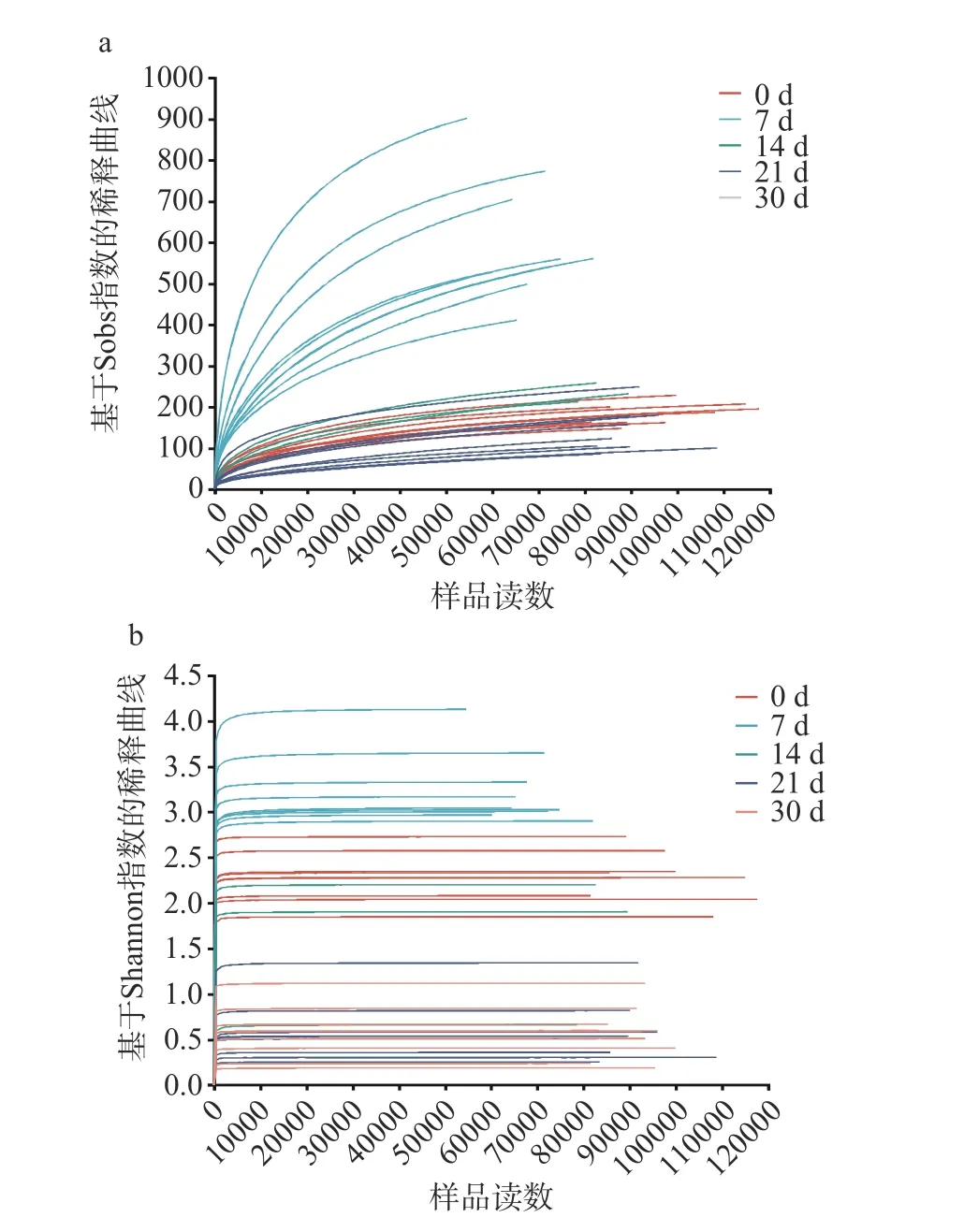
圖2 醬香型白酒第四輪次入窖酒醅的細菌樣本基于Sobs 指數與Shannon 指數的稀釋曲線圖Fig.2 Dilution plots of bacterial samples of the fourth round Jiupei of sauce-flavored Baijiu based on the Sobs index and the Shannon index
門水平上,在醬香型白酒第四輪次入窖酒醅中共檢出16 個細菌門。圖3a 展示了酒醅中相對豐度大于1%的細菌門,有Firmicutes(厚壁菌門)、Proteobacteria(變形菌門)、Actinobacterieta(放線菌門)。在整個發酵期間,Firmicutes(厚壁菌門)一直處于絕對的優勢地位,平均相對豐度>85%,該結果與醬香型白酒(山東產區)[19]、清香型白酒[20]、濃香型白酒[21]、芝麻香型白酒[22]研究結論一致。在醬香型、芝麻香型、清香型白酒釀造過程中發現Firmicutes(厚壁菌門)也是主要細菌門,說明Firmicutes 是中國白酒發酵過程中的關鍵微生物。不同的是,南方產區的醬香型白酒優勢細菌門有兩種,研究發現貴州產區的醬香型白酒發酵過程中,Firmicutes(厚壁菌門)、Proteobacteria(變形菌門)兩個門占主導地位[9]。以上結果表明白酒發酵中后期(14~30 d),細菌門水平群落多樣性降低,發酵微生態結構由多菌系演替為單一的Firmicutes(厚壁菌門)為主導的發酵模式,是白酒酒醅發酵細菌門水平演替的普遍模式。目水平上,共檢出89 個細菌目,豐度大于1%的有9 個,包括Lactobacillales(乳酸桿菌目)、Bacillales(桿菌目)、Thermoactinomycetales(熱放線菌目)、Pseudomonadales(假單胞菌目)、Propionibacteriales(丙酸桿菌目)、Burkholderiales(伯克霍爾德氏菌目)、Staphylococcales(葡萄球菌目)、Acetobacterales(醋酸菌目)、Enterobactrales(腸桿菌目)(如圖3b 所示)。在發酵前期(1~14 d),Lactobacillales(乳酸桿菌目)相對豐度較低,Bacillales(桿菌目)則相對豐度較高,其次是Thermoactinomycetales(熱放線菌目)。發酵14 d,細菌物種多樣性豐富且相對豐度分布比較多樣。之后,Lactobacillales(乳酸桿菌目)相對豐度顯著增加,說明此時的環境適宜乳酸桿菌的生長,此時窖池處于厭氧環境,厭氧型細菌成為優勢種群出現,且一直持續到出窖階段。屬水平上,共檢出260 個細菌屬,豐度大于1%的有16 個,如圖3c 所示,其中平均相對豐度較高的10 個菌屬包括Lactobacillus(乳酸桿菌屬)、Virgibacillus(枝芽孢桿菌屬)、Kroppenstedtia(克羅彭斯特菌屬)、Oceanobacillus(海洋芽孢桿菌屬)、Bacillus(芽孢桿菌屬)、Thermoactinomyces(高溫放線菌屬)、Pseudomtonas(假單胞菌屬)、unclassified_f_Bacillacese(未分類芽孢細菌屬)、Scopulibacillus(火山渣芽胞桿菌屬)、Ralstonia(羅爾斯通菌屬)。其中,Lactobacillus(乳酸桿菌屬)占細菌數量的3.55%~89.96%,平均相對豐度為67.70%,入窖初期相對含量較低,在入窖第21 d 達到最高值,后期保持在較高水平。Virgibacillus(枝芽孢桿菌屬)占細菌數量的2.90%~26.32%,平均相對豐度為14.28%,Kroppenstedtia(克羅彭斯特菌屬)占細菌數量的2.32%~25.57%,平均相對豐度為10.70%,兩個菌屬在入窖初期相對含量較高,相對豐度均在入窖第21 d開始降低。
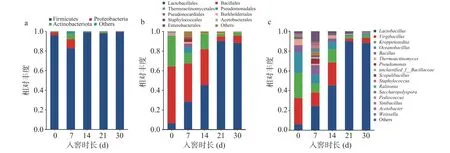
圖3 醬香型白酒第四輪次入窖酒醅中門、目、屬水平細菌群落組成Fig.3 Composed of bacterial communities in the middle of the door,order and genus of the fourth round Jiupei of sauce-flavored Baijiu
發酵0 d 時,酒醅中Virgibacillus(枝芽孢桿菌屬)相對豐度最高,Kroppenstedtia(克羅彭斯特菌屬)、Oceanobacillus(海洋芽孢桿菌屬)、Lactobacillus(乳桿菌屬)、Bacillus(芽孢桿菌屬)和Thermoactinomyces(熱放線菌屬)依次降低。在發酵第7 d,Lactobacillus(乳桿菌屬)在酒醅中的相對豐度明顯增大,Virgibacillus(枝芽孢桿菌屬)、Kroppenstedtia(克羅彭斯特菌屬)、Oceanobacillus(海洋芽孢桿菌屬)的相對豐度均降低。發酵14 d,豐度小于1%的其余細菌總相對豐度占比增加。與目水平一致的是,發酵前期(0~7 d)以Virgibacillus(枝芽孢桿菌屬)和Kroppenstedtia(克羅彭斯特菌屬)兩個為優勢屬,14 d 始,Lactobacillus(乳桿菌屬)演替為絕對的優勢屬,這表明細菌在整個發酵階段以發酵14 d為分界線出現了明顯的優勢屬的交替,在第一、二、五、六輪次的發酵14 d 入窖酒醅中均發生了優勢屬Lactobacillus的相對豐度明顯升高的現象[14-15]。
隨著發酵時間的延長,發酵中后期Lactobacillus(乳桿菌屬)相對豐度增加,尤其是發酵第14 d 開始相對豐度顯著增加,且一直維持到出窖,這期間窖池處于厭氧狀態,適應厭氧呼吸的乳桿菌屬快速生長,一些好氧或兼性好氧性細菌生長受到抑制,這也是細菌演替變化的表現,在王玉榮等[23]的研究中也發現Lactobacillus為第四輪次出窖酒醅中的絕對優勢細菌屬。而作為好氧的枝芽孢桿菌屬則是呈現明顯的減少趨勢,與乳桿菌屬相比,幾乎呈現完全相反的變化趨勢。研究將平均相對豐度>1%且至少在50%的樣品中豐度超過1%的微生物定義為核心微生物[24-25],本文將醬香型白酒第四輪次入窖酒醅的優勢細菌屬定位到乳桿菌屬和芽孢桿菌屬,這兩種優勢細菌屬在多種香型白酒發酵過程均有報道[19-20,22,26]。芽孢桿菌可代謝產生多種水解發酵原料的酶類,包括淀粉酶、糖化酶、蛋白酶等,發酵時產生吡嗪類、有機酸等風味物質,對于白酒風味具有重要影響[27-29]。乳桿菌屬在發酵過程中利用糖類產生乳酸,為乳酸乙酯的合成提供前體物質,提高了酒體的醇厚感,其產生的有機酸類也與酒體酸味呈現顯著的相關性[26,30]。此外,與南方醬香型白酒發酵中優勢細菌屬相比[12],Virgibacillus(枝芽孢桿菌屬)、Oceanobacillus(海洋芽孢桿菌屬)、Ralstonia(羅爾斯通菌屬)是北京地區醬香型白酒發酵中獨有的優勢細菌屬,而這些特有菌屬在白酒釀造中的功能及對白酒風味的貢獻尚無深入研究。以上結果表明北京地區醬香型白酒發酵優勢細菌屬除了具有和南方地區醬香型白酒發酵的優勢共性細菌屬外,還存在著其所特有的優勢細菌屬(圖3c)。
2.1.2 真菌多樣性 如圖4a 所示為醬香型白酒第四輪次入窖酒醅中所測樣品的真菌Sobs 指數稀釋曲線,各真菌樣本的測序數據量合理,測序深度足夠,與實際生物信息相符合。如圖4b 所示,所有樣品的真菌Shannon 曲線在測序數在1000 左右時均趨向平坦,說明本實驗中樣本的測序數據量足夠大,已經覆蓋了樣本中絕大多數真菌的多樣性信息,結果科學可靠。
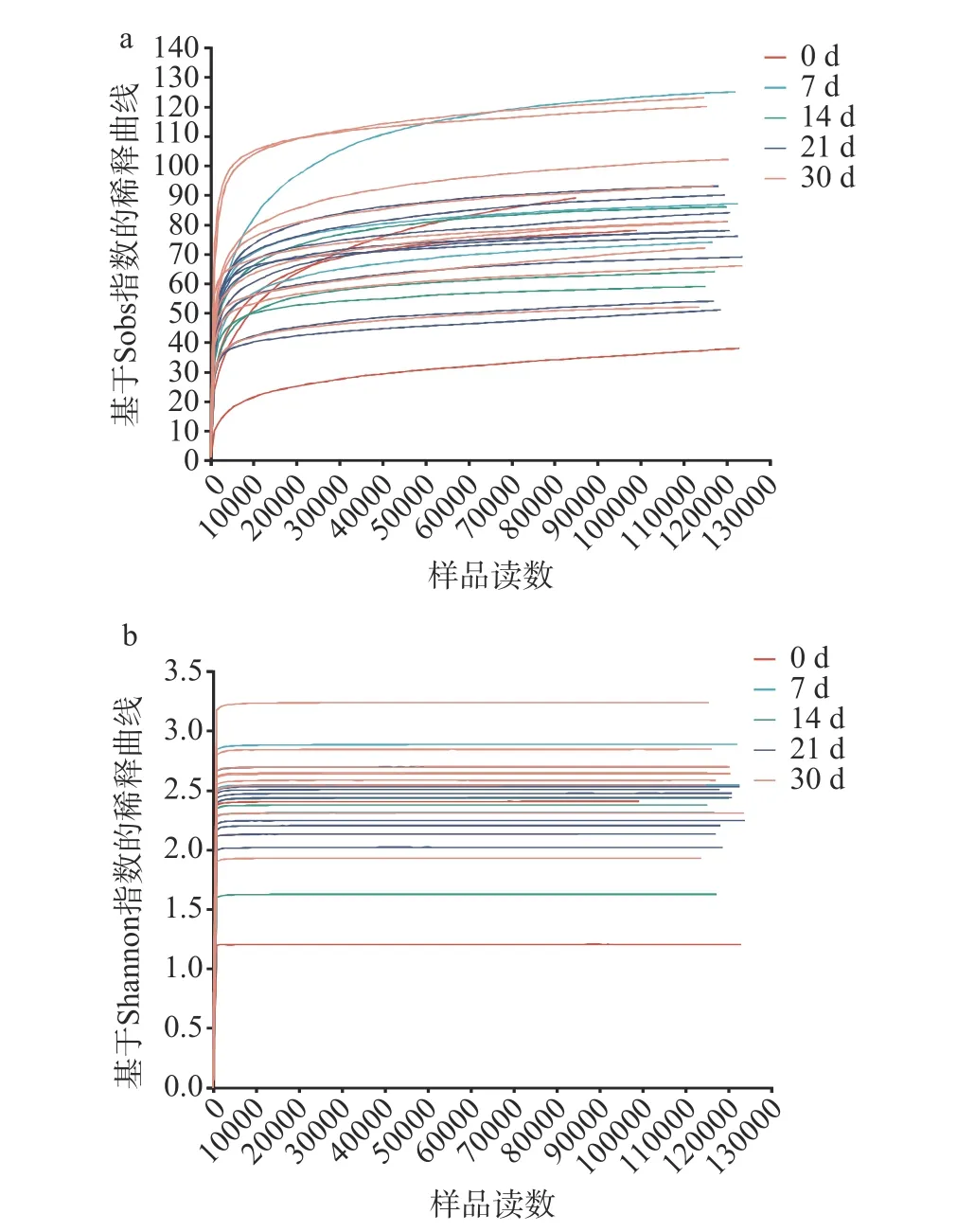
圖4 醬香型白酒第四輪次入窖酒醅的真菌樣本基于Sobs 指數與Shannon 指數的稀釋曲線圖Fig.4 Dilution plots of fungal samples of the fourth round Jiupei of sauce-flavored Baijiu based on the Sobs index and the Shannon index
門水平上,在醬香型白酒第四輪次入窖發酵酒醅中共檢測到7 個門,其中豐度大于1%的真菌門包含Ascomycota(子囊菌門)、Basidiomycota(擔子菌門)(圖5a)。其中,Ascomycota(子囊菌門)在醬香型白酒第四輪次入窖發酵過程中相對豐度達95%以上,占絕對主導地位,這與戴亦杰[31]研究結果相同,說明在白酒發酵過程中,真菌門水平群落多樣性較低,發酵微生態結構是由Ascomycota 和Basidiomycota 為主導的真菌微生物組合。

圖5 醬香型白酒第四輪次入窖酒醅中門、目、屬水平真菌群落組成Fig.5 Composed of fungal communities in the middle of the door,order and genus of the fourth round Jiupei of sauce-flavored Baijiu
目水平上,共檢出36 個真菌目,豐度大于1%的有7 個,包括Eurotiales(散囊菌目)、Saccharomycetales(酵母菌目)、unclassified_p_Ascomycota(未分類子囊菌目)、Trichosporonalles(毛孢菌)、Microascales(小囊菌目)、Hypocreales(肉座菌目)、Pleosporales(格孢腔菌目)(圖5b)。在發酵期間,Eurotiales 相對豐度呈現先增加后穩定的趨勢,在第21 d處于最高值。相反的,Saccharomycetales 的相對豐度逐漸減小,同樣,在第30 d 達到最小值。在目水平上,Eurotiales 和Saccharomycetales 占據絕對優勢。
屬水平上共檢出169 個真菌屬,豐度大于1%的有16 個,其中排名前10 的包括Thermoascus(嗜熱子囊菌屬)、Aspergillus(曲霉屬)、Issatchenkia(伊薩酵母屬)、Pichia(畢赤酵母屬)、Thermomyces(嗜熱真菌屬)、Rasamsonia、unclassified_o_Saccharomycetales(未分類酵母菌屬)、Monascus(紅曲霉屬)、Byssochlamys(絲衣霉屬)、Penicillium(青霉屬)(圖5c)。其中,Thermeascus(嗜熱子囊菌屬)占真菌數量的15.34%~45.46%,平均相對豐度為35.40%,在入窖第14 d 達到最高值。Aspergillus(曲霉屬)占真菌數量的3.44%~20.74%,平均相對豐度為14.76%,在入窖第7 d 相對含量開始劇增,在第14 d 達到最高值。Issatchenkia(伊薩酵母屬)占真菌數量的2.46%~35.92%,平均相對豐度為14.45%,在發酵前期相對豐度較高,后逐步下降。在整個發酵期間,Thermeascus(嗜熱子囊菌屬)、Aspergillus(曲霉屬)相對豐度呈現逐漸增加的趨勢,相反的,Issatchenkia(伊薩酵母屬)相對豐度呈現減少的趨勢,這與目水平的結果一致,也進一步說明了Thermeascus(嗜熱子囊菌屬)、Aspergillus(曲霉屬)和Issatchenkia(伊薩酵母屬)均為優勢屬。
真菌的代謝活動產生了豐富的酶類物質,如酸性蛋白酶、纖維素酶、糖化酶、液化酶、酯化酶等,這些酶類物質對于糧食中大分子的物質如蛋白質、淀粉、脂質等起到了一定的轉化作用[32]。雖然不同香型白酒主要的香味物質不同,但它們共同的特點是大部分都來自于釀造過程中微生物的代謝,真菌群落組成結構分析結果顯示,霉菌、酵母菌占比較大,這與后期白酒的酒精含量和香氣成分緊密相關。酵母菌和霉菌作為主要的功能菌,酵母菌通過代謝活動產生酒精,霉菌則為發酵前期生成有機酸和酯類物質的主要菌種[33]。在醬香型白酒的生產中,通過吸附萃取和熱脫附結合氣質聯用儀測定白酒中酯類成分,可以發現霉菌不僅代謝產生檸檬酸、葡萄糖酸、草酸等有機酸,還能生成淀粉酶、蛋白酶等酶制劑[34]。綜合分析上述結果,醬香型白酒第四輪次入窖發酵酒醅中的核心微生物包括細菌屬的Lactobacillus(乳酸桿菌屬)、Kroppenstedtia(克羅彭斯特菌屬)、Virgibacillus(枝芽孢桿菌屬),以及真菌屬的Thermeascus(嗜熱子囊菌屬)、Issatchenkia(伊薩酵母屬)、Aspergillus(曲霉屬)。醬香型白酒第四輪次入窖酒醅中,與細菌多樣性相比,真菌的多樣性差異較小,其余輪次中酒醅的微生物多樣性與第四輪次類似,也表現為真菌多樣性低于細菌多樣性的特征[14-15]。
2.2 第四輪次釀造過程中風味物質變化
2.2.1 白酒發酵過程酒醅風味物質分析 第四輪次酒醅樣品共檢出50 種揮發性物質,包含酯類28 種、醇類9 種、脂肪酸5 種、醛類2 種、其他化合物6 種。表3 展示了酒醅中揮發性化合物的相對含量, 其中酯類占比最高,其次是醇類和酸類。在白酒發酵過程中醇類、酯類、酸類化合物的含量隨著入窖發酵時間的增加呈現先上升后下降的規律,而總酯相對含量在每一個發酵時間點都較高。
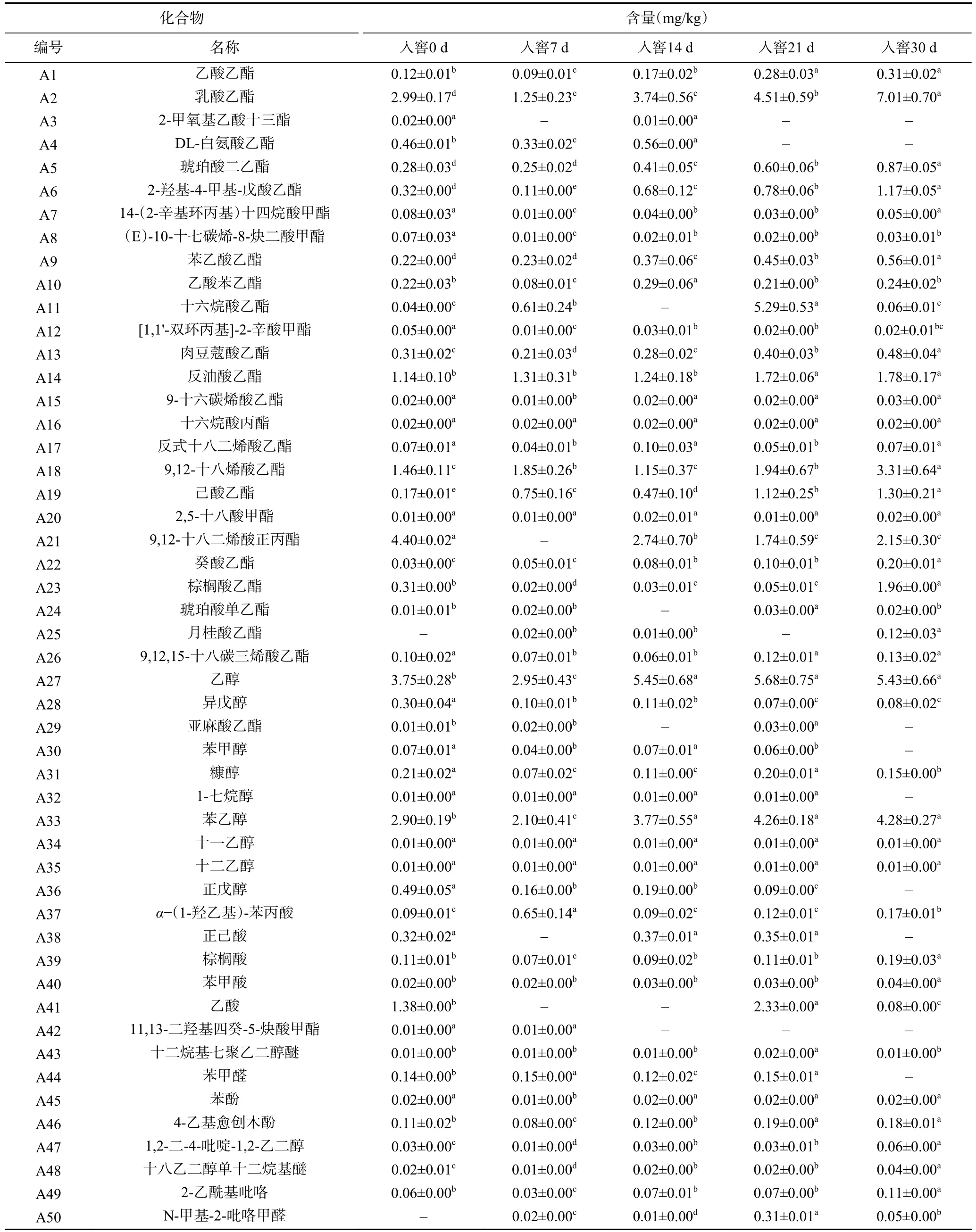
表3 基于氣相色譜-質譜分析的樣品揮發性化合物含量(mg/kg)Table 3 Volatile compound content of samples based on GC-MS spectrometry (mg/kg)
發酵30 d 時酒醅中揮發性化合物中,酯類物質的種類是所有測出的揮發性成分中最豐富的。我國的白酒與其他蒸餾酒的不同之一就是以酯香為主,尤其是體現在醬香型白酒中[35],大回酒酒質較好就是由于酯類、酸類物質占比高[36]。戴奕杰等[37]的研究顯示在酒質較好的“大回酒”中,四大酯(乙酸乙酯、乳酸乙酯、丁酸乙酯和己酸乙酯)的含量達到了釀造過程中的最高含量。本研究中乳酸乙酯(7.01±0.70 mg/kg)含量最高,其次是(E)-9-十八烯酸乙酯(3.31±0.64 mg/kg)、己酸乙酯(1.30±0.21 mg/kg)、琥珀酸二乙酯(0.87±0.05 mg/kg)、乙酸乙酯(0.31±0.02 mg/kg)等,均高于前三輪次入窖酒醅相應的酯含量[15],為醬香型白酒提供酯香風味。其中,乳酸乙酯含量由0 d 的2.99±0.17 mg/kg 提高到7.01±0.70 mg/kg;己酸乙酯含量由0.17±0.01 mg/kg 提高到1.30±0.21 mg/kg;乙酸乙酯含量由0.12±0.01 mg/kg 提高到0.31±0.02 mg/kg。醇類在21 d 含量最高,其中乙醇含量最高,其次為苯乙醇、糠醇、正戊醇、異戊醇、苯甲醇。其中乙醇含量由 0 d 的 3.75±0.28 mg/kg 增加到 21 d 的5.68±0.75 mg/kg,此后含量基本穩定不變;苯乙醇是除乙醇以外含量最高的醇類物質,含量由 0 d 的 2.90±0.19 mg/kg 增加到 30 d 的 4.28±0.27 mg/kg,在發酵后期(21~30 d)基本保持不變。高級醇在形成酒的味道、提高酒的豐滿度和厚重感方面起著重要作用,它不僅本身可以呈香呈味,而且是白酒中甜味劑和助香劑的主要來源[38-39]。21 d 酒醅中酸性物質含量較高,出窖時含量降低,酸性物質中乙酸含量最高,其次為正己酸、α-(1-羥乙基)-苯丙酸、棕櫚酸、苯甲酸。與其它香型相比,醬香型白酒中含量最高的酸是乙酸和丙酸[40],尤其是乙酸,在本研究中酒醅乙酸相對含量也較為突出,酸類物質的作用主要是影響白酒的口感和后味,起到呈香、助香、減少刺激和緩沖平衡的作用。在發酵過程中,其他揮發物(如酚類和醛類)的量沒有觀察到顯著差異。
2.2.2 風味化合物與微生物群落的相關性 微生物代謝是白酒中風味化合物的重要來源,如Lactobacillus等產酸微生物使白酒酸味增加,Bacillus、Saccharomyces等相對豐度的提高能夠使醛酮類、酯類等香氣成分含量增加[41],圖6 分析了北方醬味白酒第四輪次發酵過程中不同微生物與風味物質的相關性。
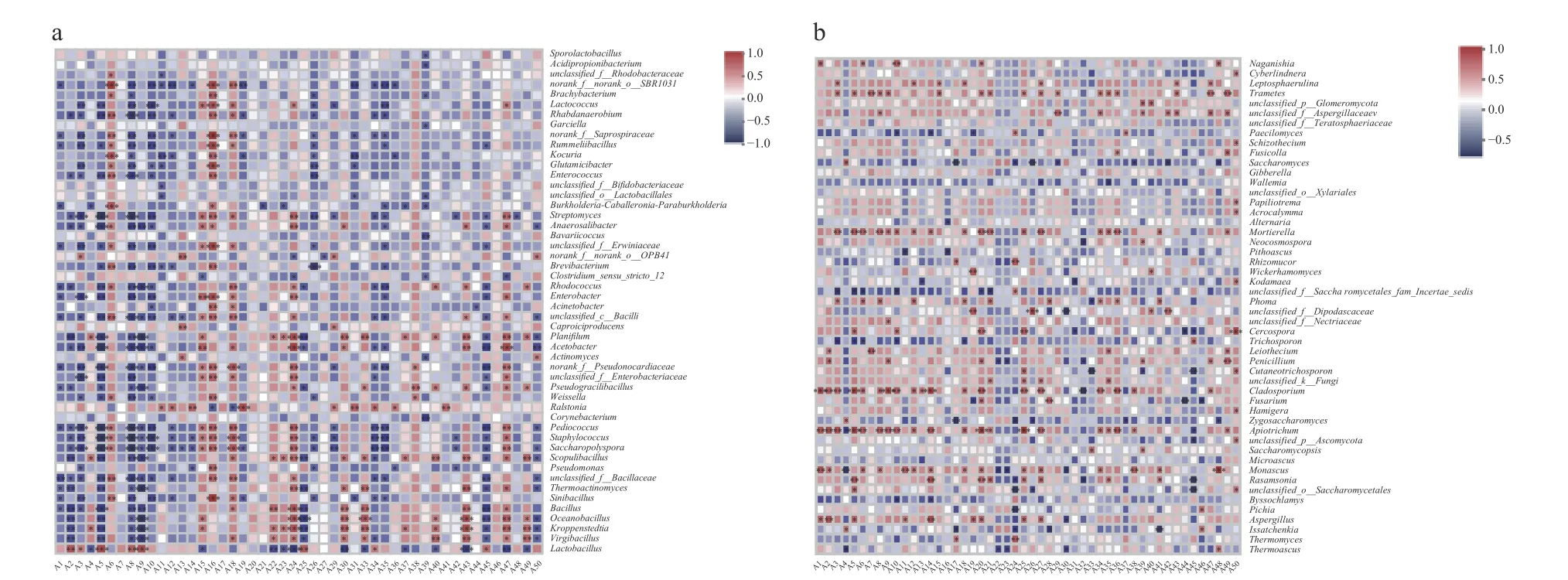
圖6 醬香型白酒第四輪次入窖酒醅微生物群落與風味化合物的相關性Fig.6 Correlation between the microbial community and flavor substances in the fourth round Jiupei of sauce-flavored Baijiu
在關鍵細菌群落中(圖6a),Lactobacillus與乳酸乙酯(A2)、琥珀酸二乙酯(A5)、(E)-10-十七碳烯-8-炔二酸甲酯(A8)、苯乙酸乙酯(A9)、月桂酸乙酯(A25)等呈顯著正相關(P<0.01),結合已報道的其余輪次入窖發酵情況,發現Lactobacillus在醬香型白酒發酵過程中具有重要的酯類合成作用[14-15,42],是一種重要的功能微生物;Virgibacillus與苯甲酸(A40)、十二烷基七聚乙二醇醚(A43)、1-(1H-吡咯-2-基)-乙酮(2-乙酰基吡咯)(A49)呈顯著正相關(P<0.01),與乳酸乙酯(A2)、琥珀酸二乙酯(A5)和苯乙酸乙酯(A9)呈顯著負相關(P<0.01);同樣地,Kroppenstedtia與琥珀酸單乙酯(A24)、苯甲醇(A30)、苯乙醇(A33)、十二烷基七聚乙二醇醚(A43)、1,2-二-4-吡啶-1,2-乙二醇(A47)、1-(1H-吡咯-2-基)-乙酮(2-乙酰基吡咯)(A49)呈顯著正相關(P<0.01),這與Virgibacillus正相關的風味化合物相近,而兩種菌的負相關性化合物也極為相似,包括乳酸乙酯(A2)、琥珀酸二乙酯(A5)、苯乙酸乙酯(A9)以及月桂酸乙酯(A25),這些顯著相關的風味化合物與白酒發酵過程中酒醅細菌群落多樣性的演替相對應,即發酵過程中優勢屬由Virgibacillus、Kroppenstedtia逐漸轉變為Lactobacillus。
在關鍵真菌群落中,Thermoascus與十八乙二醇單十二烷基醚(A48)呈正相關,與DL-亮氨酸乙酯(A4)、癸酸乙酯(A22)、棕櫚酸乙酯(A23),苯甲醇(A30)呈負相關(圖6b)。Aspergillus曲霉菌與乳酸乙酯(A2)、(E)-9 十八烯酸乙酯(A14)呈顯著正相關(P<0.01),與苯甲醇(A30)呈負相關(圖6b)。Issatchenkia與DL-亮氨酸乙酯(A4)、4-乙基愈創木酚(A46)呈正相關,與丁酸(A41)呈顯著負相關(P<0.01)。Thermoascus與Issatchenkia相關的部分風味化合物呈現出相反的相關性,這對發酵期間優勢屬Thermeascus相對豐度呈現逐漸增加而Issatchenkia相對豐度逐漸減少的演替過程提供佐證(圖5c)。
在之前的研究中發現,對白酒風味具有貢獻的關鍵酯類物質有48 種[2],傳統觀點中與白酒的風味密切相關的四大乙酯(乙酸乙酯、乳酸乙酯、丁酸乙酯和己酸乙酯)均包含在內,通過對第四輪次發酵酒醅中微生物與風味物質的關聯性分析,發現Monascus、Lactobacillus和Wickerhamomyces分別與乙酸乙酯、乳酸乙酯和己酸乙酯呈顯著正相關(P<0.01)。已有研究顯示紅曲霉通過產酯化酶可提升白酒中乙酸乙酯[43]、己酸乙酯[44]等酯類含量,石馨等[45]已將Wickerhamomyces應用于模擬發酵提升己酸乙酯含量,同樣地可以在白酒發酵過程中利用功能微生物菌屬Monascus、Lactobacillus等改善其余輪次基酒風味,有助于提高白酒的品質。
3 結論
醬香型白酒采用傳統的固態發酵模式,開放式的發酵過程導致環境中多種微生物參與其中,隨著入窖發酵的進行,原料消耗、窖池環境變化使每輪入窖都形成感官有差異的輪次酒,不同輪次酒的微生物結構和風味物質組成存在著明顯不同,其中以大回酒中第四輪次酒風味最佳。本文以北京地區醬香型白酒第四輪次發酵酒醅為研究對象,分析了發酵過程中核心微生物的結構變化和風味物質的差異。第四輪次發酵酒醅中,優勢細菌屬為Lactobacillus、Virgibacillus和Kroppenstedtia,優勢真菌屬為Thermoascus、Issatchenkia和Aspergillus,在整個發酵過程中,優勢菌屬由Virgibacillus、Kroppenstedtia、Issatchenkia交替為Lactobacillus、Thermoascus、Aspergillus。白酒發酵過程中關鍵風味化合物醇類、酯類、酸類的含量隨著入窖發酵時間的增加呈現先上升后下降的規律,并且酯類相對含量較高,這顯著影響醬香型白酒的產品品質。關聯性分析顯示Monascus、Lactobacillus和Wickerhamomyces分別與白酒中關鍵風味物質乙酸乙酯、乳酸乙酯和己酸乙酯呈正相關。本研究有助于尋找醬香型白酒發酵過程中潛在的功能微生物、明晰微生物與風味物質的相關性,為不同輪次醬香型白酒微生物區系波動和風味物質關聯比較分析提供基礎數據,有助于推動提高醬香型白酒品質的研究。

