胡柚皮黃酮對(duì)棕櫚酸誘導(dǎo)的脂肪變性肝細(xì)胞中線粒體膜電位以及自噬相關(guān)蛋白表達(dá)的影響
王 瀟 何蓓暉 姚侃男 陳芝蕓
非酒精性脂肪性肝炎(NASH)是全球最受關(guān)注的公共健康問題之一,近年來在我國發(fā)病率逐年上升,且有年輕化趨勢[1-2]。有部分患者會(huì)逐漸進(jìn)展至肝硬化和肝癌,嚴(yán)重影響人類的健康水平和生活質(zhì)量,并帶來沉重的經(jīng)濟(jì)負(fù)擔(dān)[3-4]。目前除了飲食調(diào)節(jié)、運(yùn)動(dòng)鍛煉和對(duì)癥治療外,尚未發(fā)現(xiàn)有效的治療方法。胡柚皮黃酮(pure total flavonoids from citrus,PTFC)是我們從常山胡柚皮中分離純化的黃酮類化合物,由柚皮苷、新橙皮苷和柚皮蕓香苷等3 種黃酮類化合物為主要成分。前期實(shí)驗(yàn)在NASH 動(dòng)物模型中發(fā)現(xiàn),PTFC能抑制氧化應(yīng)激和脂質(zhì)過氧化反應(yīng),減輕肝臟中炎癥反應(yīng),具有保護(hù)肝細(xì)胞的作用[5-6]。有研究發(fā)現(xiàn),細(xì)胞中沉默信息調(diào)節(jié)因子1(SIRT1)水平影響細(xì)胞自噬活性[7]。進(jìn)一步研究表明,SIRT1 可通過去乙酰化對(duì)自噬相關(guān)蛋白功能發(fā)揮調(diào)控作用,促進(jìn)線粒體自噬形成,在自噬的調(diào)節(jié)中起著關(guān)鍵性作用[8-9]。前期研究發(fā)現(xiàn),PTFC 通過調(diào)控SIRT1 改善NASH 小鼠[6]。因此,本研究采用棕櫚酸(PA)誘導(dǎo)肝細(xì)胞建立細(xì)胞脂肪變性模型,從線粒體自噬途徑探討PTFC 抗肝細(xì)胞損傷的作用機(jī)制。
1 材料與方法
1.1 試劑與儀器 人肝癌細(xì)胞株HepG2 細(xì)胞購自上海生命科學(xué)院細(xì)胞庫;PTFC 由本單位中藥制劑室分離純化;胎牛血清、高糖DMEM 培養(yǎng)基購自Gibco公司(批號(hào)211100703、8121080);0.25%胰酶購自Gibco 公司(批號(hào)2120734);PA 購自GLPBIO 公司(批號(hào)07512);油紅O 染料購自Sigma 公司(批號(hào)07512);BCA 蛋白質(zhì)定量試劑盒購自biosharp 公司(批號(hào)00755S)、線粒體膜電位檢測試劑盒北京索萊寶科技公司(批號(hào)M8650)、活性氧檢測試劑盒購自碧云天公司(批號(hào)S0033S)、總蛋白提取試劑盒購自北京普利萊基因技術(shù)有限公司(批號(hào)P1250);P62、自噬效應(yīng)蛋白(Beclin-1)抗體購自Immunoway 公司(批號(hào)00101435、00096519);微管相關(guān)蛋白質(zhì)1 輕鏈3(LC3)抗體購自proteintech 公司(批號(hào)00076446);倒置顯微鏡、熒光顯微鏡(Olympus 公司);CO2培養(yǎng)箱(Thermo 公司);酶標(biāo)儀(美國BioTek 公司);凝膠成像儀(Bio-Rad 公司)。
1.2 方 法
1.2.1 細(xì)胞培養(yǎng) 細(xì)胞培養(yǎng)于含10%胎牛血清的高糖DMEM 培養(yǎng)基中,在37 ℃、5%CO2的細(xì)胞培養(yǎng)箱中培養(yǎng),當(dāng)細(xì)胞80%~90%融合時(shí),0.25%胰酶消化細(xì)胞,1∶3 傳代,進(jìn)行相關(guān)實(shí)驗(yàn)。
1.2.2 MTT 法檢測細(xì)胞增殖 將對(duì)數(shù)生長期的HepG2 細(xì)胞以1×105/mL 的密度,100 μL/孔接種于96 孔細(xì)胞培養(yǎng)板,培養(yǎng)24 h。去上清,加入含不同濃度(0、0.1、0.2、0.3、0.4、0.5、0.6 mmol/L)PA 的培養(yǎng)液200 μL,空白對(duì)照組只加200 μL 培養(yǎng)液,培養(yǎng)24 h、48 h,培養(yǎng)結(jié)束前4 h 加入20 μL/孔5 mg/mL 的MTT溶液,繼續(xù)培養(yǎng)4 h,去上清液,加入200 μL/孔DMSO,震蕩10 min,選擇490 nm 波長,酶標(biāo)儀檢測吸光值(OD),每組做6 個(gè)復(fù)孔,實(shí)驗(yàn)重復(fù)3 次。
1.2.3 油紅O 染色檢測細(xì)胞脂質(zhì)沉積 將對(duì)數(shù)生長期的HepG2 細(xì)胞接種于6 孔細(xì)胞培養(yǎng)板,37℃、5%CO2培養(yǎng)24 h。去上清,加入含不同濃度(0、0.2、0.3、0.4、0.5 mmol/L)PA 的培養(yǎng)基,空白對(duì)照組只加培養(yǎng)基,繼續(xù)培養(yǎng)24 h。油紅O 染色,顯微鏡下觀察細(xì)胞內(nèi)脂滴形成情況。根據(jù)細(xì)胞增殖實(shí)驗(yàn)和油紅O 染色結(jié)果,確定PA 誘導(dǎo)HepG2 細(xì)胞脂肪變性的濃度。采用該濃度處理細(xì)胞,同時(shí)加入不同濃度的PTFC(0、20、40、80、160 mg/L)處理24 h,油紅O 染色,檢測細(xì)胞脂質(zhì)沉積變化。
1.2.4 熒光探針檢測細(xì)胞內(nèi)活性氧含量 將對(duì)數(shù)生長期的HepG2 細(xì)胞接種于6 孔培養(yǎng)板,37 ℃、5%CO2培養(yǎng)24 h。0.3 mmol/L 的PA 誘導(dǎo)HepG2 細(xì)胞,同時(shí)加入不同濃度的PTFC(0、40、80、160 mg/L)培養(yǎng)24 h。棄上清,加入1 mL PBS,搖床5 min,洗2 次。加入1 mL的DCFH-DA(10 μmol/L),37 ℃孵育30 min。棄上清,1 mL PBS 洗1 次。熒光顯微鏡下采集圖像。
1.2.5 熒光探針檢測線粒體膜電位 取對(duì)數(shù)生長期的HepG2 細(xì)胞接種于6 孔培養(yǎng)板,37 ℃、5%CO2培養(yǎng)24 h。0.3 mmol/L 的PA 誘導(dǎo)HepG2 細(xì)胞,同時(shí)加入不同濃度的PTFC(0、40、80、160 mg/L)培養(yǎng)24 h。棄上清,加入1 mL 現(xiàn)配的10 μg/mL 的JC-1 工作液,37 ℃孵育30 min。棄上清,培養(yǎng)液洗滌2 次。熒光顯微鏡采集圖像。
1.2.6 免疫印跡法檢測PTFC 對(duì)HepG2 細(xì)胞自噬相關(guān)蛋白表達(dá)的影響 取對(duì)數(shù)生長期的HepG2 細(xì)胞接種于細(xì)胞培養(yǎng)瓶,37 ℃、5%CO2培養(yǎng)24 h。0.3 mmol/L的PA 誘導(dǎo)HepG2 細(xì)胞,同時(shí)加入不同濃度的PTFC(0、20、40、80、160 mg/L)處理24 h。PBS 洗滌細(xì)胞,RIPA 液裂解提取總蛋白,BCA 法測定蛋白濃度。SDS-PAGE 電泳,LC3 和Beclin-1、p62 分別采用15%和10%的SDS-PAGE 膠,制備轉(zhuǎn)膜后,1%BSA封閉。一抗1∶1000 稀釋,4 ℃孵育過夜,TBST 洗膜3次,HRP 標(biāo)記的二抗室溫孵育1 h,TBST 洗膜3 次,ECL 顯影。凝膠成像系統(tǒng)采集圖片并分析。
1.2.7 統(tǒng)計(jì)學(xué)方法 應(yīng)用SPSS 22.0 軟件進(jìn)行統(tǒng)計(jì)分析。符合正態(tài)分布計(jì)量資料用均數(shù)±標(biāo)準(zhǔn)差(±s)表示,兩組資料之間比較采用獨(dú)立樣本t 檢驗(yàn),多組間比較采用單因素方差分析,以P<0.05 為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié) 果
2.1 PA 對(duì)HepG2 細(xì)胞增殖的影響 不同濃度PA分別處理HepG2 細(xì)胞24、48 h 后,MTT 法檢測細(xì)胞增殖情況,結(jié)果顯示,低濃度PA 對(duì)細(xì)胞增殖無明顯影響,而當(dāng)PA 濃度高于0.3 mmol/L 后對(duì)細(xì)胞增殖的抑制作用逐漸增強(qiáng),見圖1。

圖1 不同濃度PA 對(duì)HepG2 細(xì)胞增殖的作用
2.2 PA 誘導(dǎo)HepG2 細(xì)胞脂肪變性 油紅O 染色結(jié)果顯示,正常對(duì)照組細(xì)胞內(nèi)少量紅染,PA 處理組均可觀察到紅染,且PA 濃度越高紅染明顯增多,表明細(xì)胞內(nèi)脂滴增多。結(jié)合MTT 結(jié)果,發(fā)現(xiàn)在PA 濃度為0.3 mmol/L 時(shí),細(xì)胞增殖不會(huì)受到明顯抑制,同時(shí)細(xì)胞出現(xiàn)明顯的脂質(zhì)沉積,故實(shí)驗(yàn)選定該濃度作為誘導(dǎo)細(xì)胞脂肪變性劑量,見圖2。
2.3 PTFC 對(duì)肝細(xì)胞脂肪變性的影響 用不同濃度PTFC 分別作用于經(jīng)0.3 mmol/L 誘導(dǎo)的HepG2 細(xì)胞24 h 后,油紅O 染色發(fā)現(xiàn)細(xì)胞內(nèi)脂質(zhì)含量減少,且呈劑量依賴性(P<0.01),見圖3 和表1。
2.4 PTFC 對(duì)HepG2 細(xì)胞內(nèi)活性含量的影響 實(shí)驗(yàn)顯示,經(jīng)PA 處理后,細(xì)胞中綠色熒光顯著增強(qiáng)(P<0.01);而用不同濃度PTFC 干預(yù)后綠色熒光強(qiáng)度降低,且隨PTFC 濃度增高熒光強(qiáng)度降低越明顯(P<0.01),見圖4 和表2。
2.5 PTFC 對(duì)HepG2 細(xì)胞線粒體膜電位的影響 實(shí)驗(yàn)顯示,經(jīng)PA 處理后,細(xì)胞中紅色熒光強(qiáng)度減弱,綠色熒光顯著增強(qiáng),導(dǎo)致線粒體膜電位下降。而不同濃度PTFC 干預(yù)后綠色熒光強(qiáng)度降低,而紅色熒光強(qiáng)度逐漸增強(qiáng),表明PTFC 會(huì)使細(xì)胞線粒體膜電位恢復(fù)。見圖5。
2.6 PTFC 對(duì)HepG2 細(xì)胞自噬的影響 Western blot 結(jié)果顯示,經(jīng)PA 處理后,Beclin-1 和LC3 蛋白表達(dá)明顯下調(diào),P62 蛋白表達(dá)上調(diào);而PTFC 干預(yù)后,Beclin-1 和LC3 蛋白表達(dá)明顯上調(diào),而P62 蛋白表達(dá)下調(diào),且隨PTFC 濃度增加作用相應(yīng)增強(qiáng)。見圖6。
3 討 論
非酒精性脂肪性肝病(NAFLD)是脂質(zhì)代謝紊亂性疾病在肝臟中的一種臨床表現(xiàn),其主要病理特征為肝細(xì)胞脂肪變性和氧化應(yīng)激損傷后所致的炎癥反應(yīng),而NASH 是肝組織從單純性脂肪變性發(fā)展至肝硬化,甚至肝細(xì)胞癌的中間限速階段[1]。目前,針對(duì)NASH 尚無明確有效的治療方法。
近年來許多研究發(fā)現(xiàn),線粒體功能紊亂在NASH的發(fā)生發(fā)展過程中有著重要的作用[10]。在肝臟中,線粒體不但參與脂質(zhì)代謝,也是氧化應(yīng)激發(fā)生的主要場所。線粒體功能障礙會(huì)引起肝細(xì)胞脂肪氧化代謝出現(xiàn)異常,導(dǎo)致細(xì)胞中活性氧簇產(chǎn)生增多,從而使肝臟脂肪變性和炎癥反應(yīng),造成肝細(xì)胞功能損傷和病理改變。

圖2 油紅O 染色檢測HepG2 細(xì)胞中脂質(zhì)沉積(×200)

圖3 HepG2 細(xì)胞脂肪變性情況(×200)
表1 HepG2 細(xì)胞脂肪變性檢測(±s)

表1 HepG2 細(xì)胞脂肪變性檢測(±s)
注:PA 為棕櫚酸;PTFC 為胡柚皮黃酮;與對(duì)照組比較,aP<0.01;與PA組比較,bP<0.01
組別對(duì)照組PA(0.3 mmol/L)組PA+PTFC(20 mg/L)組PA+PTFC(40 mg/L)組PA+PTFC(80 mg/L)組PA+PTFC(160 mg/L)組孔數(shù)333333脂滴相對(duì)含量1.00±0.13 39.13±3.15a 30.17±4.41b 16.35±4.00b 6.26±1.69b 2.76±2.05b
表2 HepG2 細(xì)胞內(nèi)活性氧含量檢測(±s)

表2 HepG2 細(xì)胞內(nèi)活性氧含量檢測(±s)
注:PA 為棕櫚酸;PTFC 為胡柚皮黃酮;ROS 為活性氧;與對(duì)照組比較,aP<0.01;與PA 組比較,bP<0.01
組別對(duì)照組PA(0.3 mmol/L)組PA+PTFC(20 mg/L)組PA+PTFC(40 mg/L)組PA+PTFC(80 mg/L)組PA+PTFC(160 mg/L)組孔數(shù)333333活性氧相對(duì)熒光強(qiáng)度1.00±0.25 18.56±1.48a 16.21±2.52 9.13±1.12b 7.00±0.45b 5.03±1.00b

圖4 HepG2 細(xì)胞內(nèi)活性氧水平檢測
自噬是維持細(xì)胞穩(wěn)態(tài)的重要生理功能,也是細(xì)胞用來清除存在功能障礙線粒體的主要途徑[11]。自噬通過清除受損的線粒體并降解細(xì)胞內(nèi)累積的脂質(zhì),在NASH 脂質(zhì)代謝紊亂進(jìn)程中發(fā)揮重要作用。研究表明,NAFLD 患者肝細(xì)胞內(nèi)線粒體自噬活性下降,肝臟損傷程度與其自噬受損程度密切相關(guān)[12-14]。進(jìn)一步研究顯示,在高脂飲食誘導(dǎo)的小鼠NAFLD 模型和PA 處理的細(xì)胞模型中,均觀察到肝細(xì)胞線粒體自噬功能障礙;使用自噬激活劑后,肝細(xì)胞脂質(zhì)沉積、氧化應(yīng)激反應(yīng)和炎癥反應(yīng)明顯減輕[15-17]。

圖5 HepG2 細(xì)胞線粒體膜電位檢測
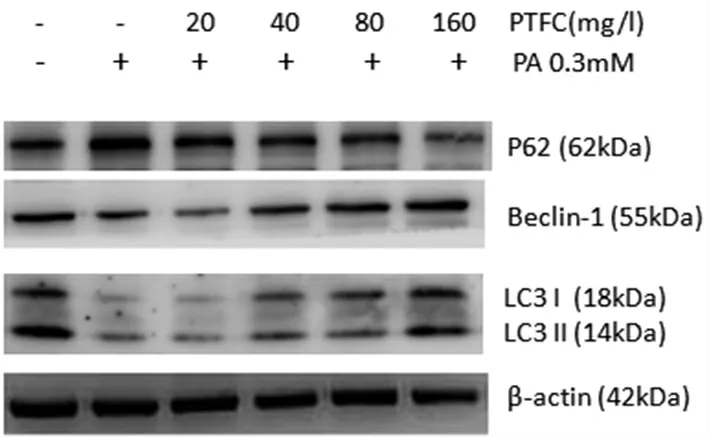
圖6 HepG2 細(xì)胞中P62、Beclin-1 和LC3 蛋白表達(dá)
本研究采用PA 誘導(dǎo)HepG2 細(xì)胞建立了肝細(xì)胞脂肪變性細(xì)胞模型。我們發(fā)現(xiàn)PTFC 能有效減少肝細(xì)胞內(nèi)脂滴沉積,改善肝細(xì)胞脂肪變性;同時(shí)減低了細(xì)胞內(nèi)活性氧含量。進(jìn)一步研究顯示,PTFC 能夠逆轉(zhuǎn)線粒體膜電位變化,表明PTFC 改善了線粒體功能障礙。同時(shí)我們還發(fā)現(xiàn),PA 處理后HepG2 細(xì)胞中與自噬活性相關(guān)的正調(diào)控蛋白Beclin-1 和LC3 表達(dá)水平下降,相應(yīng)的負(fù)調(diào)控因子P62 表達(dá)升高。而PTFC 能夠部分恢復(fù)上述蛋白表達(dá)水平。編碼Beclin-1 蛋白的基因是酵母自噬相關(guān)基因ATG6 的同系物,是參與哺乳動(dòng)物自噬的特異性基因,可調(diào)控與自噬相關(guān)的信號(hào)通路。Beclin-1 和ATG14 或UVRAG 結(jié)合形成自噬復(fù)合物,啟動(dòng)自噬小體的形成,所以被稱為自噬的分子開關(guān)蛋白,具有調(diào)控自噬起始并募集自噬底物至自噬小體的作用[18-19]。LC3 為自噬正調(diào)控蛋白,參與自噬體的形成,細(xì)胞中LC3 的水平與自噬泡數(shù)量呈正相關(guān)[20-21]。p62 又稱SQSTM1,在自噬溶酶體降解過程中具有關(guān)鍵作用,是調(diào)節(jié)自噬的負(fù)相關(guān)因子[19]。自噬小體形成過程中,p62 可連接LC3 和泛素化的底物結(jié)合,一起整合至自噬體中,并在自噬溶酶體中被降解,因此,隨著自噬活性增高,p62 蛋白水平下降[22]。本研究結(jié)果表明,PTFC 可能參與了自噬的調(diào)控。
以上研究結(jié)果提示,PTFC 能明顯改善肝細(xì)胞脂肪變性,調(diào)控線粒體自噬可能是PTFC 改善肝細(xì)胞脂肪變性的主要作用機(jī)制之一。因此,我們推測PTFC可能通過調(diào)控線粒體自噬,保護(hù)線粒體功能,減少活性氧,抗肝細(xì)胞脂肪變性,從而達(dá)到改善NASH 的治療效果。

