手持技術探究酸堿滴定過程中緩沖容量的變化
鄭海鵬,鐘鳴,陳鮮麗,鄭蘭
手持技術探究酸堿滴定過程中緩沖容量的變化
鄭海鵬1,鐘鳴2,陳鮮麗1,鄭蘭1
(韶關學院 1. 化學與土木工程學院,2. 醫學院,廣東 韶關 512005)
針對韶關學院基礎化學課程中酸堿滴定的學習內容,以酸堿滴定為基礎,繪制滴定過程中溶液緩沖容量的變化圖,并結合型體分布分數的知識聯合討論酸堿滴定過程中溶液緩沖容量變化,擴充了酸堿滴定和緩沖容量的知識,可以加深臨床醫學本科專業學生對酸堿滴定的理解.使用手持技術實驗設備中的pH傳感器和滴數傳感器設計了酸堿滴定實驗,使用NaOH溶液分別滴定HAc,H2C2O4,H3PO4溶液,繪制相應的pH-曲線和-pH曲線,基礎借助-pH曲線解釋緩沖容量變化,并聯合分析其滴定過程中緩沖容量的變化,有利于加深學生對酸堿滴定和緩沖溶液的理解.
手持技術;pH傳感器;滴數傳感器;滴定曲線;分布型體;緩沖容量
基礎化學是為臨床醫學本科專業大一學生開設的一門專業基礎課程,內容包括無機化學基礎知識和分析化學基礎知識及其相關實驗,難度和學習要求相對比較低.該課程的學習任務是使學生獲得化學基礎理論、基本知識和實驗操作的基本技能,提高他們觀察、分析、解決問題的能力,為學習醫學基礎課程和專業課程奠定基礎.其中,緩沖溶液不僅包括了對強弱電解質、酸堿質子理論等前置知識的進一步理解,還包括了人體酸堿平衡對生命活動的意義;滴定分析中酸堿滴定法的內容包括了對強弱電解質、酸堿質子理論和緩沖溶液等前置知識的進一步理解,以及滴定分析對醫藥分析的意義,兩部分內容均體現了化學與醫學的緊密聯系,且有密不可分的聯系.
以韶關學院的《基礎化學》教材為例,其中提及了酸堿滴定法是以質子轉移反應為定量基礎的滴定分析法[1].對于NaOH滴定HAc的pH-曲線的解釋提及了“隨著滴定的進行,NaAc和HAc形成緩沖溶液,對滴入的NaOH具有一定的緩沖作用,因而出現了較平坦的曲線部分”.因此,在滴定過程中形成了緩沖溶液,通過繪制pH-曲線可以反映出緩沖溶液的緩沖容量大小,進一步得到緩沖容量與pH的關系曲線.相關文獻描述通過公式繪制緩沖容量曲線[2-3],以及通過滴定的方式測定緩沖容量[4].在文獻[4]中,通過在不同的緩沖溶液中分別逐滴加入NaOH或HCl溶液,并使用電位滴定儀測定pH,并繪制成緩沖容量-pH圖,結果比較直觀,但數據點較少,難以完全展示完整的緩沖溶液曲線,所以該實驗的思路和內容能進一步豐富和優化.因此,本文結合pH傳感器和滴數傳感器,設計了手持技術為基礎的酸堿滴定實驗,并以此繪制緩沖容量曲線,能夠很好地觀察到緩沖容量隨pH的變化而變化,以及通過型體分布曲線討論其變化原因.通過酸堿滴定的方式探究緩沖溶液緩沖容量的性質,有助于加深學生對酸堿滴定規律和緩沖溶液的理解.與大型儀器的實驗和傳統實驗相比,手持技術數字化實驗能夠通過傳感器、數據采集器和配套軟件,大量、快捷、可視和精確地采集各種物理量數據,更好地認識物質在化學反應中變化的事實[5].
1 實驗原理
在酸堿滴定中,以所得混合溶液的pH為縱坐標,以滴定過程中加入的酸或堿溶液的量為橫坐標,所繪制的曲線為酸堿滴定曲線,一般為pH-或pH-(滴定分數)圖.以0.1 mol·L-1NaOH滴定0.1 mol·L-1HAc為例,在滴定過程中發生反應(1),以混合液的pH為縱坐標,加入NaOH的體積為橫坐標,即得0.1 mol·L-1NaOH滴定0.1 mol·L-1HAc的pH-圖.在滴定過程中不足量的NaOH與HAc反應生成少量的NaAc,與溶液中大量存在的HAc形成緩沖溶液,緩沖對為HAc-NaAc,隨著滴定的繼續,緩沖比[Ac-]/[HAc]也在發生改變,直至HAc全部生成NaAc,失去緩沖能力.
NaOH+HAc=NaAc+H2O (1)
滴定過程中會形成HAc-NaAc緩沖溶液,可根據滴入NaOH的濃度和體積以及緩沖溶液的pH計算出緩沖溶液的緩沖能力,即緩沖容量(mol·L-1·pH-1),公式為

式中:為外加的NaOH溶液的物質的量;為緩沖溶液的體積;ΔpH為緩沖溶液pH的變化量.當總濃度一定時,緩沖比越接近1,緩沖容量就越大,緩沖比等于1時,緩沖容量最大[6].以緩沖容量為縱坐標,pH為橫坐標可以繪制出緩沖容量-pH圖.
在滴定過程中,HAc和NaAc的濃度也在發生變化,在某一刻平衡時,某酸(或堿)的型體占酸(或堿)總濃度的分數稱為型體分布分數,一般使用δ表示[7].以δ為縱坐標,pH為橫坐標,即可得到-pH圖.在0.1 mol·L-1NaOH滴定0.1 mol·L-1HAc中,根據型體分布分數(3)(4),可以繪制出-pH圖.借助-pH圖可以很好地解釋-pH和pH-的變化.
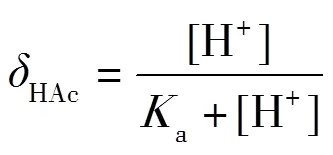

同理,0.1 mol·L-1NaOH滴定0.1 mol·L-1H2C2O4,由于H2C2O4為二元中強酸,會發生兩步質子轉移反應(5)(6),繪制pH-圖.
NaOH+H2C2O4=NaHC2O4+H2O (5)
NaOH+NaHC2O4=Na2C2O4+H2O (6)
理論上,在滴定過程中,會依次形成H2C2O4-NaHC2O4和NaHC2O4-Na2C2O4兩緩沖溶液,依據式(2)計算出緩沖容量,并繪制-pH圖.根據草酸的型體分布分數公式(7)~(9)繪制其-pH圖,并解釋-pH和pH-的變化.
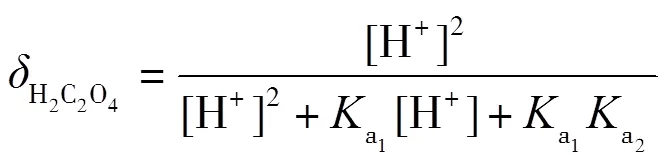
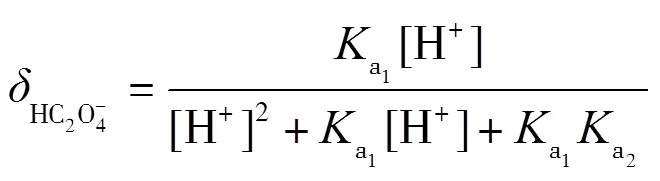
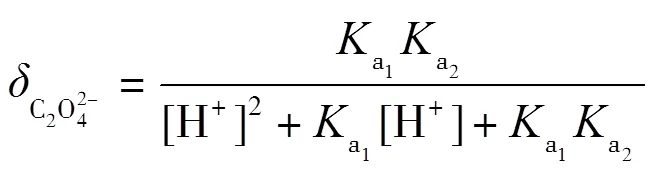
以三元酸的滴定為例,使用0.1 mol·L-1NaOH滴定0.1 mol·L-1H3PO4,滴定中發生三步質子轉移反應(10)~(12),繪制pH-圖.
NaOH+H3PO4=NaH2PO4+H2O (10)
NaOH+NaH2PO4=Na2HPO4+H2O (11)
NaOH+Na2HPO4=Na3PO4+H2O (12)
理論上,在滴定過程中,依次形成H3PO4-NaH2PO4,NaH2PO4-Na2HPO4,Na2HPO4-Na3PO4三種緩沖溶液,依據式(2)計算出緩沖容量,并繪制-pH圖.根據磷酸的型體分布分數公式(13)~(16)繪制其-pH圖,并解釋-pH和pH-的變化.
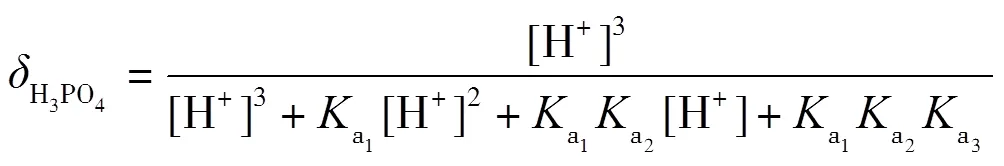
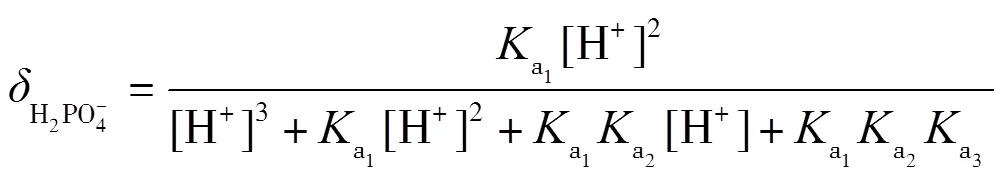
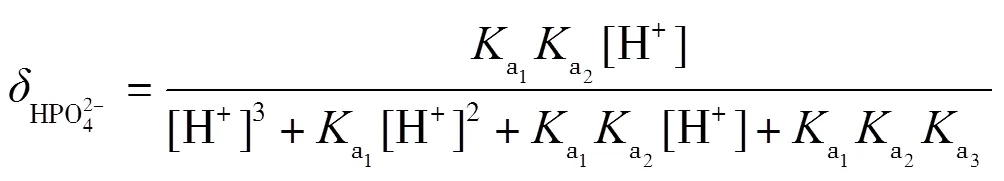

在滴定過程中,每一滴NaOH與被滴定的溶液反應后,形成緩沖溶液,對下一滴NaOH的滴入起到緩沖作用,滴入后,緩沖溶液的緩沖比發生了改變,緩沖容量也發生了改變.滴定中每一滴NaOH改變了緩沖比,下一滴NaOH的滴入引起的pH變化又能體現緩沖容量,循環往復,緩沖比從0到1,再到無限大,可以直觀地看出緩沖容量的變化.通常,當緩沖比為1時,即組成緩沖對的共軛酸與共軛堿濃度最大,兩者型體分布分數均為0.5,此時緩沖容量最大.即在滴定曲線pH-(或pH-)中,NaOH滴入分數約0.5時,所對應的pH變化最平緩.當滴入分數很小或很大時,共軛酸堿對型體分布分數偏離0.5,緩沖比偏離1,緩沖容量減小,滴定曲線pH變化較大.當反應完全到達質子轉移反應終點時,弱酸已完全反應轉化為共軛堿,到達滴定終點,共軛堿型體分布分數接近1,緩沖比偏離1的程度最大,緩沖作用最小,pH變化最大,滴定曲線出現突躍.
2 實驗方法
2.1 儀器與試劑
Vernier數據采集器,Vernier磁力攪拌器,Vernier滴數傳感器,VernierpH傳感器(上海江鳳光學儀器有限公司).
NaOH,HAc,H2C2O4,H3PO4(天津市大茂化學試劑廠),以上試劑濃度均為0.1 mol·L-1.
2.2 實驗步驟
2.2.1 組裝實驗儀器 將數據采集器、磁力攪拌器、滴數傳感器、pH傳感器和計算機連接好(見圖1),校正儀器,設置數據收集頻率為2個/s,測試,待用.

圖1 實驗裝置
2.2.2 滴定過程 0.1 mol·L-1NaOH滴定0.1 mol·L-1HAc的實驗操作過程為:在80 mL小燒杯中加入配制好的20 mL 0.1 mol·L-1HAc,加入攪拌子,然后在滴定管中加入0.1 mol·L-1NaOH,開啟磁力攪拌器和數據記錄,打開滴定管開關,使用pH傳感器和滴數傳感器同時記錄連續滴定過程中混合溶液pH隨NaOH加入的動態變化,繪制pH-曲線,在此基礎上繪制-pH曲線,并借助-pH曲線討論和解釋-pH和pH-的變化.滴定操作平行三次,取最佳曲線作為后續最終實驗結果.0.1 mol·L-1NaOH滴定0.1 mol·L-1H2C2O4和0.1 mol·L-1H3PO4的實驗操作過程同理.
3 實驗結果與討論
3.1 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 HAc
根據滴定數據,以pH為縱坐標,加入NaOH的體積為橫坐標,繪制pH-圖(見圖2).由圖2可見,pH起點為2.49,HAc為弱酸,少量解離.滴定開始時,pH起伏較大,滴定開始生成少量的NaAc對HAc產生同離子作用,抑制HAc的解離,NaOH的滴加使溶液中的[H3O+]迅速減少,pH升高.隨著滴定的進行,NaAc和HAc形成緩沖溶液,曲線出現了較為平坦的部分.繼續滴定,[HAc]逐漸減少,緩沖能力減弱,曲線起伏又開始變大,直至HAc與NaOH完全反應,引起pH的較大變化,在滴入約20 mL NaOH時出現滴定突躍,此時滴定產物為NaAc,計量點pH=8.60.需要說明的是,由于外界氣溫和儀器誤差等不可控因素,導致實際實驗結果的pH并非與理論計算pH一致.
為方便對照分析,將圖2的縱坐標與橫坐標對調,得到圖3.使用式(2)計算出緩沖容量,并繪制-pH圖(見圖4),根據型體分布分數公式(3)(4)繪制出HAc型體分布-pH圖(見圖5).滴定前,溶液溶質為HAc,由圖5可知,(Ac-)接近0,(HAc)接近1.滴定開始后,消耗HAc,生成NaAc,(Ac-)逐漸增大,(HAc)逐漸減小,開始時緩沖比[Ac-]/[HAc]小于1,并逐漸增加,因此緩沖容量較小,但處于爬升中.從圖4可以發現,在滴定過程中所生成的HAc-NaAc緩沖溶液在pH=4.60附近時,緩沖容量最大,恰好對應圖2與圖3中pH變化較為平緩的階段.對應圖5的pH=4.60處,HAc與Ac-的型體分布分數接近0.5,即HAc與Ac-的濃度相當,緩沖比[Ac-]/[HAc]約等于1,緩沖容量最大,pH變化最平緩.同時,HAc的pa為4.76,接近4.60,當緩沖溶液pH盡可能接近pa時,緩沖溶液的緩沖能力最強[8].繼續滴定,pH變化幅度又一次增大,兩者型體分布分數均不等于0.5,(Ac-)繼續增大,(HAc)繼續減小,緩沖比[Ac-]/[HAc]逐漸大于1,因此緩沖容量減少.在到達計量點pH=8.60時,出現突躍,溶液溶質為NaAc,此時型體分布以Ac-為主,(Ac-)≈1,(HAc)≈0,緩沖比[Ac-]/[HAc]大于1,且偏離1的程度最大,失去緩沖能力.繼續加入過量的NaOH,緩沖容量增大,此時溶液為NaOH和NaAc的混合溶液,pH由加入的NaOH濃度所決定,因此pH出現平臺,使得“緩沖容量”增大.

圖2 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 HAc的pH-V圖

圖3 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 HAc的V-pH圖

圖4 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 HAc的β-pH圖

圖5 HAc型體分布分數δ-pH圖
3.2 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H2C2O4

同理,為了方便對照分析,將圖6的縱坐標與橫坐標對調,得到-pH圖(見圖7),再通過式(2)得到-pH圖(見圖8),最后通過公式(7)~(9)得到型體分布分數-pH圖(見圖9).滴定開始時,由于H2C2O4為中強酸,pH約為1.46,能電離出H+,生成HC2O4-.由圖9可知,此時溶質為H2C2O4和HC2O4-,(H2C2O4)≈0.4,(HC2O4-)≈0.6,緩沖比[HC2O4-]/[H2C2O4]接近1,pH=1.46,接近pa1=1.25,由圖7可以看出,pH變化幅度小,對應圖8緩沖容量較大,具有較強的緩沖能力.在H2C2O4溶液中,[H3O+]本來就很高,會抑制水的電離,外加的少量強堿不會使溶液中的[H3O+]發生明顯變化,且溶液中由于增加了強電解質NaHC2O4而具有較大離子強度,亦可抑制H3O+的活動能力,所以在滴定開始時具有很高的緩沖容量.隨著滴定進行,消耗H2C2O4,生成NaHC2O4,(H2C2O4)減小,(HC2O4-)增加,緩沖比(HC2O4-)/[H2C2O4]逐漸增大并偏離1,緩沖容量減小.滴定直至出現一個不明顯的小突躍,此時對應的pH=2.65,H2C2O4尚未完全轉化為NaHC2O4,生成的NaHC2O4又立即與NaOH作用生成Na2C2O4,溶質主要為NaHC2O4,還有少量H2C2O4和Na2C2O4.對應圖9,(HC2O4-)≈0.93,(H2C2O4)≈0.02,(C2O42-)=0.02,“第一終點”時的緩沖比達到最大值,緩沖容量最小,但仍存在少量的H2C2O4和Na2C2O4,依舊能與大量的NaHC2O4共存,形成H2C2O4-NaHC2O4和NaHC2O4-Na2C2O4兩組緩沖對,共同發揮緩沖作用.因此,雖然緩沖容量很小,但沒有完全失去緩沖作用.

圖6 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H2C2O4V-pH圖
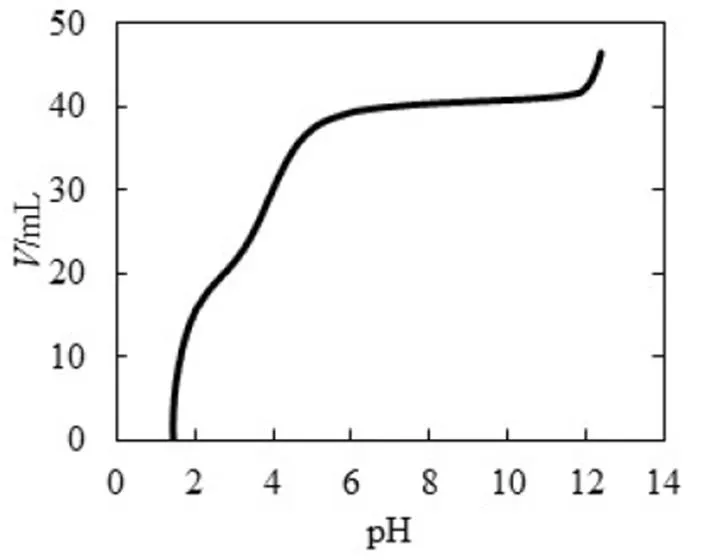
圖7 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H2C2O4 pH-V圖

圖8 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H2C2O4β-pH圖
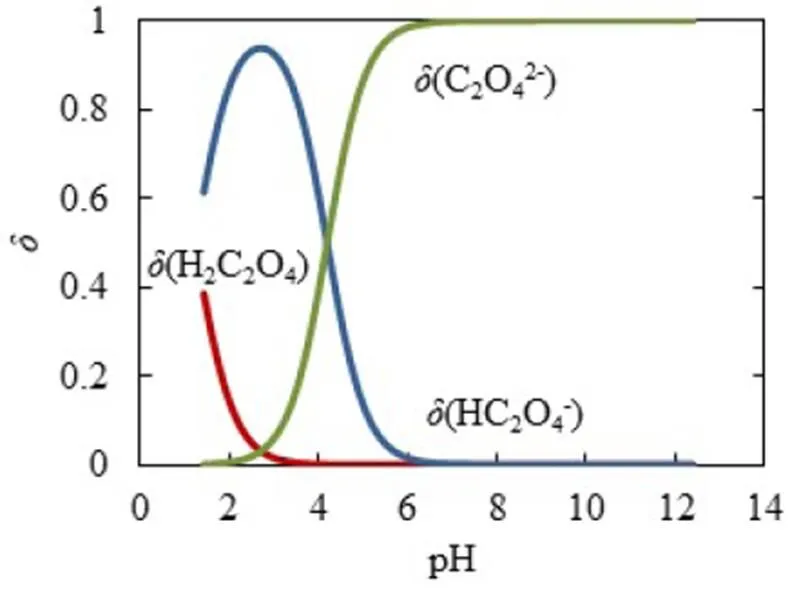
圖9 H2C2O4型體分布分數δ-pH圖
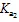
3.3 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H3PO4

同理,為了方便對照分析,將圖10的縱坐標與橫坐標對調,得到-pH圖(見圖11),再通過式(2)得到-pH圖(見圖12),最后通過公式(13)~(16)得到型體分布分數-pH圖(見圖13).滴定開始時,由于H3PO4是中強酸,會電離出H+,生成H2PO4-,pH約為1.37,由圖13可以看出,(H3PO4)≈0.85,(H2PO4-)≈0.15,組成緩沖溶液,開始滴定,圖11的pH變化比較平緩,圖12的緩沖容量較大.在H3PO4溶液中,[H3O+]本來就很高,會抑制水的電離,外加的少量強堿不會使溶液中的[H3O+]發生明顯變化,且溶液中增加了強電解質NaH2PO4而具有較大離子強度,亦可抑制H3O+的活動能力,所以在滴定開始時具有很高的緩沖容量.隨著滴定的進行,(H3PO4)減小,(H2PO4-)增大,緩沖比[H2PO4-]/[H3PO4]先接近1,再偏離1,并增大,緩沖容量減小,直至H3PO4完全反應生成NaH2PO4,出現第一突躍,pH=4.35,滴定產物為NaH2PO4,(H3PO4)≈0,(H2PO4-)≈1,失去緩沖能力,緩沖容量最小.

圖10 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H3PO4 pH-V圖

圖11 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H3PO4V-pH圖

圖12 0.1 mol·L-1 NaOH滴定0.1 mol·L-1 H3PO4β-pH圖

圖13 H3PO4型體分布分數δ-pH圖


4 結語
手持技術數字化實驗設備中的pH傳感器和滴數傳感器用于NaOH滴定HAc,H2C2O4,H3PO4,獲得大量實驗數據,整理并繪制出pH-圖、-pH圖和-pH圖,實驗操作簡便,藥品取用和配制方便.學生可以從-pH曲線了解緩沖容量隨著pH變化的動態變化規律以及通過-pH曲線解釋其變化原因.這樣的呈現結果更為豐富、清晰、直觀,能夠很好地補充和豐富教材知識,將緩沖溶液和酸堿滴定這兩部分知識結合在一起,保證知識的完整性,有助于學生理解緩沖溶液的組成,掌握緩沖比對緩沖能力的影響,形象地理解酸堿滴定過程中各階段曲線變化的原因.
手持技術無論是在實踐層面還是理論層面,都有不少的研究成果[9],在華南師范大學錢揚義教授的推動下,手持技術數字化實驗在中學化學領域中已經取得相當顯著的成效[10].大學化學的知識很大部分是基于中學化學的學習之上,同樣手持技術也可以在大學化學實驗中得到很好的應用,這能讓學生了解這一類先進、便捷的實驗技術,開拓學生的思維,激發學生對化學學習的興趣,培養學生對化學學科研究的熱情,并在化學、物理、生物、醫學、技術等學科領域加深學生對概念的理解[11].
[1] 李雪華,陳朝軍.基礎化學[M].9版.北京:人民衛生出版社,2019:226-233.
[2] 方皓文,開小明.混合弱酸溶液緩沖容量計算[J].安慶師范大學學報(自然科學版),2017,23(1):75-77.
[3] 雷玉富,開小明.緩沖容量精確計算[J].廣州化工,2016,44(1):131-132.
[4] 陳鮮麗,鄭鋒華.共軛酸堿對緩沖能力大小影響因素實驗初探[J].大學化學,2012,27(3):80-83.
[5] 陳德成,錢揚義,黃倩瑩,等.利用手持技術與T形玻璃管探究鈉與空氣中的氧氣反應[J].化學教育(中英文),2022,43(9):76-85.
[6] 陳常興,秦子平.醫用化學[M].8版.北京:人民衛生出版社,2019:18.
[7] 任健敏,韋壽蓮,劉夢琴,等.分析化學[M].北京:化學工業出版社,2014:56-59.
[8] 王同為.組成確定緩沖溶液中緩沖能力最強的分析[J].大學化學,2021,36(6):213-215.
[9] 俞真蓉,田濤,李峰偉.“手持技術”與化學教學整合的文獻統計分析[J].化學教育(中英文),2017,38(9):74-81.
[10] 麥裕華,錢揚義.“中學化學手持技術數字化實驗案例”的多維分析:以錢揚義工作室20年研究的期刊論文為例[J].化學教育(中英文),2020,41(19):83-89.
[11] 馬善恒,王后雄,劉正宇.中學化學手持技術數字化實驗研究的演進及展望[J].化學教育(中英文),2020,41(17):112.
Exploring the changes of buffering capacity during acid-base titration by using handheld technique
ZHENG Haipeng1,ZHONG Ming2,CHEN Xianli1,ZHENG Lan1
(1. School of Chemistry and Civil Engineering,2. Medical College,Shaoguan University,Shaoguan 512005,China)
Aiming at the learning content of acid-base titration in the basic chemistry course of Shaoguan University,based on the acid-base titration,the change diagram of the buffer capacity of the solution during the titration process was drawn,and the change of the buffer capacity of the solution during the acid-base titration process was discussed in combination with the knowledge of the distribution fraction.The knowledge of acid-base titration and buffer capacity can deepen the understanding of acid-base titration by undergraduates majoring in clinical medicine.The acid-base titration experiment was designed by using the pH sensor and the drop sensor in the handheld technology experimental equipment.The HAc,H2C2O4and H3PO4solutions were titrated by NaOH solution,and the corresponding pH-curve and-pH curve were drawn.The-pH curve was used to explain the change of buffer capacity,and the change of buffer capacity in the titration process was analyzed,which was helpful to deepen the students′ understanding of acid-base titration and buffer solution.
handheld technology;pH sensor;drop sensor;titration curve;distribution fraction;buffer capacity
O65∶G642.0
A
10.3969/j.issn.1007-9831.2024.01.018
1007-9831(2024)01-0097-08
2023-09-08
韶關學院第二十四批(2023年度)校級教育教學改革研究項目(SYJY20231030)
鄭海鵬(1994-),男,廣東韶關人,助教,碩士,從事化學教學研究.E-mail:pengge5820@qq.com
鐘鳴(1985-),男,廣東韶關人,講師,碩士,從事抗流感病毒藥物合成和生物學研究.E-mail:13580104368@163.com

