剪接因子3B亞單位1在乳腺癌組織中的表達及與患者臨床病理特征關系
陳麗麗,施民新,薛麗娟
(南通市腫瘤醫院 南通大學附屬腫瘤醫院,江蘇 南通 226000)
乳腺癌作為女性中最普遍的惡性腫瘤類型,其患病率持續占據高位并呈現上升的趨勢[1]。由于乳腺癌的發生與分子層面的調控異常密切相關,導致患者展現出多樣化的臨床病理特征,因此,深入解析乳腺癌的分子病理機制及其與臨床表型之間的聯系,已成為醫學研究的關鍵課題[2-3]。在細胞生物學中,剪接體是由與蛋白質相互作用的小RNA構成的復合體,負責精確移除真核生物前體mRNA的內含子[4]。若RNA剪接過程發生異常,可能觸發多種病理狀態。隨著基因組測序技術的進步,對癌癥患者基因組的深入分析揭示了RNA剪接異常與多種腫瘤的發生、發展之間的潛在聯系[5]。作為U2小分子核糖核蛋白復合體的關鍵組成部分,剪接因子3B(Splicing factor 3B,SF3B)在U2小分子核糖核蛋白的組裝及分支點序列的穩定結合上發揮著至關重要的作用[6]。特別是剪接因子3B亞單位1(Splicing factor 3B subunit 1,SF3B1)其在剪接體與前體mRNA的錨定過程中起著核心作用,研究發現其是變異頻率極高的基因之一,已報道的變異頻率介于66.7%~79%之間[7]。本研究旨在深入探究SF3B1在乳腺癌患者腫瘤組織中的表達趨勢,并探討其表達與乳腺癌患者臨床病理特征之間的潛在聯系。
1 資料與方法
1.1 一般資料 本研究納入了在2020年11月至2022年11月期間于本院進行手術治療的88例乳腺癌病例作為研究樣本。病例納入標準:①初發、原發的乳腺癌患者,并且經過病理學檢查結果確診為乳腺浸潤導管癌;②有手術指征,初次接受乳腺手術者;③術前未接受其他治療如放療、化療、激素療法及生物治療等。排除標準:①有其他重大合并癥;②病例數據資料缺失者。88例患者均為女性,年齡31~73歲,平均(53.17±4.05)歲;分化程度為高分化67例,中分化15例,低分化6例;淋巴結轉移14例;未絕經45例,已絕經43例。
1.2 研究方法 將手術采集到的組織樣本立即于-80 ℃冷凍保存,采用RIPA緩沖液對組織樣本進行勻漿處理,提取總蛋白后,采用BCA蛋白測定法測定蛋白濃度。根據蛋白濃度,加載等量蛋白至SDS-PAGE凝膠中,使用恒電流模式進行電泳分離。將分離后的蛋白轉移至PVDF膜上,使用冷TBS-T緩沖液進行濕式轉膜。轉膜完成后,在5%脫脂牛奶中封閉1 h。采用SF3B1特異性一抗(1∶1000稀釋)于4 ℃孵育過夜。洗滌后,采用與一抗相對應的HRP標記的二抗孵育1 h,使用β-actin作為內參抗體,采用ECL化學發光底物顯影。最后,使用Image J圖像處理軟件對SF3B1蛋白及內參蛋白的條帶進行灰度分析,通過計算目標蛋白的灰度值與內參蛋白灰度值的比值來確定SF3B1蛋白的相對表達量。
1.3 觀察指標 分析SF3B1在乳腺癌組織和癌旁組織中的表達,比較不同SF3B1表達情況患者臨床病理因素:年齡、腫瘤大小、組織學分級、腫瘤部位、病理學分級、雌激素受體(ER)、孕激素受體(PR)、淋巴結轉移、分化程度的差異。
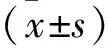
2 結 果
2.1 乳腺癌組織和癌旁組織SF3B1表達比較 乳腺癌組織SF3B1表達明顯高于癌旁組織(P<0.05),見表1。

表1 乳腺癌組織和癌旁組織SF3B1表達比較
2.2 SF3B1表達對乳腺癌的診斷價值 ROC曲線分析結果顯示,SF3B1診斷乳腺癌的AUC為0.713,最佳截斷值為110.72,約登指數為0.314,敏感度為75.00%,特異度為56.43%,95%CI:0.656~0.765(P<0.001)(圖1)。
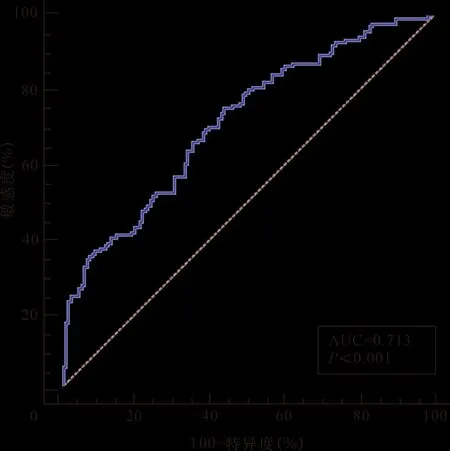
圖1 SF3B1表達診斷乳腺癌的ROC曲線
2.3 SF3B1表達與患者臨床病理特征的關系 根據ROC分析得出SF3B1診斷乳腺癌的最佳截斷值為110.72,以此為標準將≥110.72的納入高表達組,<110.72的納入低表達組,高表達組49例,低表達組39例。高表達組年齡明顯高于低表達組,病理學分級顯著高于低表達組,淋巴結轉移為N0的比例明顯低于低表達組,差異均有統計學意義(均P<0.05)。見表2。
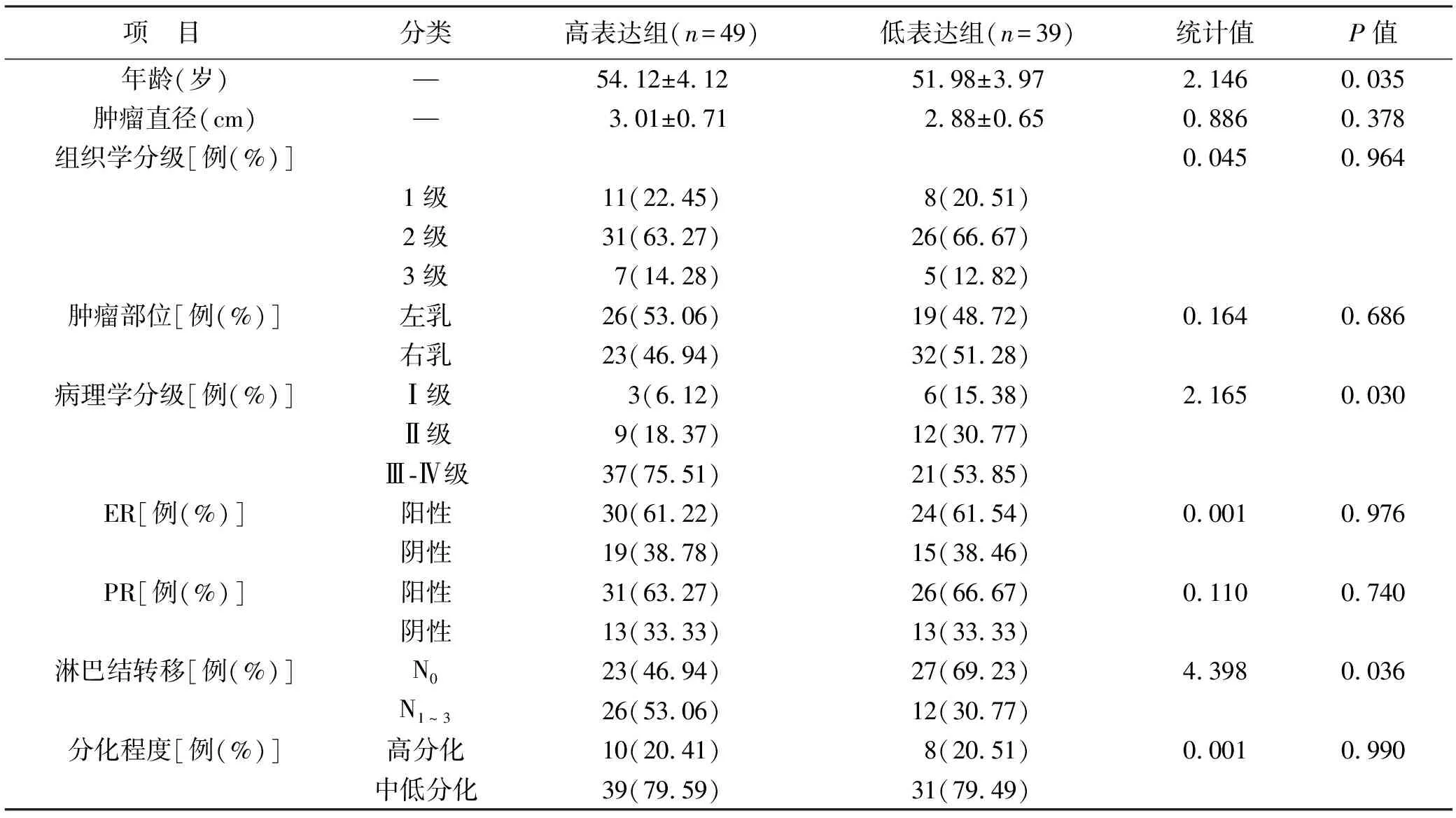
表2 SF3B1表達與患者臨床病理特征的關系
3 討 論
乳腺癌已成為我國女性中最為常見的惡性腫瘤類型,對女性健康構成了極大的威脅,位居女性腫瘤發病率和病死率的首位。盡管醫療技術持續發展與進步,乳腺癌的發生率和病死率依舊呈現持續增長的態勢[8-9]。盡管手術、放療、化療和靶向治療等多種治療手段已在臨床中廣泛應用,但仍然有相當一部分的患者在治療以后出現復發或轉移,從而影響乳腺癌患者的長期生存率[10-11]。了解癌癥的分子基礎不僅有助于更好地理解其發病機制,還可為開發新的治療策略提供方向,因此,深入探索乳腺癌的分子機制和潛在治療靶點尤為重要。
SF3B1是核糖核蛋白復合體的關鍵組成部分,對RNA的前體剪切起到至關重要的作用,在細胞的基因表達過程中,RNA前體剪切是mRNA合成及后續蛋白質翻譯過程中一個至關重要的調控步驟。研究[12-13]顯示,有56%的乳腺癌中剪接體成分基因發生突變,在ER陽性亞型患者中SF3B1的突變較為顯著,頻率較高,可能參與乳腺癌的發生。在乳腺癌中,SF3B1的突變和異常表達可能導致RNA剪切的異常,從而產生異常的mRNA和蛋白質異構體,這些異常的蛋白質異構體的功能可能發生增強、減弱或完全改變,從而影響細胞的增殖、遷移和侵襲能力,比如某些由SF3B1突變引起的RNA剪切變體可能增強細胞的生存和增殖信號,或抑制細胞的凋亡信號,從而促進乳腺癌的發生和進展[14-15]。此外,SF3B1的突變和異常表達還可能影響乳腺癌細胞對激素等其他信號的響應,比如SF3B1的某些突變可能增強或減弱乳腺癌細胞對雌激素的響應,從而影響乳腺癌的生長和治療反應。本研究對比了乳腺癌組織和癌旁組織中SF3B1的表達,結果顯示乳腺癌組織中SF3B1表達明顯較癌旁組織上調。原因可能是與SF3B1的作用機制有關,具體而言,RNA的剪切作用是保持蛋白質多樣性的關鍵,如果剪切相關的因子發生突變,可能會導致多種不正常的剪切變體,從而破壞基因序列的穩定性,異常的RNA剪切和與之相關的基因變異,已被認為是與腫瘤發展相關的關鍵特征[16-17]。SF3B1基因位于染色體2q33.1,可組成剪接體催化核心的U2小分子核糖核蛋白體(U2 small nuclear ribonucleoprotein particle,U2-snRNP),SF3B1作為SF3B的亞單位,能夠與RNA前提的5’及3’端分支點交聯,參與mRNA內含子的剪切和成熟過程[18-19]。作為RNA剪切因子中突變頻率最高的基因,突變發生在多種類型癌癥中。SF3B1的變異主要集中在其C端的22個HEAT重復結構域內,在乳腺癌中,這種變異會導致氨基酸的單點替換,表現為雜合性的突變形式,其突變位點在22個重復HEAT結構域中集中在第5至第9,乳腺癌中SF3B1的復發性錯義突變也表明mRNA剪接過程中剪接體的重要作用。有研究應用高通量測序技術評估慢性淋巴細胞性白血病患者癌癥細胞,發現SF3B1突變引起的RNA選擇性剪接大多集中在3’剪接位點,另外也有研究分析乳腺癌的生物信息學,得到了相同結論[20-21]。
本研究分析SF3B1表達對乳腺癌的診斷價值,ROC結果顯示,SF3B1的AUC為0.713,診斷效能較好。并且本研究根據ROC得出的最佳截斷值劃分高低表達組,證實SF3B1的表達水平與患者年齡、病理學分級、淋巴結轉移狀態有關,提示SF3B1在乳腺癌初期可能扮演關鍵角色,并有可能成為乳腺癌治療的預測標志物。SF3B1可通過激活RAS及MAPK等信號傳導途徑,以及介導細胞因子與其受體之間的相互作用,進而參與調控乳腺癌細胞的生物學特性,包括絲氨酸和蘇氨酸的代謝過程,尤其是RAS信號途徑的持續活化,促進正常細胞向腫瘤細胞的轉變,并觸發細胞的無限制增殖現象[22-23]。當MAPK信號途徑被過度激活或表達增強時,細胞內會觸發一系列的鏈式反應,這些反應會影響細胞核的轉錄調控元件,導致與細胞生長、擴增、遷移和死亡相關的基因的過量表達,同時使來自外界生長因子的信號作用增強,以此機制促進癌細胞生長增殖[24]。研究[25]顯示,SF3B1的反復突變與乳腺癌不同剪接活性相關,并且年齡較大的患者突變風險更高,與年齡呈現明顯相關性。然而與其他臨床病理學因素沒有顯著相關性,這可能是由于樣本量的限制,此外,由于腫瘤的內在異質性,SF3B1在各種腫瘤信號途徑中可能有不同的功能。同時,腫瘤的體積和研究操作中的變異也可能導致數據的不一致性,從而影響研究結果。因此,關于SF3B1與腫瘤的臨床病理特性和其深層次的分子機制仍需深入探討。
綜上所述,SF3B1在乳腺癌患者體內的表達水平顯著提高,其在乳腺癌的早期診斷中顯示出較高的應用價值。SF3B1的表達與患者的年齡、病理等級以及淋巴結轉移狀況等多個臨床病理指標緊密相關,表明其可能在乳腺癌的發展、局部侵犯及遠處轉移等關鍵過程中扮演著重要角色,并有助于在臨床上對乳腺癌進行診斷和評估病情。

