新型β-內酰胺酶抑制劑藥物研究進展

摘要:多重耐藥革蘭陰性菌的不斷出現及流行嚴重限制了抗感染治療用抗菌藥物的選擇,β-內酰胺酶的產生是其耐藥的主要機制。因此,針對β-內酰胺酶開發的抑制劑也成為研究熱點。近年來,已有多種新型β-內酰胺酶抑制劑藥物問世或已投入臨床使用。這些抑制劑的研發不僅為治療多重耐藥革蘭陰性菌感染提供了新的希望,而且也為抗菌藥物的再利用和研發提供了重要思路。本文將對這些抑制劑的化學結構、抗菌機制以及臨床應用進行深入探討,以期為臨床用藥提供更可靠的依據。
關鍵詞:β-內酰胺酶抑制劑;醫院獲得性感染;革蘭陰性菌;多重耐藥
中圖分類號:R978.1 文獻標志碼:A
Progress on the novel β-lactamase inhibitors
Yan Ruyu, Shen Han, and Cao Xiaoli
(Department of Laboratory Medicine, Nanjing Drum Tower Hospital, Nanjing University of Traditional Chinese Medicine, Nanjing 210008)
Abstract The continuous emergence and widespread prevalence of multidrug-resistant Gram-negative bacteria severely limit the selection of antimicrobial agents for anti-infective therapy, with the production of β-lactamases being the primary mechanism of resistance. Consequently, the development of inhibitors targeting β-lactamases has become a research hotspot. In recent years, several novel β-lactamase inhibitors have emerged or been introduced into clinical practice. The development of these inhibitors not only provides new hope for treating infections caused by multidrug-resistant Gram-negative bacteria but also offers important insights for the reuse and development of antimicrobial agents. This article delved into the chemical structures, antimicrobial mechanisms, and clinical applications of these inhibitors, aiming to provide more reliable guidance for clinical drug use.
Key words β-lactamase inhibitor; Hospital-acquired infections; Gram-negative bacteria; Multidrug resistance
全球范圍內,醫院獲得性感染(hospital acquired infections, HAIs)作為常見的感染性疾病,與高死亡率密切相關。流行病學研究顯示,腸桿菌目、不動桿菌屬和假單胞菌屬是HAIs最為常見的致病菌,常引起呼吸道、泌尿道、血液等感染[1-2]。
隨著抗菌藥物的廣泛使用,特別是碳青霉烯類抗菌藥物的使用,多重耐藥菌,尤其是耐碳青霉烯革蘭陰性菌(carbapenem resistant Gram-negative bacteria,CRGNB),以耐碳青霉烯鮑曼不動桿菌、肺炎克雷伯菌、大腸埃希菌及銅綠假單胞菌等不斷出現或流行,導致臨床抗感染治療陷入困境,醫療成本增加,住院時間延長,患者的死亡率增高[3]。
β-內酰胺酶的產生是革蘭陰性桿菌對β-內酰胺類抗菌藥物耐藥的主要機制,包括A、B、C和D 4類酶。其中,A、B和D 3類酶屬于碳青霉烯酶,因其能夠明顯水解亞胺培南或美羅培南的一類β-內酰胺酶,是目前全球廣泛流行且備受關注的酶[4-5]。所以,針對碳青霉烯酶開展的抑制劑也在不斷研發,并且有了初步的成效。
在20世紀早期,細菌感染是全球最主要的致死原因之一。抗菌藥物的發展,尤其是包括β-內酰胺類抗菌藥物在內的多類藥物,已成功遏制了這一威脅,展現出卓越的療效和選擇性。這一治療類別具備一個特殊的四元β-內酰胺環結構,對其抗菌活性至關重要。這個環結構通常被稱為氮雜環丁酮,通過在網狀結構中模擬PBPs的天然底物D-Ala-D-Ala部分,參與了對細菌細胞壁合成的抑制[6]。
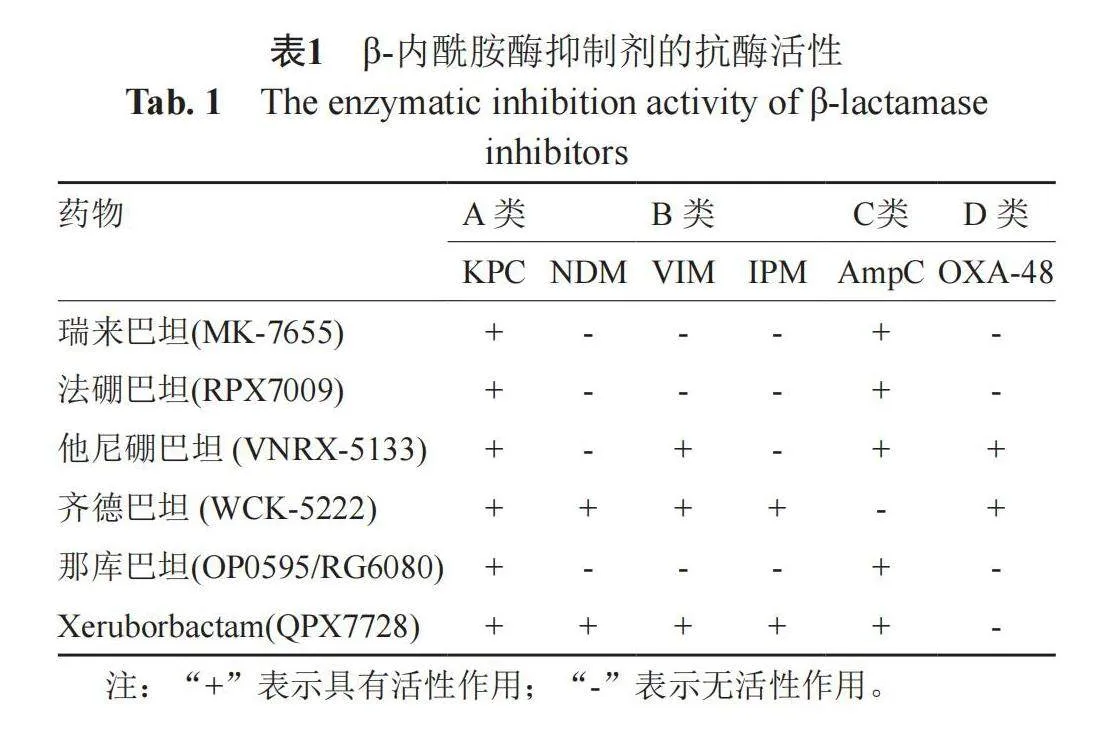
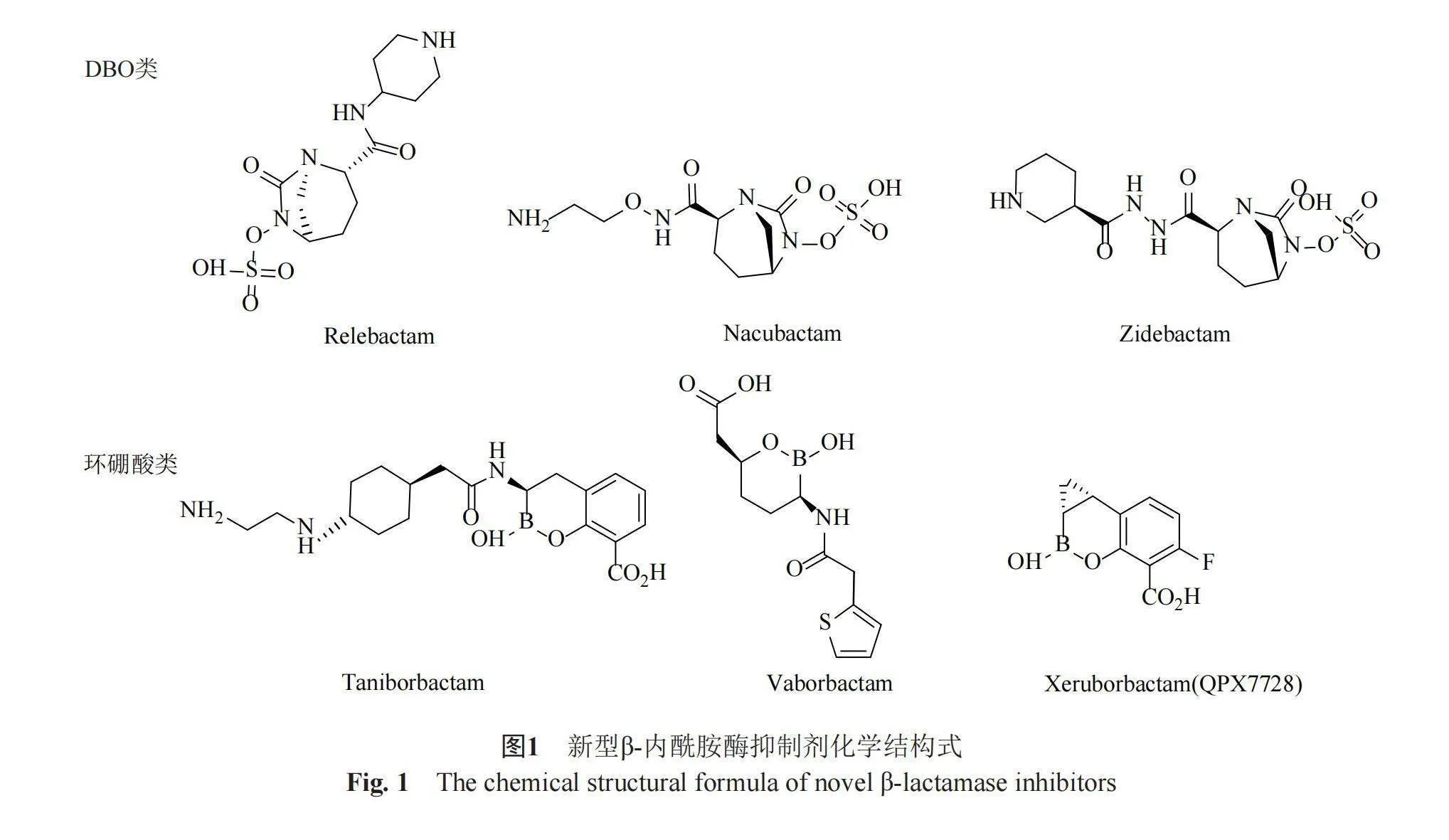
近年來,新型β-內酰胺酶抑制劑的開發包括了他唑巴坦(tazobactam)、瑞來巴坦(relebactam)、齊德巴坦(zidebactam)、法硼巴坦(vaborbactam)、他尼硼巴坦(taniborbactam)、那庫巴坦(nacubantam)、xeruborbactam等(圖1)。其中,瑞來巴坦(rele-bactam)、齊德巴坦和那庫巴坦都屬于DBO類,其五元環含有酰胺基團。DBO類抑制劑通過氨甲酰化反應針對β-內酰胺酶的活性位點絲氨酸,表現為A類和C類β-內酰胺酶的強效抑制劑。這一類化合物在阿維巴坦的基礎上進行改良,構建了一個橋接雙環尿素核心結構,旨在專門模仿β-內酰胺藥效團[7]。相比之下,法硼巴坦、他尼硼巴坦和Xeruborbactam屬于一類含有環硼酸的β-內酰胺酶抑制劑。環硼酸通過形成穩定的酰-酶復合物來有效抑制核苷酸親核性SBL和MBL。結晶學研究揭示,雙環硼酸能夠快速與SBL和MBL發生反應,形成穩定的酶-抑制劑復合物。環硼酸在sp2和sp3雜化狀態之間的“變形”能力使其在與靶分子相互作用時具有更高的適應性和靈活性,這進一步有助于實現強效的抑制[8]。
1 化學結構變化對抗菌譜及抗菌活性的影響
1.1 瑞來巴坦(relebactam)
瑞來巴坦的化學名稱為[(2S, 5R)-7-氧代-2-(哌啶-4-基氨基甲酰基)-1,6-二氮雜雙環[3.2.1]辛烷-6-基]硫酸氫,是一種在阿維巴坦結構基礎上改進的化合物。相較于阿維巴坦,瑞來巴坦的主要變化在于在氨基甲酰基2號位置的碳上引入了一個哌啶取代基[7]。
它與β-內酰胺酶的結合方式為非共價結合,首先與酶的結合位點形成非共價鍵,然后通過共價酰化酶的活性位點上的絲氨酸殘基實現抑制。與其他一些β-內酰胺酶抑制劑不同,一旦瑞來巴坦從活性位點解離,它可以重新形成其5-環結構,并能夠重新結合到目標酶[9]。
瑞來巴坦對KPC介導的DBO分裂起到作用,而KPC-2是一種β-內酰胺酶,導致細菌對碳青霉烯類抗菌藥物產生耐藥性。通過解析瑞來巴坦與KPC-2 D179N復合物的晶體結構,研究發現瑞來巴坦與Ω環保持交互,與脫酰化水發生作用,并且存在與以前未觀察到的亞胺水解產物一起。在這個過程中,瑞來巴坦的基本分子框架的哌啶環已經旋轉了約150度,與標準的DBO方向不同。這種旋轉的瑞來巴坦方向和與脫酰化水的相互作用可能在KPC介導的DBO分裂中發揮作用。瑞來巴坦的四元亞胺官能團與脫酰化水相互作用,可能有助于抑制KPC介導的β-內酰胺酶對β-內酰胺抑制劑的抵抗,并最終導致細菌死亡[10]。
1.2 法硼巴坦(vaborbactam)
法硼巴坦(VAB),先前稱為RPX 7009,其分子式為2-[(3R, 6S)-2-羥基-3-[(2-噻吩-2-基乙酰基)氨基]氧雜硼雜環己烷-6-基]乙酸,是一種環狀硼酸藥效團抑制劑,具有絲氨酸蛋白酶活性(PubChem ID: 77846445)。法硼巴坦的硼酸藥效團形成一個硼酸酯環,硼酸酯部分通過與β-內酰胺酶的催化絲氨酸側鏈的高親和力形成緩慢可逆的共價鍵。這種鍵的酶停留時間超過16 h,提供了有利的結合構型,從而提高了抑制效果[11-12]。通過引入法硼巴坦的2-噻吩并酰基,增強了對β-內酰胺酶的抑制活性。該化合物能夠阻斷KPC細菌菌株,并提高碳青霉烯類抗菌藥物的活性,特別是在攜帶編碼β-內酰胺酶的基因的CRE菌株群中[13]。法硼巴坦通過外膜上的孔蛋白OmpK 35和OmpK 36進入生物體,隨后,酶催化絲氨酸殘基與法硼巴坦的硼原子之間發生共價相互作用,形成酶抑制劑復合物。這一反應可以逆轉,因為水分子可以迅速破壞催化絲氨酸殘基和硼原子之間的共價鍵,釋放法硼巴坦[14-15]。
1.3 他尼硼巴坦(taniborbactam)
他尼硼巴坦的完整分子式為(3R)-3-[[2-[4-(2-氨基乙基氨基)環己基]乙酰基]氨基]-2-羥基-3,4-二氫-1,2-苯并沙硼烷-8-羧酸,其中含有一個堿性苯并氧雜硼雜環,一側鏈為羧酸,另一側鏈為通過氨基甲酰基連接的環己烷鏈,環己烷具有氨基乙醇胺的側鏈(PubChem ID:76902493)。他尼硼巴坦是第一個被發現的硼酸鹽β-內酰胺酶抑制劑[16],其雙環結構包括硼酸酯官能團,能夠與SBL和MBL結合,屬于雙重作用的SBL/MBL抑制劑。他尼硼巴坦通過與SBL和MBL的活性位點結合,實現對它們活性的抑制。在SBL中,他尼硼巴坦是可逆的共價抑制劑,表現出緩慢的解離和延長的活性位點停留時間(半衰期為30~105 min)。而對于MBL,它表現為競爭性抑制劑,其表觀抑制常數(Kiapp,apparent inhibition constant)值在0.019到0.081 μmol/L范圍內[17]。
他尼硼巴坦的循環硼酸酯結構使其能夠與β-內酰胺酶結合并發揮抑制作用,通過模擬過渡態結構并利用與高度保守活性位點殘基的相互作用來實現抑制。這種模擬的結構和相互作用對于抑制酶的活性具有重要作用[18]。
1.4 齊德巴坦(WCK-5107)
齊德巴坦(zidebactam)的化學名稱為[(2S, 5R)-7-氧代-2-[(3R)-哌啶-3-羰基]氨基]氨基甲酰基] 1, 6-二氮雜雙環[3.2.1]辛烷-6-基]硫酸氫鹽(PubChem ID:77846445)。該化合物的結構包含3個主要基團,分別是一個DBO基團、一個含有羧酰肼的苯甲酰胺基團,以及一個含有磺酸的氧化物基團。齊德巴坦的DBO基團能夠與PBP結合,從而抑制細菌的細胞壁合成[19]。同時,其羧酰肼基團可以與β-內酰胺酶結合,保護β-內酰胺類抗菌藥物免受水解的影響。此外,磺酸基團的存在增加了齊德巴坦在細胞外液中的溶解度和穩定性[20-21]。通過晶體結構分析發現,齊德巴坦與PBP2的活性位點發生結合,形成抑制性共價鍵,其中與PBP2催化位點上的S327發生相互作用。二酰肼基團在與S-X-N/D PBP基序中的天門冬氨酸相互作用中發揮著重要作用。此外,齊德巴坦還能提高PBP2的熔化溫度,鞏固了它與PBP2之間的相互作用。值得注意的是,盡管齊德巴坦與PBP3發生共價鍵結合,但它們導致PBP3的不穩定,表明齊德巴坦及其類似化合物對PBP2和PBP3具有不同的抑制機制[22]。
1.5 那庫巴坦(nacubactam)
在化學領域,那庫巴坦的命名為[(2S, 5R)]-2-(2-氨基乙氧基氨基甲酰基)-7-氧代-1, 6-二氮雜雙環[3.2.1]辛烷-6-基]硫酸氫鹽。該結構包含一個重氮環辛烷環,具有一個氨基乙氧基氨基甲酰基,末端為硫酸化(PubChem ID:73386748)。那庫巴坦的碳酰化速率比其他DBO快了約10倍,因此對AmpCEC(產AmpC β-內酰胺酶的大腸埃希菌表現出更強的抑制能力:kiapp為0.69 μmol/L,而其他DBO的表觀抑制常數為5.0到7.4 μmol/L。通過結晶學分析發現,與其他DBO相比,產AmpC β-內酰胺酶的大腸埃希菌與那庫巴坦羧酰化復合物具有更大的構象自由度。這可能意味著那庫巴坦在產AmpC β-內酰胺酶的大腸埃希菌的結合位點上具有更大的空間適應性和柔性[23]。那庫巴坦在阿維巴坦的氨基甲酰基側鏈上引入了氨基乙氧基。這種變化很可能是那庫巴坦單獨使用時表現出內在抗菌活性的原因。此外,那庫巴坦的化學結構特征包括含有硫酸酯官能團,該官能團有助于在與KPC-2和K234R變體結合時提供穩定性,從而發揮其抗菌活性[24]。
1.6 Xeruborbactam (QPX7728)
Xeruborbactam的分子式為C10H8BFO4的(1A R, 7B S)-5-氟-2-羥基-1a, 7b-二氫-1H環丙烷[c][1, 2]苯并惡硼-4-羧酸,是一種可逆抑制劑,通過硼原子與活性絲氨酸位點(S70)共價結合,形成使酶失活的復合物。然而,該復合物會在一定時間后解離,導致酶重新獲得活性該化合物的羧酸部分的氧原子、硼酸酯氧和羥基通過與核心位點中的兩個鋅離子配位,阻礙了NDM-1與酶形成穩定的復合物。與此同時,配體的苯基和環丙基環通過形成親脂性接觸,與NDM-1活性位點上的氨基酸側鏈發生相互作用。此外,配體的羧酸鹽與酶上的正電荷側鏈或其他氫鍵供體形成鹽橋和/或電荷輔助氫鍵,進一步調控了它們之間的相互作用。這種結合模式有助于理解該化合物與NDM-1的相互作用機制[25]。有助于抑制劑與MBL有更高的親和力[16]。盡管該藥物在直接抗菌作用方面效果較低,但在具有外排泵AdeIJK和MexAB-OprM的鮑曼不動桿菌及銅綠假單胞菌中,其抗菌能力會稍微降低[26]。
2 新型β-內酰胺酶抑制劑的抗菌譜、抗菌活性及臨床應用(表1~2)
2.1 瑞來巴坦(relebactam)
瑞來巴坦是由默沙東(Merck amp; Co)公司研發的,它與亞胺培南和西拉司丁組成了復方抗菌藥物Recarbrio。Recarbrio在2019年已經獲得美國食品藥品監督管理局(FDA,Food and Drug Administration)的批準,用于治療由某些革蘭陰性菌引起的復雜尿路感染和復雜性腹腔內感染,以及醫院獲得性細菌性肺炎和呼吸機相關細菌性肺炎[27]。瑞來巴坦是一種二氮雜二環辛烷類(DBO,diazabicyclooctane)可逆性β-內酰胺酶抑制劑[28],其機理類似于他唑巴坦,它通過競爭性抑制β-內酰胺酶的位點,從而抑制其活性,保護亞胺培南不被絲氨酸-β-內酰胺酶(SBL,Serine" β-lactamase)降解[29]。亞胺培南/瑞來巴坦具備抗廣譜β-內酰胺酶活性,對A類超廣譜β-內酰胺酶(ESBLs,extended-spetrum β-lactamase)及碳青霉烯酶KPC和C類AmpC酶都比較穩定[30-31]。該復方抗菌藥物對多種革蘭陰性病原菌均有活性,包括來自不同腸桿菌目的產KPC和產ESBLs的菌株。亞胺培南/瑞來巴坦聯合療法展現出了相當的療效和安全性[32]。
2.2 法硼巴坦(vaborbactam, RPX7009)
法硼巴坦(vaborbactam,前身為RPX7009)是一種創新型的β-內酰胺酶抑制劑,基于環硼酸藥效團。它顯示出對SBL的良好活性[9],同時能有效抑制A類碳青霉烯酶(CTX-M、SHV和TEM)和C類β-內酰胺酶。對產生KPC的菌株具有強大的體外抑制活性,但對產金屬β-內酰胺酶(MBL,metallo-β-lactamase)或OXA-48的菌株無效[33]。該藥與美羅培南的聯用是由美國的Rempex 制藥公司研發的新型抗菌藥物,于2017年獲得美國FDA批準。主要應用于治療18歲及以上患者的復雜尿路感染,其中包括由特定細菌引起的腎盂腎炎,如大腸埃希菌、肺炎克雷伯桿菌、陰溝腸桿菌等易感微生物引起的感染。此外,它還可用于治療由耐碳青霉烯類抗菌藥物腸桿科菌(CRE,carbapenem-resistant Enterobacteriaceae)引起的難治性感染,包括血液感染、腹膜炎和肺炎等[34-36]。
2.3 他尼硼巴坦(taniborbactam,VNRX-5133)
他尼硼巴坦(原名VNRX-5133)是由美國Venatorx 制藥公司研發的藥物,目前正在與頭孢吡肟組成復合制劑,用于治療復雜的尿路感染和醫院獲得性細菌性肺炎以及呼吸機相關性細菌性肺炎[37]。他尼硼巴坦和頭孢吡肟的聯合使用目前正在進行第三階段的臨床試驗,該組合的新藥申請已被美國FDA接受,并獲得了優先審查。他尼硼巴坦對SBL與MBL(包括KPC-2,KPC-3, OXA-48,NDM-1,NDM-9,VIM-2,SPM-1以及AmpC酶和ESBLs等)均表現出顯著活性,且在抑制B1亞類MBL方面優于阿維巴坦和法硼巴坦[38]。然而,對美國疾病控制與預防中心以及FDA的抗菌藥物耐藥菌株庫中的產MBL腸桿菌屬分離株進行的試驗顯示,對頭孢吡肟/他尼硼巴坦的敏感性進行檢測時,異質耐藥性(85%)顯著高于耐藥性和敏感性。因此,在研究新型抗菌藥物頭孢吡肟/他尼硼巴坦的抗藥性時,應考慮到這種異質性現象的影響[39]。
2.4 齊德巴坦(zidebactam,WCK-5222)
齊德巴坦是由Wockhardt制藥研發的一種新型β-內酰胺酶抑制劑,能夠高效抑制青霉素結合蛋白2(PBP2,penicillin binding protein 2)。與傳統的β-內酰胺結構不同,齊德巴坦是一種DBO分子,不會被β-內酰胺酶水解[40-42],從而有效抑制細菌產生的β-內酰胺酶,對抗菌藥物的β-內酰胺環的破壞。在環境中存在齊德巴坦的情況下,即使經過長時間的酶誘導,也不會導致齊德巴坦的抑制活性降低。齊德巴坦能夠使耐碳青霉烯的鮑曼不動桿菌菌株恢復對舒巴坦的敏感性。與舒巴坦/阿維巴坦的協同作用相比,舒巴坦/齊德巴坦的效果更為優越。在齊德巴坦的作用下,舒巴坦的最小抑菌濃度(MIC,minimum inhibitory concentration)值顯著降低至≤4 μg/mL[43];與厄他培南聯合使用時,齊德巴坦對多種革蘭陰性菌表現出活性。齊德巴坦與頭孢吡肟復合制劑的臨床試驗顯示其可以用于治療嚴重的革蘭陰性菌感染。1 mg/L的齊德巴坦與1 mg/L的頭孢吡肟聯合使用時,對大多數產AmpC、ESBLs、K1、OXA-48和KPC β-內酰胺酶的腸桿菌科及大多數產MBL的菌株(35株中的29株)具有活性[44]。在1632株抗菌藥物耐藥性敏感性研究中,厄他培南/齊德巴坦 1:1組合可以有效抑制超過90%的大腸埃希菌,這些細菌產AmpC、ESBLs、KPC、MBL或OXA-48酶。在厄他培南用量為0.5 μg/mL時,這種組合對這些菌株的抑制效果尤為顯著[45]。該藥已經獲得了美國FDA對其Ⅲ期臨床試驗的批準。
2.5 那庫巴坦(nacubactam,OP0595 free acid)
那庫巴坦是由明治制果藥業(Meiji Seika Pharma)公司發現并開發的一種新型化合物,目前正在進行全球范圍內的Ⅲ期臨床試驗,屬于DBO類化合物,是一種創新的β-內酰胺酶抑制劑。那庫巴坦具有多重作用機制,能夠有效抑制腸桿菌科細菌中的MBL和PBP2,以及A、C和部分D類β-內酰胺酶。通過這種方式,它可以保護與之聯合使用的β-內酰胺類藥物免受水解,提高藥物的療效。有研究測試了309株產MBL的腸桿菌科菌株的MIC,結果顯示,單獨使用那庫巴坦時,變形菌屬的MIC幾乎全部大于32 mg/L,
而其他菌屬的MIC呈現雙峰曲線分布,分別為1~
8 μg/mL和>32 μg/mL。然而,在與美羅培南或頭孢吡肟聯合使用時,那庫巴坦對80.3%~93.3%的MBL陽性菌株表現出顯著的抗菌活性[46]。那庫巴坦還表現出對銅綠假單胞菌、肺炎克雷伯菌和陰溝腸桿菌等細菌的有效抑制作用[16]。特別值得注意的是,對那些產生AmpC酶或表達KPC的銅綠假單胞菌[47],
以及對美羅培南耐藥的多重耐藥菌,那庫巴坦也顯示出顯著的活性[48]。目前,那庫巴坦正在用于治療由難治性革蘭陰性菌引起的血流感染[49]。
2.6 Xeruborbactam
Xeruborbactam目前由Qpex Biopharma公司開發,該公司計劃被Shionogi公司收購。Xeruborbactam
正在進行臨床試驗,用于治療由耐藥革蘭陰性菌引起的感染,如不動桿菌、銅綠假單胞菌和腸桿菌。Xeruborbactam是一種環狀硼酸類抑制劑,能對多種SBL和對多種MBL具有活性,包括各類IMP酶以及NDM-9,而同為環狀硼酸類的他尼硼巴坦則無法對這些酶產生抑制作用[50]。此外,美羅培南與xeruborbactam的組合使用(xeruborbactam固定濃度為8 μg/mL)對不攜帶MBL的CRE表現出極高的聯用活性,MIC90值僅為0.125 μg/mL。據研究報道,對于90%以上的CRE病原菌,不論是MBL陰性還是陽性,美羅培南與xeruborbactam的MIC值均
≤8 μg/mL[51],對于CRE以及碳青霉烯耐藥鮑曼不動桿菌,xeruborbactam的MIC50/MIC90值分別為
16/32 μg/mL和16/64 μg/mL(對銅綠假單胞菌的MIC50/MIC90值>64 μg/mL)。特別值得注意的是,在肺炎克雷伯菌體內,OmpK36的失活以及與其伴隨的OmpK35的失活,都將使xeruborbactam MIC值提高2~4倍。
3 結語
近年來,隨著多種抗菌藥物的不斷發展,暫時緩解了由GNB感染引起的治療困境,但是頭孢他啶/
阿維巴坦等新藥大量用于臨床治療的同時,新的耐藥問題也在不斷出現,特別是針對產金屬β-內酰胺酶細菌的藥物相當受限,使得臨床治療還是舉步維艱,而有一些在其他國家上市的藥物,在我們國家要上市還需要時間。在當前的形勢下,除了做好耐藥防控,更多的是要準確把握抗菌藥物的用藥指征,按照藥敏結果、療程劑量等合理使用,以延緩抗菌藥物的耐藥發展。
參 考 文 獻
Eichenberger E M, Thaden J T. Epidemiology and mechanisms of resistance of extensively drug resistant Gram-negative bacteria[J]. Antibiotics(Basel), 2019, 8(2): 37.
Alizadeh N, Ahangarzadeh Rezaee M, Samadi Kafil H, et al. Evaluation of resistance mechanisms in carbapenem-resistant Enterobacteriaceae[J]. Infect Drug Resist, 2020, 13: 1377-1385.
Watkins R R, Van Duin D. Current trends in the treatment of pneumonia due to multidrug-resistant Gram-negative bacteria[J]. F1000Res, 2019, 8: F1000 Faculty Rev-121..
Thapa P, Bhandari D, Shrestha D, et al. A hospital based surveillance of metallo-beta-lactamase producing gram negative bacteria in Nepal by imipenem-EDTA disk method[J]. BMC Res Notes, 2017, 10(1): 322.
Araujo B F, Ferreira M L, Campos P A, et al. Clinical and molecular epidemiology of multidrug-resistant P. aeruginosa carrying aac(6’)-Ib-cr, qnrS1 and blaSPM genes in Brazil[J]. PLoS One, 2016, 11(5): e0155914.
Gavara L, Verdirosa F, Legru A, et al. 4-(N-Alkyl- and -acyl-amino)-1,2,4-triazole-3-thione analogs as metallo-beta-lactamase inhibitors: Impact of 4-linker on potency and spectrum of inhibition[J]. Biomolecules, 2020, 10(8): 1094.
Smith J R, Rybak J M, Claeys K C. Imipenem-cilastatin-relebactam: A novel beta-lactam-beta-lactamase inhibitor combination for the treatment of multidrug-resistant gram-negative infections[J]. Pharmacotherapy, 2020, 40(4): 343-356.
Krajnc A, Lang P A, Panduwawala T D, et al. Will morphing boron-based inhibitors beat the beta-lactamases?[J]. Curr Opin Chem Biol, 2019, 50: 101-110.
Zhanel G G, Lawrence C K, Adam H, et al. Imipenem-relebactam and meropenem-vaborbactam: Two novel carbapenem-beta-lactamase inhibitor combinations[J]. Drugs, 2018, 78(1): 65-98.
Alsenani T A, Viviani S L, Papp-Wallace K M, et al. Exploring avibactam and relebactam inhibition of Klebsiella pneumoniae carbapenemase D179N variant: Role of the Omega loop-held deacylation water[J]. Antimicrob Agents Chemother, 2023, 67(10): e0035023.
Cho J C, Zmarlicka M T, Shaeer K M, et al. Meropenem/vaborbactam, the first carbapenem/beta-lactamase inhibitor combination[J]. Ann Pharmacother, 2018, 52(8): 769-779.
Bhowmick T, Weinstein M P. Microbiology of meropenem-vaborbactam: A novel carbapenem beta-lactamase inhibitor combination for carbapenem-resistant Enterobacterales infections[J]. Infect Dis Ther, 2020, 9(4): 757-767.
Duda-Madej A, Viscardi S, Topola E. Meropenem/vaborbactam: Beta-lactam/beta-lactamase inhibitor combination, the future in eradicating multidrug resistance[J]. Antibiotics(Basel), 2023, 12(11): 1612.
Lomovskaya O, Sun D, Rubio-Aparicio D, et al. Vaborbactam: Spectrum of beta-lactamase inhibition and impact of resistance mechanisms on activity in Enterobacteriaceae[J]. Antimicrob Agents Chemother, 2017, 61(11): e01443-17.
Tsivkovski R, Totrov M, Lomovskaya O. Biochemical Characterization of QPX7728, a new ultrabroad-spectrum beta-lactamase inhibitor of serine and metallo-beta-lactamases[J]. Antimicrob Agents Chemother, 2020, 64(6): e00130-20.
Arer V, Kar D. Biochemical exploration of beta-lactamase inhibitors[J]. Front Genet, 2022, 13: 1060736.
Krajnc A, Brem J, Hinchliffe P, et al. Bicyclic boronate VNRX-5133 inhibits metallo- and serine-beta-lactamases[J]. J Med Chem, 2019, 62(18): 8544-8556.
Hamrick J C, Docquier J D, Uehara T, et al. VNRX-5133(taniborbactam), a broad-spectrum inhibitor of serine- and metallo-beta-lactamases, restores activity of cefepime in Enterobacterales and Pseudomonas aeruginosa[J]. Antimicrob Agents Chemother, 2020, 64(3): e01963-19.
Luci G, Mattioli F, Falcone M, et al. Pharmacokinetics of non-beta-lactam beta-lactamase inhibitors[J]. Antibiotics(Basel), 2021, 10(7): 769.
Alfei S, Schito A M. Beta-lactam antibiotics and beta-lactamase enzymes inhibitors, Part 2: Our limited resources[J]. Pharmaceuticals(Basel), 2022, 15(4): 476.
Yamanushkin P, Kaya K, Feliciano M A M, et al. SuFExable NH-pyrazoles via 1,3-dipolar cycloadditions of Diazo compounds with bromoethenylsulfonyl fluoride[J]. J Org Chem, 2022, 87(5): 3868-3873.
Rajavel M, Kumar V, Nguyen H, et al. Structural characterization of diazabicyclooctane beta-lactam \"enhancers\" in complex with penicillin-binding proteins PBP2 and PBP3 of Pseudomonas aeruginosa[J]. mBio, 2021, 12(1): e03058-20.
Lang P A, Leissing T M, Page M G P, et al. Structural investigations of the inhibition of Escherichia coli AmpC beta-Lactamase by diazabicyclooctanes[J]. Antimicrob Agents Chemother, 2021, 65(2): e02073-20.
Barnes M D, Taracila M A, Good C E, et al. Nacubactam enhances meropenem activity against carbapenem-resistant Klebsiella pneumoniae producing KPC[J]. Antimicrob Agents Chemother, 2019, 63(8): e00432-19.
Lomovskaya O, Tsivkovski R, Sun D, et al. QPX7728, an ultra-broad-spectrum β-lactamase inhibitor for intravenous and oral therapy: Overview of biochemical and microbiological characteristics[J]. Front Microbiol, 2021, 12: 697180.
Sun D, Tsivkovski R, Pogliano J, et al. Intrinsic antibacterial activity of xeruborbactam in vitro: Assessing spectrum and mode of action[J]. Antimicrob Agents Chemother, 2022, 66(10): e0087922.
Codjoe F S, Donkor E S. Carbapenem resistance: A review[J]. Med Sci(Basel), 2017, 6(1): 1.
Mashaly M E, Mashaly G E. Activity of imipenem/relebactam on Klebsiella pneumoniae with different mechanisms of imipenem non-susceptibility[J]. Iran J Microbiol, 2021, 13(6): 785-792.
Shi Z, Zhang J, Tian L, et al. A comprehensive overview of the antibiotics approved in the last two decades: Retrospects and prospects[J]. Molecules, 2023, 28(4): 1762.
Jones J A, Virga K G, Gumina G, et al. Recent advances in the rational design and optimization of antibacterial agents[J]. Medchemcomm, 2016, 7(9): 1694-1715.
Garcia-Fernandez S, Calvo J, Cercenado E, et al. Activity of imipenem/relebactam against Enterobacterales and Pseudomonas aeruginosa in Spain. SMART 2016-2020[J]. Rev Esp Quimioter, 2023, 36(3): 302-309.
Giron R M, Ibanez A, Gomez-Punter R M, et al. New evidence in severe pneumonia: imipenem/cilastatin/relebactam[J]. Rev Esp Quimioter, 2022, 35 Suppl 1(Suppl 1): 46-49.
Pascale R, Giannella M, Bartoletti M, et al. Use of meropenem in treating carbapenem-resistant Enterobacteriaceae infections[J]. Expert Rev Anti Infect Ther, 2019, 17(10): 819-827.
Andrei S, Valeanu L, Chirvasuta R, et al. New FDA approved antibacterial drugs: 2015-2017[J]. Discoveries(Craiova), 2018, 6(1): e81.
Chawla M, Verma J, Gupta R, et al. Antibiotic potentiators against multidrug-resistant bacteria: Discovery, development, and clinical relevance[J]. Front Microbiol, 2022, 13: 887251.
Dhillon S. Meropenem/vaborbactam: A review in complicated urinary tract infections[J]. Drugs, 2018, 78(12): 1259-1270.
Dowell J A, Marbury T C, Smith W B, et al. Safety and pharmacokinetics of taniborbactam(VNRX-5133) with cefepime in subjects with various degrees of renal impairment[J]. Antimicrob Agents Chemother, 2022, 66(9): e0025322.
Le Terrier C, Gruenig V, Fournier C, et al. NDM-9 resistance to taniborbactam[J]. Lancet Infect Dis, 2023, 23(4): 401-402.
Martinez-Servat S, Yero D, Huedo P, et al. Heterogeneous colistin-resistance phenotypes coexisting in Stenotrophomonas maltophilia isolates influence colistin susceptibility testing[J]. Front Microbiol, 2018, 9: 2871.
Mesh C L, Baxter B T, Pearce W H, et al. Collagen and elastin gene expression in aortic aneurysms[J]. Surgery, 1992, 112(2): 256-261; discussion 261-262.
Sethuvel D P M, Bakthavatchalam Y D, Karthik M, et al. β-Lactam resistance in ESKAPE pathogens mediated through modifications in penicillin-binding proteins: An overview[J]. Infect Dis Ther, 2023, 12(3): 829-841.
Kaushik A, Ammerman N C, Parrish N M, et al. New beta-lactamase inhibitors nacubactam and zidebactam improve the in vitro activity of beta-lactam antibiotics against Mycobacterium abscessus complex clinical isolates[J]. Antimicrob Agents Chemother, 2019, 63(9): e00733-19.
Cedano J, Baez M, Pasteran F, et al. Zidebactam restores sulbactam susceptibility against carbapenem-resistant Acinetobacter baumannii isolates[J]. Front Cell Infect Microbiol, 2022, 12: 918868.
Livermore D M, Mushtaq S, Warner M, et al. In vitro activity of cefepime/zidebactam(WCK 5222) against Gram-negative bacteria[J]. J Antimicrob Chemother, 2017, 72(5): 1373-1385.
Mushtaq S, Garello P, Vickers A, et al. Activity of ertapenem/zidebactam(WCK 6777) against problem Enterobacterales[J]. J Antimicrob Chemother, 2022, 77(10): 2772-2778.
Mushtaq S, Vickers A, Woodford N, et al. Activity of nacubactam(RG6080/OP0595) combinations against MBL-producing Enterobacteriaceae[J]. J Antimicrob Chemother, 2019, 74(4): 953-960.
Asempa T E, Motos A, Abdelraouf K, et al. Meropenem-nacubactam activity against AmpC-overproducing and KPC-expressing Pseudomonas aeruginosa in a neutropenic murine lung infection model[J]. Int J Antimicrob Agents, 2020, 55(2): 105838.
Monogue M L, Giovagnoli S, Bissantz C, et al. In vivo efficacy of meropenem with a novel non-beta-lactam-beta-lactamase inhibitor, nacubactam, against Gram-negative organisms exhibiting various resistance mechanisms in a murine complicated urinary tract infection model[J]. Antimicrob Agents Chemother, 2018, 62(9): e02596-17.
Bassetti M, Vena A, Sepulcri C, et al. Treatment of bloodstream infections due to Gram-negative bacteria with difficult-to-treat resistance[J]. Antibiotics(Basel), 2020, 9(9): 632.
Lomovskaya O, Tsivkovski R, Totrov M, et al. New boronate drugs and evolving NDM-mediated beta-lactam resistance[J]. Antimicrob Agents Chemother, 2023, 67(9): e0057923.
Lomovskaya O, Castanheira M, Lindley J, et al. In vitro potency of xeruborbactam in combination with multiple beta-lactam antibiotics in comparison with other beta-lactam/beta-lactamase inhibitor(BLI) combinations against carbapenem-resistant and extended-spectrum beta-lactamase-producing Enterobacterales[J]. Antimicrob Agents Chemother, 2023, 67(11): e0044023.

