濃香型白酒在新、老窖池發酵過程中酒醅微生物群落結構差異分析
邱顯平,黃 橋,楊 靜,田 蕾,劉 英,林宜錦,關統偉*
(1.四川全興酒業有限公司,四川 成都 611637;2.西華大學 食品與生物工程學院,四川 成都 610039;3.食品微生物四川省重點實驗室,四川 成都 610039)
中國白酒歷史悠久,內涵豐富,是傳統文化的代表符號之一。由于生產原料、工藝以及地理環境的差異,中國白酒經過長期的發展和演變形成了以三大香型(濃香、醬香和清香)為主導的產業格局。其中,濃香型白酒以其芳香濃郁、綿柔甘冽、余味悠長的風格和口感深受消費者的青睞,獨占市場鰲頭[1-2]。
濃香型白酒是以糧谷為原料,采用濃香大曲為糖化發酵劑,經泥窖固態發酵、固態蒸餾、陳釀、勾調而成[3]。其風味物質主要來自酒曲、原料及微生物發酵過程,其中微生物發酵是白酒風味的主要來源[4]。如乳酸菌產生大量有機酸,芽孢桿菌(Bacillussp.)產生特殊的風味成分,釀酒酵母(Saccharomyces)發酵產生酒精,而非釀酒酵母則負責代謝如酯類、酸類、高級醇類、醛類和萜烯類化合物[5-6]。因此,明確白酒發酵過程中相關微生物作用及其與特征風味的關系對其品質提升具有重要意義。而窖池是濃香型白酒發酵微生物主要來源之一,其四壁覆蓋的窖泥中擁有豐富的微生物資源,特別是細菌和古菌[7]。這些微生物經過窖內低氧、低pH、高乙醇等極端環境的長期篩選,形成有益于濃香型白酒生香的群落結構,與白酒品質密切相關[8-9]。在無氧發酵過程中,窖泥和酒醅中的微生物借助固、液、氣三相系統相互擴散和遷徙,該過程調控著窖池內部的物質轉化和能量代謝,最終決定了發酵的進程和結果[10-11]。
一般認為,窖池越老,酒質越好[12]。有研究發現,與新窖泥相比,老窖泥中更豐富的菌屬組成形成了完整的窖泥菌群代謝網絡[13]。老窖泥中更加豐富的瘤胃菌科(Ruminococcaceae)和梭菌屬(Clostridium)[14],可以降解乳酸生成己酸、丁酸和乙酸等;沉積物棒菌屬(Sedimentibacter)和氨基酸桿狀菌屬(Aminobacterium)[15]可以降解氨基酸生成乙酸和丁酸等;互養單胞菌屬(Syntrophomonas)[16]可以降解中鏈的脂肪酸形成乙酸和丙酸等。老窖泥中各類微生物相互作用,形成完整的窖泥菌群代謝鏈,其豐富的微生物群落也使得其生產的濃香型白酒風味更佳,品質更好。目前,對于窖池的探索更多的集中在不同窖齡或不同空間位置窖泥中微生物群落結構的演替與區別[17-18],以及窖泥中微生物群落與理化指標的相關性研究[19],對于新、老窖池中發酵酒醅微生物群落演替規律差異性研究較少。本研究采用高通量測序技術解析成都市某酒廠濃香型白酒酒醅在新、老窖池發酵過程中的微生物群落動態演替特征以及多樣性組成,以期為濃香型白酒發酵過程微生態研究提供更多的有益信息,同時也為認識不同窖齡對濃香型酒醅微生物群落的具體影響提供數據參考。
1 材料與方法
1.1 材料與試劑
1.1.1 材料
酒醅樣品:成都某酒業有限公司,發酵周期為95 d。
1.1.2 試劑
Power SoilR脫氧核糖核酸(deoxyribonucleic acid,DNA)分離試劑盒:美國MO Bio Laboratories公司;聚合酶鏈式反應(polymerase chain reaction,PCR)純化試劑盒:日本TaKaRa公司;Illumina TruSeq DNA樣品制備LT試劑盒:美國Life公司。
1.2 儀器與設備
Pico-21臺式離心機:美國Thermo Fisher公司;GL-88B旋渦混合器:海門市其林貝爾儀器制造有限公司;3614 ZONKIA USTC Zonkia低速離心機:安徽科學儀器有限公司;TND03-H-H均勻型干式恒濕器:深圳拓能達科技有限公司;DYCZ-21電泳槽:北京市六一儀器廠;Qubit2.0熒光儀:新加坡Invitrogen公司。
1.3 方法
1.3.1 樣品采集方法
從新(S組)、老窖池(T組)中采集濃香型白酒酒醅樣品,新、老窖池分別經過了6年和30年的連續使用。為了滿足生物學重復,每組樣本由隨機選擇的3個平行窖池組成。依據發酵溫度的變化過程,分別在發酵第0、7、15、25、45、70和95天收集酒醅樣本,每個窖池樣本由6個子樣本(每個子樣本200 g)均勻混合而成(圖1)。新窖池樣品編號為S0、S7、S15、S25、S45、S70、S95,老窖池樣品編號為T0、T7、T15、T25、T45、T70、T95。酒醅樣本的采集和運輸過程遵循無菌原則,樣本保存在-80 ℃保存條件下備用。
圖1 酒醅樣品采樣示意圖Fig.1 Sampling diagram of fermented grains
1.3.2 DNA提取、PCR擴增與Illumina Miseq高通量測序
稱取酒醅樣品6 g,根據Power SoilRDNA分離試劑盒的操作說明提取基因組DNA,以其為模板,采用包含barcode的引物對338F/806R和ITS1F/ITS2R[20]分別PCR擴增細菌16S DNA V3-V4和真菌ITS1的高變區基因序列,PCR擴增條件及體系參考TAN Y W等[21]的方法。PCR擴增產物用PCR純化試劑盒進行純化,并根據Illumina TruSeq DNA樣品制備LT試劑盒的說明書構建文庫,最后在Illumina Miseq(PE2500)平臺上機測序。原始數據保存在美國國立生物技術信息中心(national center for biotechnology information,NCBI)數據庫,登錄號為PRJNA622890。
1.3.3 序列處理
原始序列通過QIIME pipeline(v.1.8.0)進行處理[22]:①序列解復用,去除標簽、引物和接頭序列;②過濾序列長度<110 bp、模糊堿基>2以及平均得分<30的低質量序列;③使用Uchime評估并去除嵌合體;④經過Uclust將過濾后的高質量序列按照最小置信閾值(0.97)聚類成不同的操作分類單元(operational taxonomic unit,OTU);最后,排除可能是葉綠體或線粒體的序列,并計算相應的Chao1、Shannon和Simpson指數(按照最低序列數進行歸一化處理)。
1.3.4 數據分析
通過單因素方差分析(analysis of variance,ANOVA)中的Duncan檢驗計算Alpha多樣性指數的組間差異;采用基于Bray-Curtis距離系數的主坐標分析(principal coordinate analysis,PCoA)比較新、老窖池發酵過程中微生物群落的組成和結構差異,并使用相似性分析(analysis of similarities,ANOSIM)檢驗顯著性;通過計算屬間的Spearman等級關聯度揭示微生物群落之間的關系,為了降低網絡復雜性,只有顯著的相關性(P<0.05)才被認為是有效的相關性。通過Gephi對微生物之間的相互關系進行可視化。
2 結果與分析
2.1 新、老窖池濃香型白酒發酵過程中酒醅微生物菌群的α-多樣性分析
α-多樣性是能夠反映特定區域或生態系統內生物豐富度和多樣性的綜合指標[21]。新、老窖池濃香型白酒發酵過程中酒醅樣品微生物菌群的α-多樣性見圖2。由圖2可知,整體而言,兩組窖池濃香型白酒發酵過程中酒醅樣品微生物菌群的α-多樣性呈先增后減的變化趨勢,并且細菌菌群的豐富度和多樣性都遠高于真菌菌群。在發酵前7 d,細菌和真菌菌群的α-多樣性都有大幅度的提高,表明大量的微生物開始復蘇增殖。在新窖池組中,細菌和真菌菌群的多樣性分別在第7天和第15天達到最高,估計物種的總數分別為703種和116種。相比之下,老窖池組中細菌和真菌菌群的多樣性要明顯低于新窖池組。值得注意的是,老窖池組中細菌菌群多樣性的增長趨勢要滯后于新窖池組,而真菌菌群則呈現相反的趨勢。在發酵70~95 d微生物菌群α-多樣性降低,推測是因為發酵后期酒醅中乙醇含量和酸度過高,而有機物與氧含量過低所致[23]。
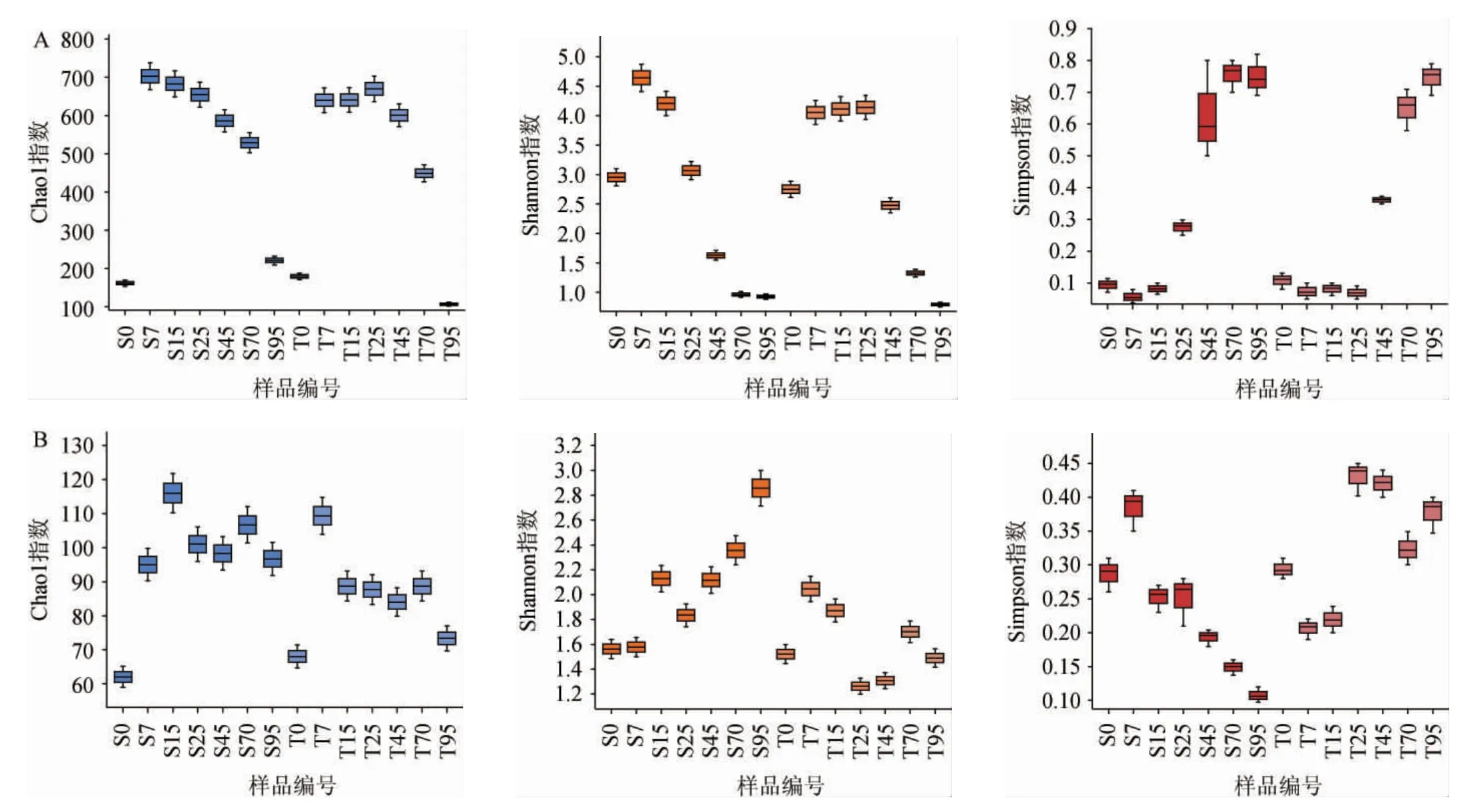
圖2 新、老窖池濃香型白酒發酵過程中細菌(A)與真菌(B)菌群的α-多樣性分析結果Fig.2 Analysis results of α-diversity of bacteria (A) and fungi (B) during strong-flavor Baijiu fermentation in new and old pits
2.2 新、老窖池濃香型白酒發酵過程中酒醅微生物群落差異
在了解新、老窖池組內微生物菌群多樣性的基礎上,通過PCoA比較新、老窖池濃香型白酒發酵過程中酒醅樣品組間微生物群落的多樣性,結果見圖3。
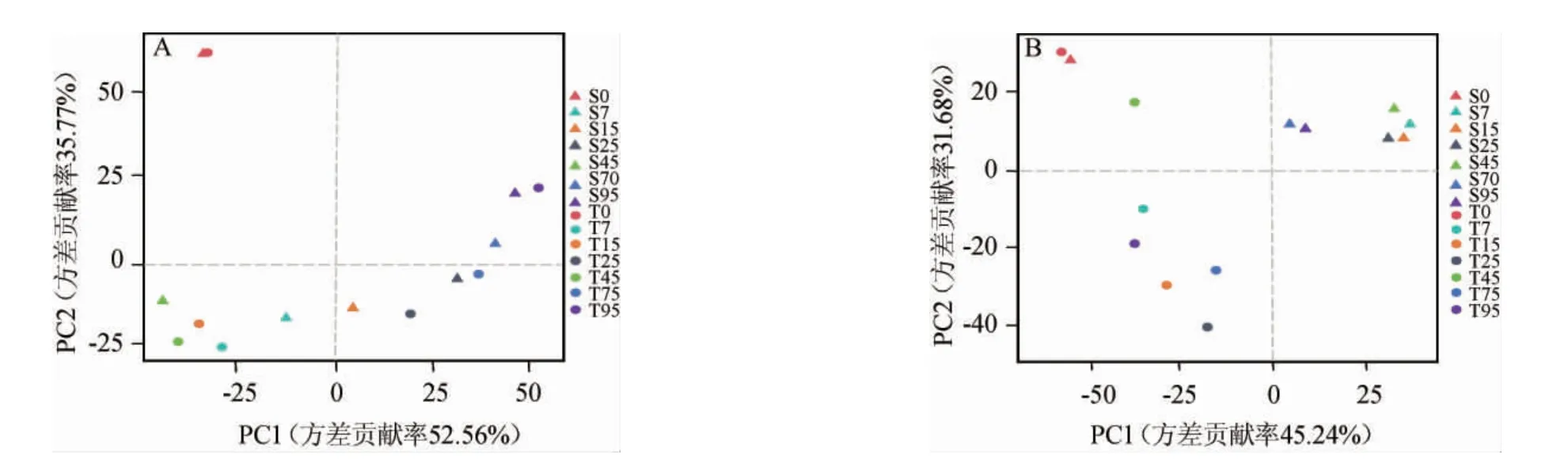
圖3 基于Bray-Curtis距離系數新、老窖池酒醅樣品細菌(A)和真菌(B)菌群的主坐標分析結果Fig.3 Principal coordinate analysis results of bacterial (A) and fungal (B) communities in fermented grains samples of new and old pits based on Bray-Curtis distance coefficient
由圖3可知,整體而言,細菌群落的動態演替在新、老窖池濃香型白酒發酵過程中高度相似。兩組酒醅樣品在PCoA坐標空間中沒有形成明顯的聚集,說明細菌群落在整個發酵過程都處在不斷的演替之中,而且發酵前期的結構變化較大,而后期則趨于穩定。相比之下,真菌群落的演替在兩組窖池濃香型白酒發酵過程中有明顯的差異,形成各自的集簇。盡管如此,兩組窖池發酵酒醅樣品S0、T0的細菌和真菌菌群在PCoA坐標空間相互接近或重合,說明發酵初始酒醅樣本中細菌和真菌的群落結構十分相似,這可能歸因于新、老窖池入池的初始糟醅是一樣的結果所致[24]。
2.3 新、老窖池濃香型白酒發酵過程中酒醅微生物群落的組成及其動態演替特征
2.3.1 細菌群落組成及動態演替特征
在目和屬水平,新、老窖池濃香型白酒發酵過程中酒醅細菌群落組成見圖4,本研究將在某一樣品中相對豐度>1%的微生物定義為優勢微生物。由圖4A可知,新、老窖池濃香型白酒發酵過程中具有高度相似的種群動態。乳桿菌目(Lactobacillales)、腸桿菌目(Enterobacteriales)和芽孢桿菌目(Bacillales)是新、老窖池酒醅樣品S0、T0中的優勢細菌目。但是,這些優勢細菌目在發酵進行的前7天逐漸被厭氧繩菌目(Anaerolineales)、擬桿菌目(Bacteroidales)以及其他迅速增殖的類群所取代,這一動態過程代表了發酵早期(0~7 d)細菌群落的演替模式(方向)。隨著發酵的進行,乳桿菌目的相對豐度逐漸回升并在中后期成為最主要的類群,這期間其他所有類群的相對豐度都呈連續下降趨勢。厭氧繩菌目和擬桿菌目維持其優勢地位直到發酵進行的第25天左右,隨后相對豐度進一步下降至1%以下。值得注意的是,乳桿菌目在新窖池組中的增長趨勢要明顯快于老窖池組,乳桿菌目是乳酸和醋酸等有機酸的主要生產者[25],所形成的酸脅迫可能會抑制酸敏感類群的微生物正常生長,如芽孢桿菌屬(Bacillus),而其中的蠟樣芽孢桿菌(Bacillus cereus)和地衣芽孢桿菌(Bacillus licheniformis)是重要的己酸產生菌[26],這也可能是導致新窖池己酸乙酯含量偏低的一個主要因素。此外,其他優勢細菌目還包括梭菌目(Clostridiales)(0.1%~6.6%)、假單胞菌目(Pseudomonadales)(0.2%~6.8%)、甲基球菌目(Methylococcales)(0~4.5%)、β變形桿菌目(Betaproteobacteriales)(0~3.0%)和微球菌目(Micrococcales)(0~4.5%)。這些類群大都在第7天大量出現,并隨著發酵進行而逐漸減少。其中,梭菌目、假單胞菌目和甲基球菌目的相對豐度在老窖池組的發酵過中普遍高于新窖池組。有研究表明,梭菌目的相對豐度隨著窖齡的增加而增加,而梭狀芽孢桿菌(如科氏梭菌(Clostridium kluyveri))可以利用乙醇和乙酸產生己酸,是重要的己酸菌之一[27],這可能會使得老窖生產的濃香型白酒含有更高的己酸乙酯。

圖4 基于目(A)和屬水平(B)新、老窖池濃香型白酒發酵過程中酒醅細菌群落結構的動態變化Fig.4 Dynamic changes of bacterial community structure in fermented grains during strong-flavor Baijiu fermentation in new and old pits based on order(A)and genus level(B)
由圖4B可知,乳桿菌屬(Lactobacillus)(1.05%~91.24%)是乳桿菌目的代表菌屬,也是發酵過程中最具優勢的細菌類群,該菌屬相對豐度的變化趨勢與乳桿菌目基本一致。有研究表明,乳桿菌屬(Lactobacillus)在發酵后期很大程度上主導了細菌群落的演替過程[28]。除此之外,乳桿菌目中的魏斯氏菌屬(Weissella)(0.07%~17.57%)和片球菌屬(Pediococcus)(0.01%~11.31%)只在酒醅樣本S0、T0中占據優勢地位,并且魏斯氏菌屬在酒醅樣品T0(17.57%)中的相對豐度要顯著高于S0(12.08%)。隨著發酵的進行,兩者的相對豐度都呈連續下降的趨勢。有研究發現,窖池發酵前期出現的Weissella、Pediococcus和部分Lactobacillus菌株能夠快速產生乳酸、乙酸等有機酸,從而降低發酵體系的pH,抑制雜菌生長,代謝產生的二氧化碳則有助于維持發酵體系的厭氧環境,為后期乳酸菌的生長創造了有利的環境[29]。然而,隨著發酵的進行,白酒發酵體系的酸度、乙醇濃度增加,含氧量降低,這些乳酸菌的生長受到了抑制而逐漸衰亡,直到消失,繼而出現更耐酸、耐高濃度乙醇、耐低含氧量的乳酸菌完成后續發酵過程[30]。在芽孢桿菌目(Bacillales)中芽孢桿菌屬(Bacillus)(0.27%~13.42%)和葡萄球菌屬(Staphylococcus)(0.06%~9.15%)的相對豐度在酒醅樣品T0中也顯著高于S0,前者的相對豐度在發酵前25天內都>1%。Kosakonia(0.01%~21.18%)和泛菌屬(Pantoea)(0.01%~10.78%)是腸桿菌目中的優勢代表,其中,泛菌屬在酒醅樣品S0中的相對豐度(10.78%)顯著高于T0(3.79%)。目前對泛菌屬的研究主要集中在醫療與疾病方面,在白酒中還少有報道。有研究表明,泛菌屬能夠有效降解鄰苯二甲酸酯[31],有助于控制白酒安全,但其對風味的具體影響還需繼續挖掘。除上述優勢細菌屬之外,其他優勢細菌屬還包括Proteiniphilum(0~4.69%)、假單胞菌屬(Pseudomonas)(0.02%~3.08%)、醋酸桿菌屬(Acetobacter)(0.01%~4.17%)、擬桿菌屬(Bacteroides)(0.05%~1.37%)、厭氧粘菌屬(Anaeromyxobacter)(0~1.72%)、Fermentimonas(0~1.88%)、Saccharofermentans(0~1.14%)、互營菌屬(Syntrophus)(0~1.07%)、黃桿菌屬(Flavobacterium)(0~1.48%)、Longilinea(0~2.9%)等。黃桿菌屬在土壤中廣泛發現,但是在白酒酒醅中極少被鑒定為優勢菌屬,其具有高產α-淀粉酶能力,有利于原料中淀粉的利用[32]。綜上,新、老窖池濃香型白酒發酵過程中酒醅細菌群落結構的演替較為相似。
2.3.2 真菌群落的多樣性及動態演替特征
在目和屬水平,新、老窖池濃香型白酒發酵過程中酒醅真菌群落的組成見圖5。

圖5 基于目水平(A)和屬水平(B)新、老窖池濃香型白酒發酵過程中酒醅真菌群落結構的動態變化Fig.5 Dynamic changes of fungal community structure in fermented grains during strong-flavor Baijiu fermentation in new and old pits based on order (A) and genus level (B)
由圖5A可知,真菌群落的演替特征主要表現為優勢類群散囊菌目(Eurotiales)向酵母菌目(Saccharomycetales)的過渡,且這種過渡演替的速率在新、老窖池濃香型白酒發酵過程中存在顯著差異。在新窖池組中,酵母菌目的相對豐度在7 d內從最初的30.58%上升至83.47%,對應的散囊菌目相對豐度從61.24%下降至8.75%。然而,相似過程在老窖池組中在發酵第25天才完成。除此之外,毛霉目(Mucorales)是發酵前期的優勢真菌目之一(5.24%~9.12%),并且在老窖池組中的相對豐度顯著高于新窖池組(P<0.05)。毛霉代謝形成亞油酸乙酯和油酸乙酯,亞油酸乙酯具有花果的香氣,使酒體結構更加豐滿,有研究表明,油酸乙酯是茅臺空杯香的主要物質,并且油酸乙酯也是鑒定不同窖齡白酒的重要標記物[33-34]。相反,絲孢酵母目(Trichosporonales)在新窖池組的相對豐度要普遍高于老窖池組,這可能就是新窖池的出酒率高于老窖池的主要原因。寡囊盤菌目(Thelebolales)在整個發酵階段含量比較少(相對豐度<0.5%),僅在老窖池組的中后期(45~70 d)短暫的成為優勢真菌目(4.35%~8.62%)。寡囊盤菌目與白酒相關性的研究十分少見,但在有關土壤的研究中發現其與纖維素降解密切相關[35]。
由圖5B可知,在新、老窖池濃香型白酒發酵過程中,哈薩克斯坦酵母屬(Kazachstania)(0.01%~79.33%)和釀酒酵母屬(Saccharomyces)(0~23.50%)是酵母的代表類群。在宜賓的濃香型白酒產區中發現的酵母代表類群除這兩類外,還包括拜氏接合酵母(Zygosaccharomyces bailii)與林生地霉(Geotrichum silvicola)[36]。在發酵前7 d時,哈薩克斯坦酵母屬經歷爆發式增長,另外老窖池組在發酵25~95 d時哈薩克斯坦酵母屬的相對豐度要明顯高于新窖池組。而釀酒酵母屬僅在新窖池組的發酵過程中占據優勢地位。已有研究表明,哈薩克斯坦酵母屬能夠在乳酸發酵過程中同化乳酸,并水解葡萄糖醛糖苷作為異型發酵乳酸菌的代謝底物,促進其利用果糖產乙酸[37],到目前為止,哈薩克斯坦酵母屬只有少數幾個種的代謝特性被表征。JOOD I等[38]研究發現,哈薩克斯坦酵母屬的部分菌種具有積極的風味特性,但其發酵力要弱于釀酒酵母(Saccharomyces)。初步推測這是新窖池的產酒量較高,而老窖風味更優的原因之一。曲霉屬(Aspergillus)(1.42%~41.20%)和嗜熱子囊菌屬(Thermoascus)(0.06%~37.06%)隨著發酵的進行持續下降,且在老池組的相對豐度普遍高于新窖池組。曲霉屬(Aspergillus)是諸多胞外酶(如淀粉酶和糖化酶)的主要貢獻者,參與大分子物質的降解代謝,有利于白酒發酵的進行[39]。此外,老窖池組中假散囊菌屬(Pseudeurotium)在發酵25~70 d呈現爆發式增長,相對豐度顯著高于新窖池組。Apiotrichum(0~4.81%)則在新窖池組發酵的25~95 d有明顯優勢,相對豐度高于老窖池組。其他優勢真菌屬還包括絲孢酵母(Trichosporon)(0.11%~4.08%)、青霉屬(Penicillium)(0~3.24%)、德巴利酵母屬(Debaryomyces)(0~7.54%)、復膜孢酵母屬(Saccharomycopsis)(0.01%~0.45%)、畢赤酵母(Pichia)(0.01%~1.46%)和Naumovozyma(0~1.97%)。之前有研究從冰葡萄汁中分離獲得德巴利酵母菌,并發現其對糖、SO2、乙醇和酸均有較強的耐受性,可作為冰酒釀造的菌株[40],另外德巴利酵母能發酵葡萄糖產D-阿拉伯糖醇顯著改善酒精飲品的品質[41],但其在白酒發酵的相關研究中少有報道,值得深入挖掘。綜上,新、老窖池濃香型白酒發酵過程中酒醅真菌群落結構的演替差異較大。
2.3.3 微生物間的相關性與穩定性分析
有研究表明,微生物代謝物的多樣化與其復雜多樣相互作用有關,而微生物間相互作用則與微生物的演替與多樣性相關[20]。采用基于Spearman等級相關性的共現性網絡分析評估新、老窖池組優勢微生物屬的相互作用關系,結果見圖6。由圖6可知,在新、老窖池組中分別得到62和56個有效的連接節點,以及158和234對穩定的相關關系。與新窖池組的網絡分析相比,老窖池組的微生物網絡具有更高的聚集程度,微生物群落的共存關系更加復雜,穩定性更高,并且細菌之間的聯系會比真菌更加緊密。另外發現同一種微生物在新、老窖池中表現出不同的相關性,如在新窖池中Aspergillus僅與Kazachstania呈現顯著相關性(P<0.05),但在老窖池中Aspergillus與Lactobacillus、Saccharomyces、Bacteroides等微生物均呈現顯著相關(P<0.05)。之前有研究表明,環境會影響微生物代謝從而改變微生物之間的相互作用[8]。窖池微生物群在窖池環境長時間的篩選下,不斷適應窖池環境,形成更加穩定的群落結構。

圖6 新(A)、老(B)窖池濃香型白酒發酵過程中酒醅優勢微生物屬網絡分析結果Fig.6 Network analysis results of dominant microbial genera in fermented grains during strong-flavor Baijiu fermentation in new (A) and old (B) pits
3 結論
本研究采用高通量測序技術分析酒醅的微生物群落演替與組成結構,結果發現,老窖池中酒醅樣品的細菌和真菌菌群多樣性較低,且細菌菌群多樣性的增長趨勢也要滯后于新窖池,而真菌菌群多樣性相反。新、老窖池酒醅樣品中的真菌群落組成及演替規律存在明顯差異,而細菌群落較為相似。老窖池酒醅樣品中,曲霉屬(Aspergillus)與哈薩克斯坦酵母屬(Kazachstania)的相對豐度更高,而在新窖池酒醅樣品中釀酒酵母(Saccharomyces)更具優勢。通過相關性網絡分析發現,隨著窖池使用時間的增加,窖池中酒醅的微生物互作網絡具有更高的聚集程度,微生物群落的共存關系也更加復雜,穩定性更高。后期研究中還需結合全基因組測序與代謝組學分析,進一步探究這些差異性菌株對濃香型白酒風味的影響機制,從而更好的為濃香型白酒的高質量發展提供科學依據。

