李渡特香型大曲層次間微生物群落結構與風味物質變化規律研究
杜姝穎,鮑文濤,吳立平,朱棟才,楊濤,李杰,李國城,任聰*,徐巖*
1(江南大學 生物工程學院,釀造微生物學與應用酶學研究室,江蘇 無錫,214122) 2(江西李渡酒業有限公司,江西 南昌,331725)
中國白酒的12種香型,包括濃香型、清香型、醬香型、米香型、豉香型、兼香型、鳳香型、藥香型、特香型、芝麻香型、老白干香型和馥郁香型,除米香型和豉香型外,其他10種完全或部分采用大曲為糖化劑和發酵劑,其大曲制作通常由整顆粒小麥或大麥直接壓制成曲,但特香型大曲的制作較為例外。特香型大曲以面粉和麥麩為主要原料,添加適量比例的酒糟提高大曲的酸度,具有含氮量高、選擇性接種環境中耐酸微生物的特點[1-2],這種特殊的制曲方式是特香型白酒風格形成的關鍵工藝。近年來,對于特香型大曲的研究主要集中在大曲理化指標檢測[3]、改變單一因素對大曲品質影響[4]等方面,但對于特香型大曲微生物種類及其數量變化規律的認識仍不清晰。
大曲按照制曲溫度可以分為高溫大曲(60 ℃以上)、中高溫大曲(50~59 ℃)、中溫大曲(45~50 ℃)[5],成品曲可分為曲皮、中層及曲心3個層次。大曲不同層次一般具有顯著不同的菌群結構,如醬香型高溫大曲中曲皮主要為乳桿菌目(Lactobacillales),核心主要為芽孢桿菌目(Bacillales),其中芽孢桿菌目細菌與吡嗪類等風味物質的形成密切相關[2]。濃香型高溫大曲不同層次具有不同的微生物結構,如中層富含庫德里阿茲威氏畢赤酵母(Pichiakudriavzevii)、扣囊復膜酵母(Saccharomycopsisfibuligera),可產生多種酯類、芳香族、酸類和醇類化合物,對濃香型大曲酒的風格起到重要作用[6]。特香型白酒制曲雖也采用了中高溫制曲工藝,但制曲原料較為獨特,其成品曲不同層次的微生物菌群結構和風味化合物特征尚未能完全解析。
本研究使用擴增子測序和頂空固相微萃取結合氣相色譜質譜技術(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS),從群落結構和風味物質兩方面闡述了特香型大曲3個層次微生物和揮發性風味物質的類型及變化規律,同時運用微生物溯源分析對大曲不同層次微生物的來源進行探索。本研究使用的絕對定量方法學、大曲層次分析方法,即細菌和真菌在大曲不同層次間的變化規律,對優化特香型制曲工藝,提升特香型白酒風味品質具有重要參考價值。
1 材料與方法
1.1 材料與試劑
1.1.1 樣品采集
1.1.1.1 大曲樣品的采集
大曲樣品收集于江西李渡酒業有限公司4個不同曲房的典型性中高溫大曲,其入庫時間分別為3、6、9、11月,從每個曲房隨機抽取3塊大曲。選取的大曲均含有典型的3個層次:大曲由外至內約0.5 cm厚區域定義為曲皮(DaquSurface),曲皮與曲心之間約0.5 cm深色區域定義為中層(DaquMiddle),中層以內約2 cm的曲中心區域定義為曲心(DaquCore)(圖1)。從每塊曲分別收集曲皮、中層、曲心3層樣品,每層5點取樣、粉碎、混合均勻后備用。

圖1 成品大曲剖面圖
1.1.1.2 環境及原料樣品的采集
環境樣品收集于江西李渡酒業有限公司制曲車間,選擇3個曲房。分別從曲房室內地面(ground)和室內屋頂(roof)2個位置收集,混合不同曲房的樣品備用。原料樣品從原料倉庫中隨機收集面粉(flour)、麥麩(wheat bran)和酒糟(fermented grains)樣品備用。
1.1.2 試劑
DNA提取液、核酸提取液、2-辛醇標準品,北京索萊寶科技有限公司;無水乙醇、氯化鈉等,國藥集團化學試劑有限公司;磷酸鹽緩沖液速溶顆粒,南京諾唯贊生物科技股份有限公司。
1.2 儀器與設備
NanoDrop蛋白核酸測定分光光度計,Thermo FisherScientific公司;高速冷凍離心機,Eppendorf公司;Illumina MiSeq PE300測序平臺,Illumina公司。
1.3 實驗方法
1.3.1 揮發性化合物測定
采用HS-SPME-GC-MS分析樣品中的揮發性風味物質,5 g大曲和10 μL 2-辛醇(31.31 mg/L)混合作為內標,詳細測定方法見JI等[7]。
1.3.2 核酸提取、16S rRNA基因擴增子和ITS擴增子測序
所有樣品均用0.1 mol/L的PBS處理,30×g離心5 min,重復3次,然后將上清液再次以9 000×g離心3 min,重復3次,使用DNA提取液[V(苯酚)∶V(氯仿)∶V(異戊醇)=25∶24∶1]和核酸提取液[V(氯仿)∶V(異戊醇)=24∶1]提取基因組DNA。分別使用515FmodF(5′-GTGYCAGCMGCCGCGGTAA-3′)、806RmodR(5′-GCATCG-ATGAAGAACGCAGC-3′)和ITS3(5′-GGACTACNVGGGTWTCTAAT-3′)、ITS4(5′-TCCTCCGCTTATTGATATGC-3′)對細菌16S rRNA基因V4區和真菌ITS2區進行PCR擴增。利用Illumina公司的Miseq PE300平臺對細菌和真菌序列進行測序分析(上海美吉生物醫藥科技有限公司)。
1.3.3 細菌總數的絕對定量
在使用PBS處理所有樣品前,添加已知數量的丙酮丁醇梭菌營養體細胞,每克大曲和原料樣品中添加1.368×108個內標菌,每克環境樣品中添加2.28×107個內標菌。
1.4 生物信息學分析
通過美吉生信云內置的QIIME1.9等分析工具處理擴增子測序數據,去除質量較差和含嵌合體的序列,并將相似度大于97%的序列聚類為1個操作分類單元(operational taxonomic unit,OTU)。統計分析采用t-檢驗,P<0.05為有統計學差異(*),P<0.01為有顯著統計學差異(**),P<0.001為有極其顯著的統計學差異(***)。Spearman相關系數用于分析微生物和代謝物之間的相關性,使用Gephi(0.9.1)進行關聯網絡可視化。
2 結果與分析
2.1 特香型成品大曲中不同層次的細菌群落組成與變化規律
在特香型大曲所有樣品中共檢測到50個細菌目,其中豐度較高的細菌目(平均相對豐度>1%)主要包括乳桿菌目(Lactobacillales,平均值26.58%,分布范圍5.55%~86.45%)、假諾卡氏菌目(Pseudonocardiales,平均值26.08%,分布范圍0.03%~87.33%)、腸桿菌目(Enterobacterales,平均值26.78%,分布范圍0.03%~81.95%)、高溫放線菌目(Thermoactinomycetales,平均值5.88%,分布范圍0.00%~47.16%)、芽孢桿菌目(Bacillales,平均值5.25%,分布范圍0.04%~23.79%)、葡萄球菌目(Staphylococcales,平均值2.66%,分布范圍0.11%~10.50%)、立克次氏體目(Rickettsiales,平均值2.26%,分布范圍0.03%~19.20%)和微球菌目(Micrococcales,平均值1.65%,分布范圍0.00%~9.55%)。
如圖2所示,曲皮的優勢細菌目分別是乳桿菌目(Lactobacillales)和腸桿菌目(Enterobacterales),其相對比例分別是45.34%(分布范圍6.26%~86.81%)和35.61%(分布范圍3.20%~67.36%)。隨著大曲層次的深入,假諾卡氏菌目(Pseudonocardiales)成為中層中豐度最高的微生物,相對比例為39.20%(分布范圍1.85%~87.34%);乳桿菌目(Lactobacillales)和腸桿菌目(Enterobacterales)的相對比例的平均值與曲皮比降低了23.84%和7.93%。而曲心中,相對豐度最高的細菌為假諾卡氏菌目(Pseudonocardiales)、腸桿菌目(Enterobacterales)和高溫放線菌目(Thermoactinomycetales),其相對豐度分別為35.63%(分布范圍0.39%~70.25%)、17.37%(分布范圍0.03%~82.62%)和16.55%(分布范圍0.08%~47.17%)。特別值得注意的是,高溫放線菌目(Thermoactinomycetales)的相對豐度在曲皮的含量極低,僅約0.03%(分布范圍0.00%~0.09%),而在曲心的含量顯著增加(P<0.01),相對豐度增加到16.55%(分布范圍0.08%~47.17%)。
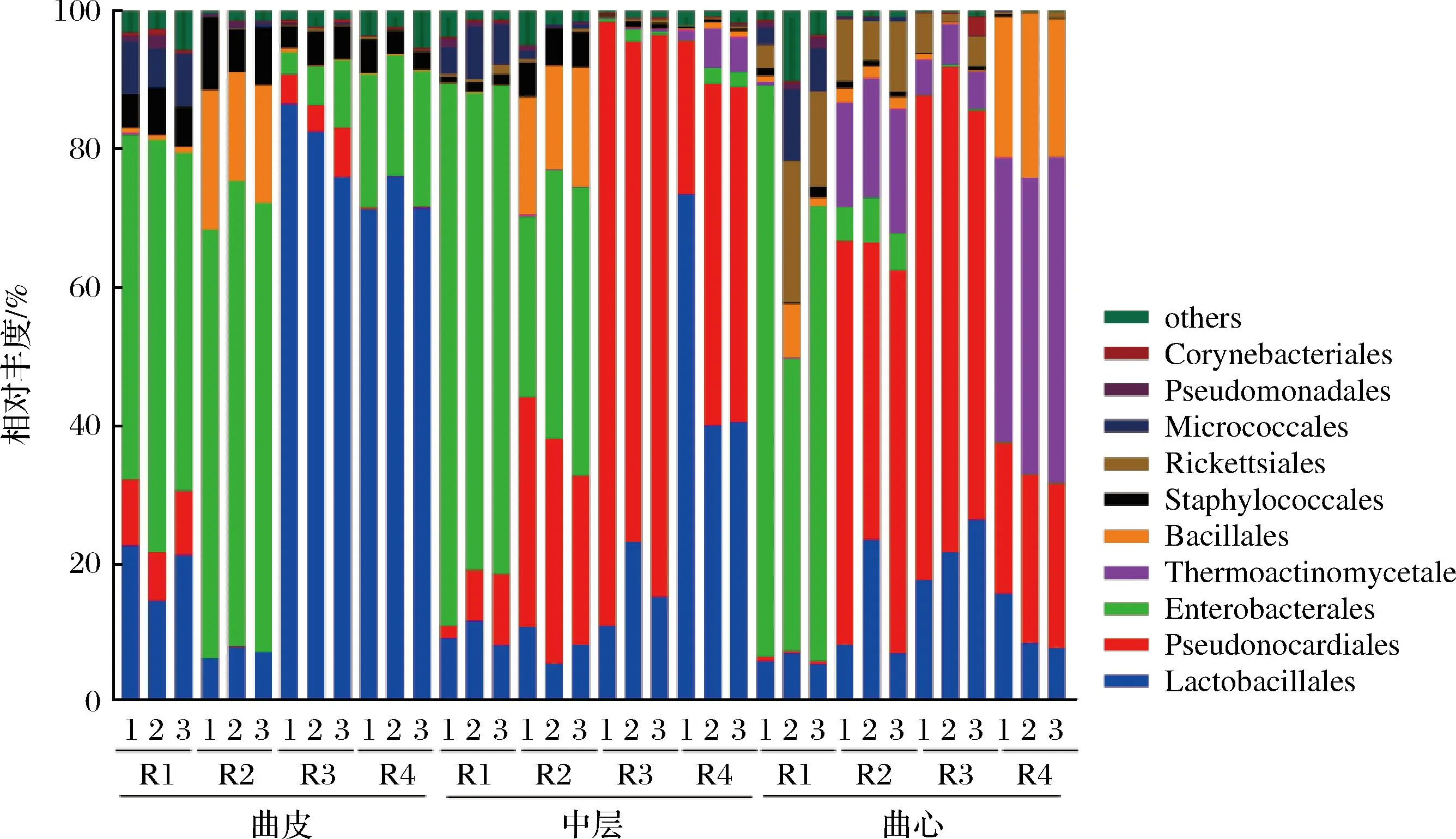
圖2 不同層次大曲中細菌組成
在所有大曲樣品中共檢測到103個細菌屬,基于已知數量內標菌添加的絕對定量方法來比較大曲3個層次之間的細菌微生物的總生物量(圖3-a)。曲皮與中層的平均總生物量分別為(3.69±2.06)×108、(3.84±1.39)×108個/g,無顯著差異。而曲心的總生物量[20.3×±8.47)×107個/g]相較于曲皮和中層分別降低了44.98%和47.13%(P<0.05)。在大曲發酵過程中,曲心部分的溫度最高[8],推測高溫是導致曲心中總生物量低的主要原因之一。
糖多孢菌屬(Saccharopolyspora)屬于假諾卡氏菌目(Pseudonocardiales),在大曲中層中的生物量顯著高于曲皮(圖3-b),在中層的含量[(8.37±11.8)×107個/g]為曲皮[(3.47±3.66)×106個/g]的24.14倍。有研究報道,糖多孢菌屬(Saccharopolyspora)是小麥曲微生物中占主導地位,可產生酶、維生素、纖維素降解促進因子[9]。魏斯氏菌屬(Weissella)、乳桿菌屬(Lactobacillus)和腸桿菌屬(Enterobacter)均為產乳酸菌類群,此類菌屬在發酵過程中生產的乳酸與乙醇被酯化生成風味物質乳酸乙酯[10]。雖然這三類菌為兼性厭氧菌或耐氧菌,其生長不依賴于氧氣的供給,但由圖3-c~圖3-e可知,這三類菌屬均在曲心中測定出的生物量最低。魏斯氏菌屬(Weissella)在曲心的含量[(1.48±1.35)×107個/g]為曲皮含量[(4.79±4.40)×107個/g]的30.88%;乳桿菌屬(Lactobacillus)在曲心的含量[(3.51±4.74)×106個/g]為曲皮含量[(3.84±3.14)×107個/g]的9.15%;腸桿菌屬(Enterobacter)在曲心的含量[(4.08±4.30)×106個/g]為曲皮含量[(1.06±1.32)×108個/g]的3.86%。這表明溫度可能為這三類產乳酸細菌生長的限制因素[11]。高溫放線菌屬(Thermoactinomyces)和芽孢桿菌屬(Bacillus)在其他研究中被認為高溫[(66±1) ℃]有利于菌株生長[12]。根據絕對定量的結果(圖3-f、圖3-g),高溫放線菌屬(Thermoactinomyces)在發酵溫度最高的曲心含量[(2.95×±3.56)×107個/g],為中層含量[(1.59×±2.23)×106個/g]的18.49倍,為曲皮含量[(4.23±5.36)×104個/g]的695.96倍。然而,芽孢桿菌屬(Bacillus)的生物量卻沒有觀察到從曲皮到曲心的顯著梯度變化趨勢。這可能與高溫放線菌屬(Thermoactinomyces)是嗜熱微生物有關,最適生長溫度在60~80 ℃[13],因其獨特的胞外酶結構導致這類微生物趨向在高溫中生存[14]。芽孢桿菌屬(Bacillus)微生物多為耐高溫細菌,可以耐受高溫環境但最適生長溫度為28~37 ℃,同時芽孢桿菌屬(Bacillus)是在有氧條件下生長更為旺盛的兼性厭氧微生物,大曲曲皮的氧含量高于曲心,從另一角度解釋了曲皮中芽孢桿菌屬(Bacillus)含量最高[(2.59±4.42)×107個/g][15]。
2.2 特香型大曲中不同層次的真菌群落組成與變化規律
在所有大曲樣品中共檢測到78個真菌屬,其中酵母主要包括伊薩酵母屬(Issatchenkia,平均值21.10%,分布范圍0.06%~97.56%)、絲孢畢赤酵母屬(Hyphopichia,平均值3.9%,分布范圍0.00%~19.96%)、假絲酵母屬(Candida,平均值3.27%,分布范圍0.00%~26.20%)等;霉菌主要包括曲霉屬(Aspergillus,平均值43.63%,分布范圍0.06%~97.56%)、根毛霉屬(Rhizomucor,平均值4.00%,分布范圍0.00%~30.42%)、橫梗霉屬(Lichtheimia,平均值2.63%,分布范圍0.04%~23.32%)等(圖4)。
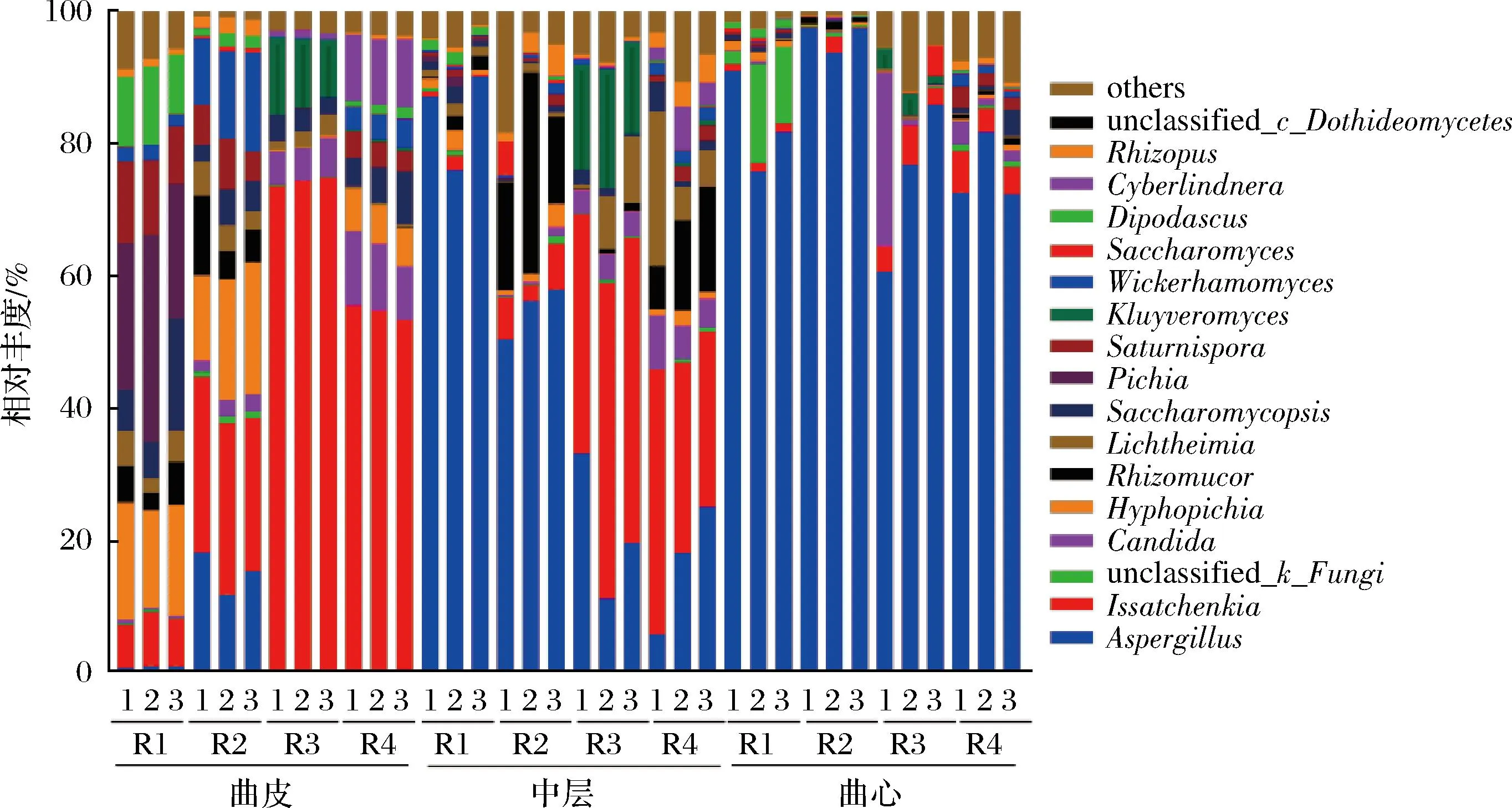
圖4 不同層次大曲中真菌組成
見如表1所示,酵母主要分布在曲皮和中層,曲心的酵母含量相對較低,如Issatchenkia、Hyphopichia、Saccharomycopsis、Pichia、Saturnispora、Wickerhamomyces和Cyberlindnera從曲皮到曲心呈現出降低趨勢。伊薩酵母屬(Issatchenkia)為曲皮的主要酵母類型,占真菌的40.19%(分布范圍6.59%~74.56%)。與絲狀真菌的分布情況不同,以伊薩酵母屬(Issatchenkia)和絲孢畢赤酵母屬(Hyphopichia)為主的酵母在曲皮中總平均豐度為50.11%(分布范圍22.94%~74.80%),顯著高于中層(平均值21.61%,分布范圍0.97%~47.84%,P<0.01)和曲心(平均值3.27%,分布范圍0.29%~6.77%,P<0.001)。
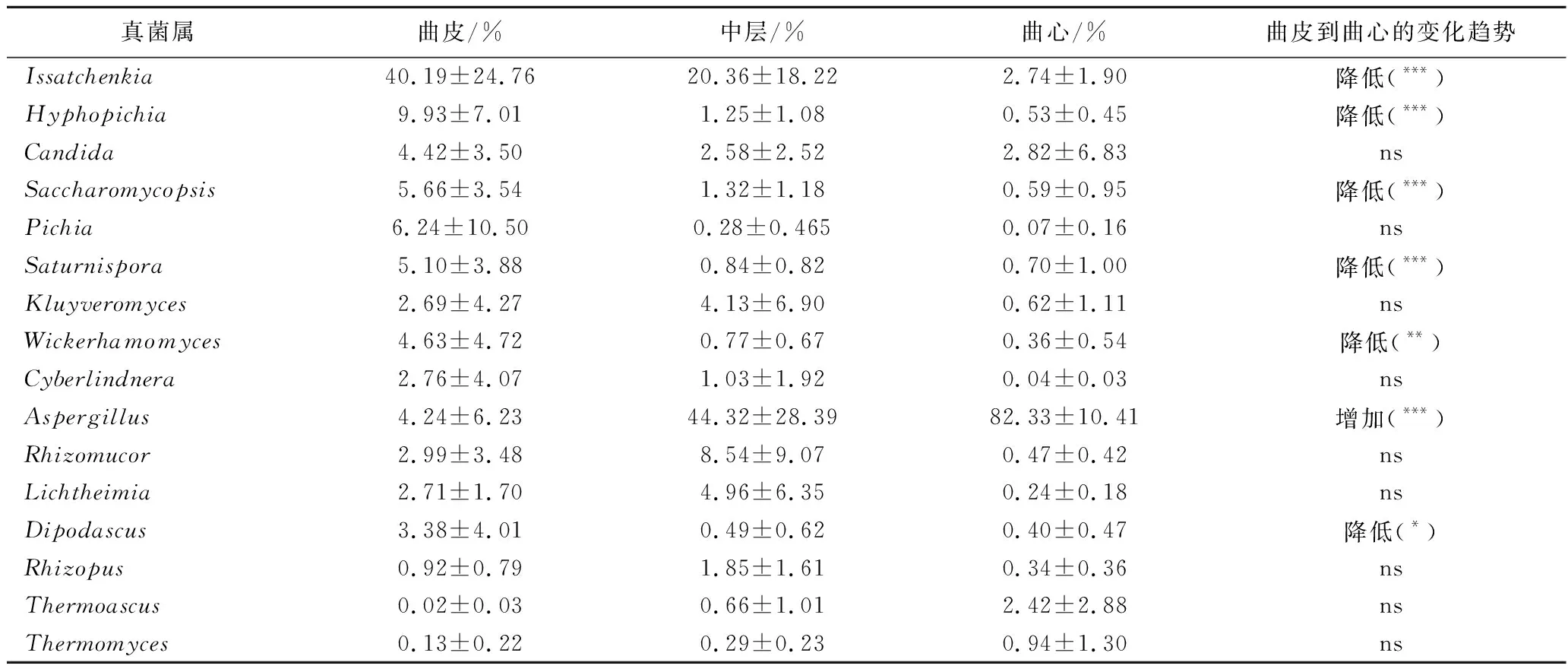
表1 成品大曲主要真菌在屬水平的相對豐度變化Table 1 The changes of relative abundance of dominant fungi in mature Daqu at genus level
與上述大部分酵母的層次分布不同,多種霉菌的層次分布顯現出與酵母相反的變化趨勢。曲霉屬(Aspergillus)為各層次豐度最高的霉菌,在曲心占比為82.33%(分布范圍72.41%~97.48%),為中層(平均占比44.32%,分布范圍5.84%~90.22%)和曲皮(平均占比4.24%,分布范圍0.06%~18.27%)的1.86倍和19.42倍(P<0.001)。
特香型大曲曲心中曲霉屬(Aspergillus)比例高于酵母,可能原因在于曲霉菌絲體更容易在大曲深層基質中進行生長;而酵母的生長受到溫度的限制,主要在淺層大曲基質中進行生長繁殖。
2.3 特香型大曲優勢微生物的溯源分析
擴增子測序在所有樣品(大曲、原料及環境樣品)中共檢測到220個細菌屬和118個真菌屬。大曲3個層次樣品共檢測到103個細菌屬和78個真菌屬,其中72個細菌屬和62個真菌屬可在制曲原料或環境樣品中能檢測到。
為了進一步分析大曲不同層次間微生物群落,本研究將大曲、原料及環境樣品中相對豐度>0.5%的屬定義為優勢細菌屬,得到其屬水平信息(圖5-a)。圖5-a顯示,所有樣品中的細菌主要歸屬于17個屬,且大曲、原料和環境中占據主要比例的細菌幾乎均不同。原料中面粉檢測到的細菌以魏斯氏菌屬(Weissella,平均值47.23%,分布范圍41.64%~51.29%)為主;在麥麩中檢測到的細菌腸桿菌屬(Enterobacter,平均值20.31%,分布范圍16.15%~23.43%)的豐度最高;酒糟檢測到的細菌屬主要為芽孢桿菌屬(Bacillus,平均值13.41%,分布范圍7.03%~19.96%)。而環境樣品中室內地面和室內屋頂中檢測到豐度最高的細菌分別是糖多孢菌屬(Saccharopolyspora,12.21%)和Inquilinus(38.85%)。而大曲主要細菌屬為糖多孢菌屬(Saccharopolyspora)、腸桿菌屬(Enterobacter)、魏斯氏菌屬(Weissella)、乳桿菌屬(Lactobacillus)、高溫放線菌屬(Thermoactinomyces)等。
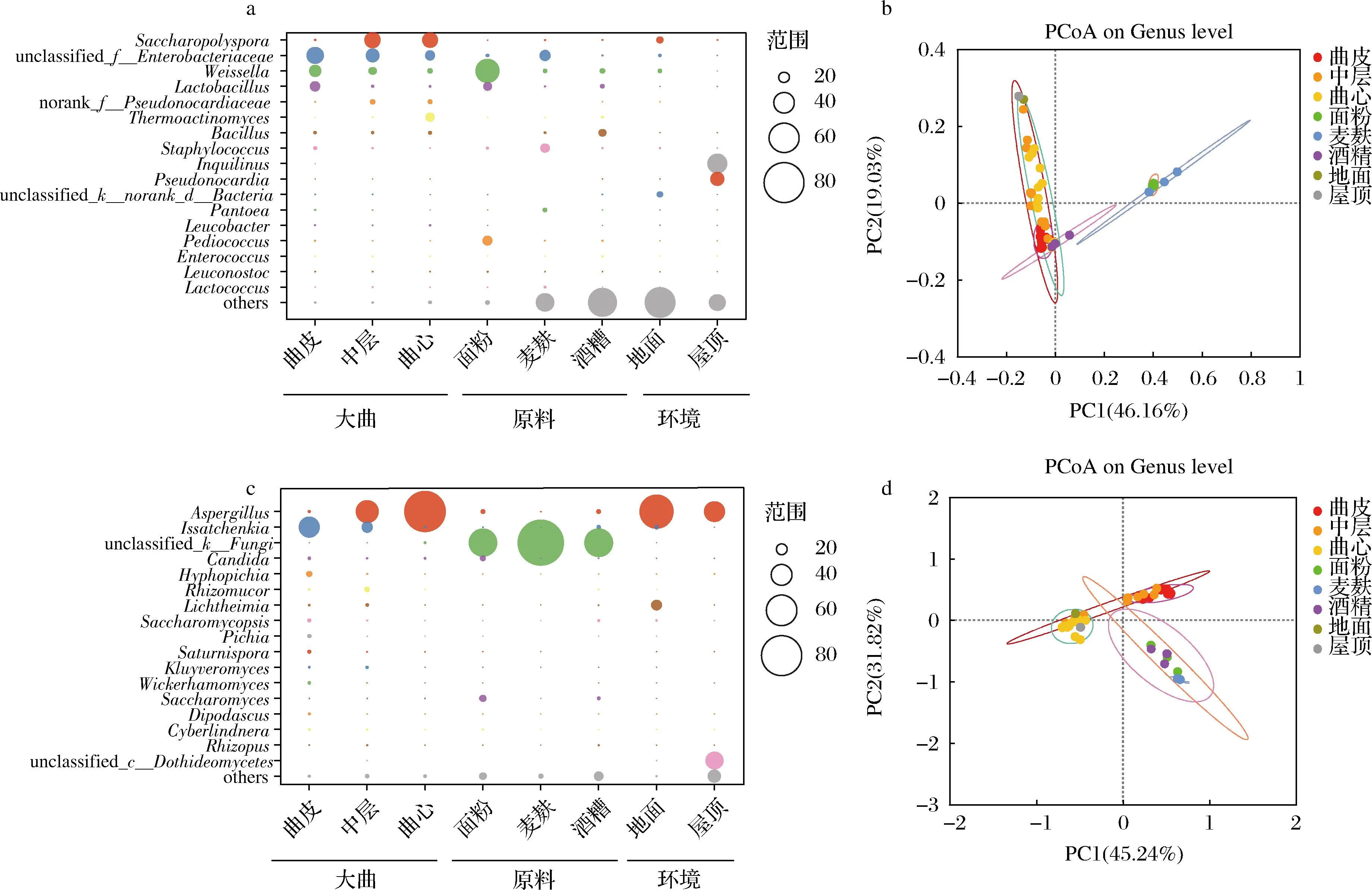
a-屬水平大曲優勢細菌分布(平均豐度>0.5%);b-基于weighted UniFrac距離的細菌主坐標分析(principal coordinate analysis,PCoA);c-屬水平大曲優勢真菌分布(平均豐度>0.8%);d-基于weighted UniFrac距離的真菌主坐標分析(PCoA)圖5 大曲、原料及環境樣品微生物群落結構
根據上述豐度信息,可以推測大曲中優勢細菌屬來源:糖多孢菌屬(Saccharopolyspora)部分來源于室內地面,腸桿菌屬(Enterobacter)和葡萄球菌屬(Staphylococcus)主要由麥麩帶入,魏斯氏菌屬(Weissella)、乳桿菌屬(Lactobacillus)和片球菌屬(Pediococcus)等乳酸菌主要來源于面粉,芽孢桿菌屬(Bacillus)主要來源于酒糟和麥麩,而室內屋頂檢測出的細菌并未大量進入大曲制作過程。
在真菌方面,本研究將大曲、原料及環境樣品中相對豐度>0.8%的屬定義為優勢真菌屬(圖5-c)。由圖5-c可知,3種原料樣品中的真菌以未鑒定出的真菌(unclassified_k__Fungi)為主,分別占55.40%(分布范圍31.79%~81.71%)、92.00%(分布范圍89.07%~93.70%)和55.88%(分布范圍48.02%~64.90%),表明擴增子測序技術對真菌的判定分辨率較為有限。環境樣品中室內地面和室內屋頂中均以曲霉屬(Aspergillus)為主,相對豐度分別為67.54%和40.27%。大曲中的曲霉屬(Aspergillus)來源于室內環境(包括地面和屋頂),橫梗霉屬(Lichtheimia)則主要由發酵室內地面提供。伊薩酵母屬(Issatchenkia)主要來源于酒糟和室內地面。面粉為制曲過程提供了假絲酵母屬(Candida)和酵母屬(Saccharomyces)。而麥麩中的主要真菌(unclassified_k__Fungi,未能鑒定到屬水平,界水平為fungi)并未在大曲中檢出。
為了更直觀地說明大曲與原料及環境中微生物的關系,基于weighted UniFrac 距離的主坐標分析(principal coordinate analysis,PCoA)進一步表征它們之間的關系(圖5-b和圖5-d):曲皮與制曲原料的細菌群落距離較近,中層與制曲環境的細菌群落較近;曲心與制曲環境的真菌群落較近,而制曲原料與其他樣品真菌群落距離較遠。綜上,特香型大曲的細菌主要來源于制曲原料,而真菌主要來源于制曲環境。本研究的結果與DU等[16]、周天慈等[10]對濃香型大曲溯源結果一致,中高溫大曲的制造環境是大曲真菌群落的主要來源,而原料則是細菌群落的主要來源。
2.4 特香型大曲不同層次風味物質含量比較分析
運用HS-SPME-GC-MS技術,在特香型大曲中共檢測到80種揮發性化合物。將主要化合物分為五類,包括24種醇類、14種醛酮類、9種吡嗪類、10種醚酚類和5種酯類。根據各類化合物的濃度繪制柱狀圖(圖6-a),曲心中醇類、醛酮類、吡嗪類和醚酚類的總含量均大于曲皮和中層(P<0.001),中層中醇類和醛酮類化合物的總含量比曲皮中的有極其顯著增加(P<0.001)。曲心的醇類含量(0.65±0.01) μg/g是中層含量(0.54±0.01) μg/g的1.20倍,是曲皮含量(0.43±0.01) μg/g的1.52倍。曲心的醛酮類含量(0.65±0.02) μg/g是中層含量(0.48±0.02) μg/g的1.37倍,是曲皮含量(0.31±0.01) μg/g的2.07倍。曲心的吡嗪類含量(0.22±0.01) μg/g是中層含量(0.16±0.01) μg/g的1.36倍,是曲皮含量(0.16±0.01) μg/g的1.33倍。曲心的醚酚類含量(0.46±0.03) μg/g是中層含量(0.13±0.01) μg/g的3.43倍,是曲皮含量(0.12±0.01) μg/g的3.81倍。而對于吡嗪類和醚酚類風味物質,曲皮和中層的含量差異較小,吡嗪類含量分別為(0.16±0.01)、(0.16±0.01) μg/g,醚酚類含量分別為(0.12±0.01)、(0.13±0.01) μg/g。酯類化合物與其他化合物顯示出了不同的分布情況,曲皮中酯類含量(0.07±0.01) μg/g是曲心含量(0.04±0.001) μg/g的1.62倍(P<0.05)。
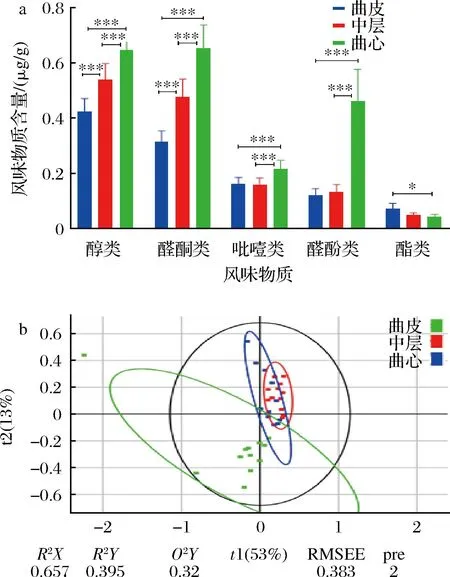
a-大曲中主要風味物質的相對含量;b-風味物質PLS-DA評分圖圖6 成品大曲不同層次的風味物質分析
利用偏最小二乘法判別分析(partial least squares discriminant analysis,PLS-DA)分析特香型大曲3個層次的風味物質組成的相似性,PLS-DA評分圖(圖6-b)顯示,曲心點較為分散,與曲皮和中層點相差較遠,這推測是由于曲心風味物質含量差異與曲皮和中層較大導致,而曲皮和中層距離較近,存在部分重疊。風味物質含量和相關性分析表明,曲心的風味物質含量特征顯著不同于曲皮和中層,推測曲心的高豐度微生物(如高溫放線菌屬)對曲心風味物質的形成具有重要作用。
利用Spearman相關系數分析大曲中微生物與主要風味物質間的相互作用(圖7)。由圖7可知,醇類和吡嗪類物質與高溫放線菌屬(Thermoactinomyces)和曲霉屬(Aspergillus)呈顯著正相關,與酵母呈負相關;酯類物質與以伊薩酵母屬(Issatchenkia)、絲孢畢赤酵母屬(Hyphopichia)和復膜孢酵母屬(Saccharomycopsis)為主的酵母呈顯著正相關,與高溫放線菌屬(Thermoactinomyces)和曲霉屬(Aspergillus)呈顯著負相關。根據之前的研究,高溫放線菌屬(Thermoactinomyces)可產生多種耐高溫酶系[15],包括α-淀粉酶、蛋白酶等,可促進蛋白降解產生多種氨基酸,為美拉德反應提供前體物質,對大曲風味物質的形成可能具有重要作用。此外,高溫放線菌形態雖與放線菌綱微生物(Actinomycetia)類似,但在分類學上卻屬于芽孢桿菌綱(Bacilli),而芽孢桿菌類群是重要的吡嗪合成微生物,是解析高溫放線菌對吡嗪產生呈正相關的科學依據。而以伊薩酵母屬(Issatchenkia)、絲孢畢赤酵母屬(Hyphopichia)為主的酵母被證明與香氣化合物,尤其是大多數酯類化合物呈顯著正相關[17],也與上述分析結果基本一致。
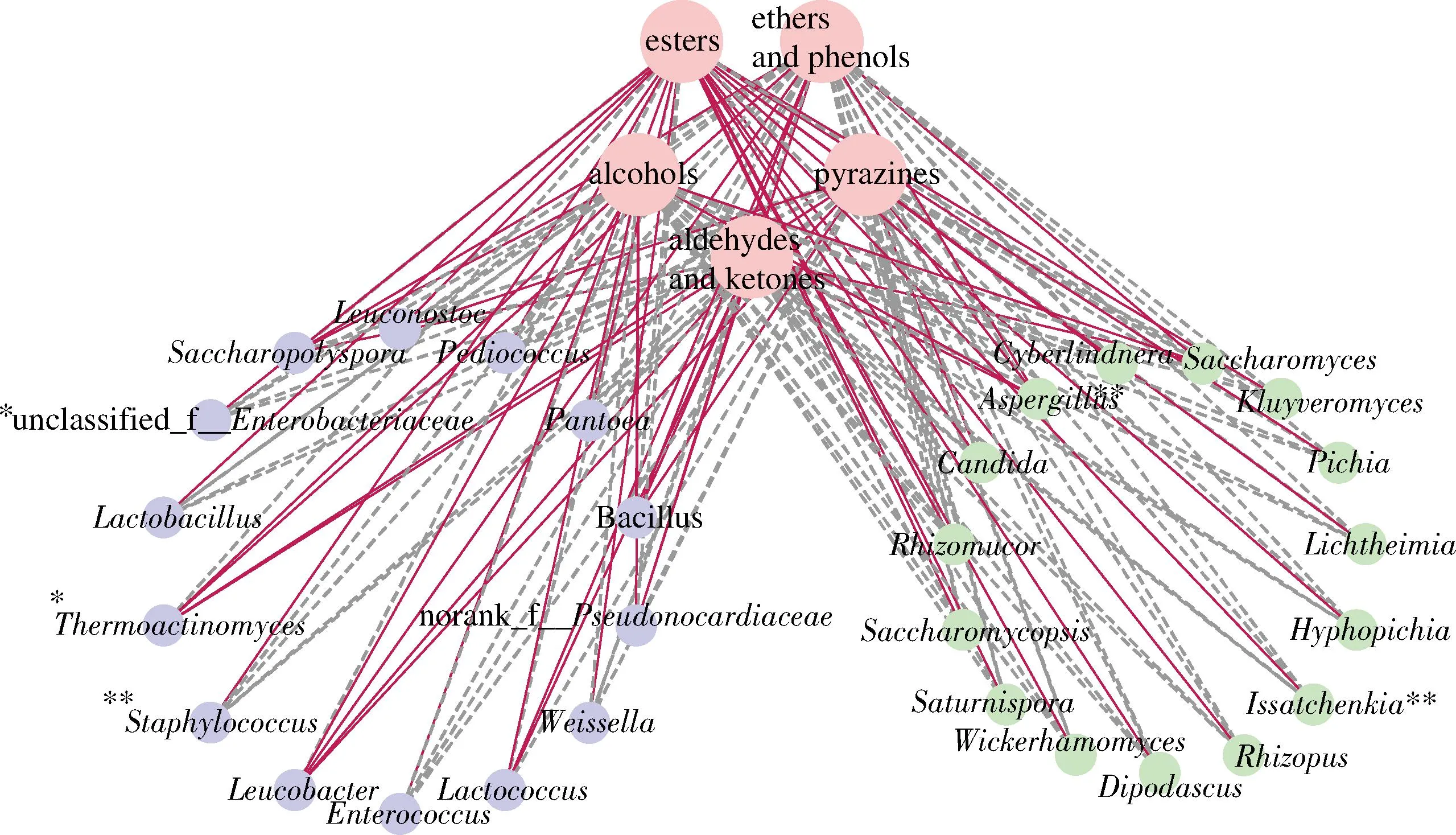
圖7 大曲微生物群落與風味物質的相關性分析
3 結論與討論
本研究采用擴增子測序技術和HS-SPME-GC-MS分別揭示了特香型大曲3個層次的微生物量比關系和揮發性風味物質含量特征。結果表明,曲心的細菌總生物量為曲皮和中層的50%左右。不同層次大曲樣品的細菌和真菌群落結構差異均顯著不同,魏斯氏菌屬、乳桿菌屬和腸桿菌屬為曲皮的主要細菌類型,高溫放線菌屬為曲心的絕對優勢細菌,而糖多孢菌屬在中層和曲心含量遠高于曲皮。伊薩酵母屬和絲孢畢赤酵母屬為曲皮的主要酵母,曲霉屬為曲心的優勢霉菌。風味物質分析結果表明,曲心的醇類、醛酮類、吡嗪類和醚酚類的總含量均高于曲皮和中層,而曲皮的酯類的總含量高于曲心。微生物溯源分析表明成品曲的細菌主要來源于制曲原料,而真菌主要來源于制曲環境。
特香型大曲與濃香型大曲同為中高溫大曲,本研究的特香型大曲曲心和濃香型包包曲均具有較高豐度的高溫放線菌屬微生物[18]。中高溫大曲的曲心微生物組成與醬香型釀造用的高溫大曲微生物組成具有一定的相似性,如高溫放線菌屬微生物起著關鍵作用[19]。對于真菌而言,本研究與DU等[16]、周天慈等[10]發現制曲環境為真菌的主要來源,環境和制曲工藝(溫度、水分)等對中高溫大曲的真菌組成具有較大的影響,如張倩等[18]報道濃香型包包曲的曲皮和曲心均含有較高豐度的嗜熱子囊菌屬,而周天慈等[6]報道平板中高溫大曲的主要真菌為曲霉屬和根霉屬。清香型大曲因制曲溫度的原因,曲心的細菌微生物多樣性相比特香型大曲曲心的豐富度較低[20],曲皮的優勢真菌為復膜孢酵母屬,曲心的曲霉屬相對比例顯著增加[21]。可見,原料、制曲工藝、環境對大曲微生物組成均具有較大影響。
綜上,本研究解析了特香型大曲不同層次細菌和真菌及揮發性風味物質隨層次的變化規律,結果表明曲心優勢微生物(如高溫放線菌屬)的有效生長對大曲質量可能具有重要的影響,為優化特香型制曲工藝,進而運用生態發酵技術提升大曲品質提供了參考。

