不同位置窖泥酶活力及其細菌群落結構相關性分析
曾波,蒲吉洲,陳秋旭,饒家權,鄒永芳,文靜,黃治國,3,衛春會,3*
1(四川輕化工大學,釀酒生物技術及應用四川省重點實驗室,四川 宜賓,644000) 2(舍得酒業股份有限公司,四川 射洪,629000) 3(中國輕工業釀酒生物技術及智能制造重點實驗室,四川 宜賓,644000)
中國白酒以糧谷為主要原料,以大曲、小曲、麩曲、酶制劑及酵母等為糖化發酵劑,經蒸煮、糖化、發酵、蒸餾、陳釀、勾調而成的蒸餾酒[1]。長期以來,泥窖被用作為發酵濃香型白酒的反應器,窖泥在長期發酵過程中形成了復雜的生態系統,構建了特殊的微生態結構[2]。酶是具有生物催化能力的高分子蛋白質活性物質,是由窖泥微生物代謝過程中產生,在窖泥氮、磷等循環中起關鍵作用,同時還參與有機物的分解轉化[3]。窖泥中脲酶與蛋白酶是參與氮循環的關鍵酶,在有機氮轉化為無機氮的過程中發揮極其重要的作用[4],其中脲酶能夠將有機氮水解成氨[5],蛋白酶將蛋白質與肽類物質分解為氨基酸,提供微生物能夠利用的無機氮,因此蛋白酶和脲酶的活性直接影響著窖泥中氮轉化的強度和供氮能力[6]。過氧化氫酶、脫氫酶能夠促進窖泥中木質素的降解、蔗糖的水解、纖維素的分解、腐殖質的形成,促進窖泥微生物的物質循環,磷酸酶參與有機磷酸鹽的水解[7]。窖泥微生物對酒質的影響是通過酶促反應實現的,已有研究表明酶活性的高低可以反映土壤微生物活性和功能的變化,也可以作為評價窖泥質量的重要指標[8]。因此研究不同位置窖泥酶活力及其細菌群落結構的相關性對于探究窖泥中氮素轉化具有重要意義。
酶活力可以反映窖泥中氮代謝的強度,其活性大小不僅受窖泥品質、微生物活性的影響,還與窖泥的空間位置密切相關。吳樹坤等[9]分析不同品質濃香型白酒窖泥與微生物群落的相關性,結果表明不同品質窖泥的酶活與微生物群落結構呈一定的規律性。微生物群落與酶活力是影響窖泥物質循環的重要因素,WANG等[10]發現氮是調控微生物群落與酶活力的重要因素,氮素轉化也是窖泥中重要的代謝過程。張淼等[11]針對黑土區農田土壤的研究結果表明,除了理化因子,地理距離對土壤氮循環中關鍵過程微生物分布產生重要影響。目前關于窖泥的研究多是微生物結構解析,而研究不同位置窖泥細菌群落與酶活力的相關性、參與氮循環關鍵酶的差異性報道較少。
本研究以四川濃香型酒廠發酵正常窖池不同位置的窖泥作為樣品,通過高通量測序技術獲得窖泥微生物信息并測得窖泥理化數據及酶活力,使用聚類分析、冗余分析、相關性分析研究窖泥理化性質、細菌群落、氮循環中關鍵酶的差異性,試圖揭示不同位置窖泥微生物對濃香型白酒發酵的影響,為進一步提高白酒風味品質提供方向。
1 材料與方法
1.1 實驗材料
1.1.1 樣品采集
樣品取自四川某濃香型白酒窖池的窖泥,取樣點如圖1所示,從距離窖沿30 cm處的四面窖壁中心點取樣混合,作為窖壁上層窖泥(wall top mud,WT);從距離窖底120 cm處的四面窖壁中心點取樣混合,作為窖壁中層窖泥(wall middle,WM);窖底采用五點取樣法,以窖底平面,在窖底確定對角線的中點作為中心抽樣點,再在對角線上選擇4個與中心樣點距離相等的點作為樣點,作為窖底窖泥(bottom mud,BM)。每個樣品取3口窖池,分別命名為WT1~WT3,WM1~WM3,BM1~BM3,將每個窖泥樣品取出混勻后分成2份裝入無菌袋并冷藏,快速送回實驗室,貯存在4 ℃冰箱和-80 ℃冰箱,分別用于檢測理化指標和窖泥DNA的提取。
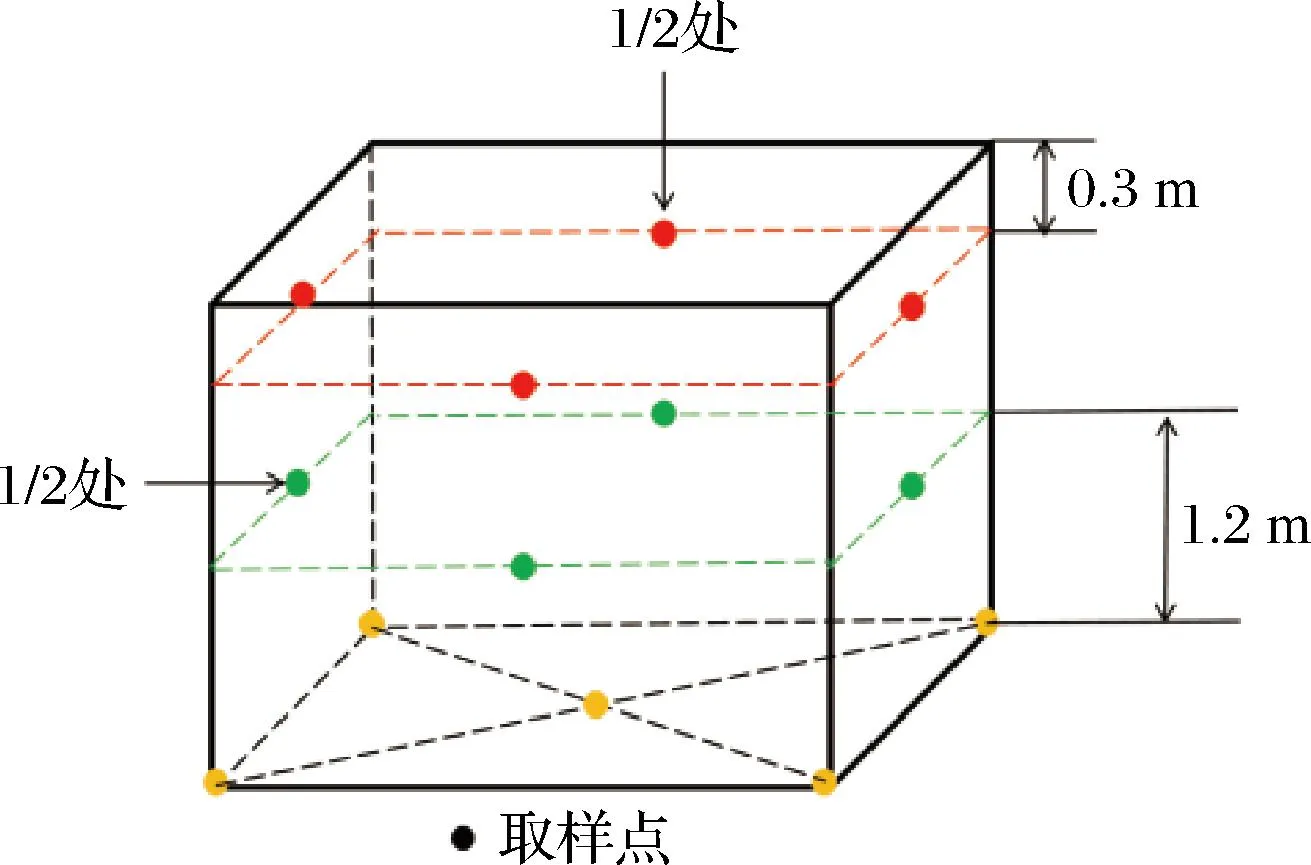
圖1 窖泥的取樣位置
1.1.2 試劑與儀器
E.Z.N.A.?soil試劑盒,上海晶諾生物科技有限公司;碘化汞、碘化鉀、氫氧化鈉、酒石酸鉀鈉、氯化銨、氟化銨、鹽酸、鉬酸銨、磷酸二氫鉀、氯化亞錫、檸檬酸、苯酚鈉、次氯酸鈉、福林試劑、碳酸鈉、三氯乙酸、磷酸苯二鈉、硫酸、高錳酸鉀、氯化三苯基四氮唑、連二亞硫酸鈉,以上均為分析純,成都市科隆化學品有限公司;UV-2400紫外分光光度計,上海尤尼柯儀器有限公司;PCR儀、電泳儀,美國Bio-Rad公司;高速冷凍離心機,德國Hettich公司;NanoDrop2000 DNA含量測定儀,美國Illumina公司。
1.2 實驗方法
1.2.1 窖泥理化與酶活檢測方法
pH值、酸性磷酸酶活力(acid phosphatase,ACP)、脲酶活力(urease,N_U)、過氧化氫酶(catalase,CAT)、蛋白酶(protease,D_U)、脫氫酶(dehydrogenase,T_U)用新鮮的窖泥測定,銨態氮含量(ammonium nitrogen content,A_N)、有效磷含量(available phosphorus content,P)用風干的窖泥測定,納氏試劑比色法測定銨態氮含量;氟化銨-鹽酸比色法測定有效磷含量[12];靛酚比色法測定脲酶活性;茚三酮比色法測定蛋白酶活性;苯磷酸二鈉比色法測定酸性磷酸酶活性;容量法測定過氧化氫酶活性;氯化三苯基四氮唑法測定脫氫酶活力,5種酶活的具體檢測步驟參考吳樹坤等[9]。
1.2.2 窖泥總DNA的提取
根據E.Z.N.A.?soil試劑盒說明書進行總DNA提取,DNA濃度和純度利用NanoDrop2000進行檢測,同時利用質量分數為1%的瓊脂糖凝膠電泳檢測DNA提取質量。
1.2.3 PCR擴增
用338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)引物對V3~V4可變區進行PCR擴增,擴增程序為:95 ℃預變性3 min,27個循環(95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸30 s),最后72 ℃延伸10 min。擴增體系為20 μL,4 μL 5×FastPfu緩沖液,2 μL 2.5 mmol/L dNTPs,0.8 μL引物(5 μmol/L),0.4 μL FastPfu聚合酶;10 ng DNA模板。全部樣本按照正式實驗條件進行,每個樣本3個重復,將同一樣本的PCR產物混合后用質量分數為2%的瓊脂糖凝膠電泳檢測。參照電泳初步定量結果,將PCR產物送到上海美吉生物技術有限公司進行測序,用于后續分析。
1.2.4 實時PCR 法檢測樣本中 16S 基因的絕對含量
使用16S rDNA通用引物341F(5′-CCTACGGGAGGCAGCAG-3′)和518R(5′-TTACCGCGGCTGCTGGC-3′)擴增窖泥宏基因組DNA,得到16S rDNA混合擴增產物。具體步驟參照張會敏等[13]。
1.3 數據處理
2 結果與分析
2.1 窖泥理化性質與酶活
由表1可知,銨態氮、過氧化氫酶活性和蛋白酶活力隨著窖窖泥位置的升高,含量減小;窖壁中層窖泥的有效磷含量和酸性磷酸酶活力都顯著高于窖底、窖壁上層(P<0.05);窖壁中層窖泥的脲酶活力顯著低于窖底、窖壁上層(P<0.05);脫氫酶活力隨著窖泥位置的升高,活性增強。
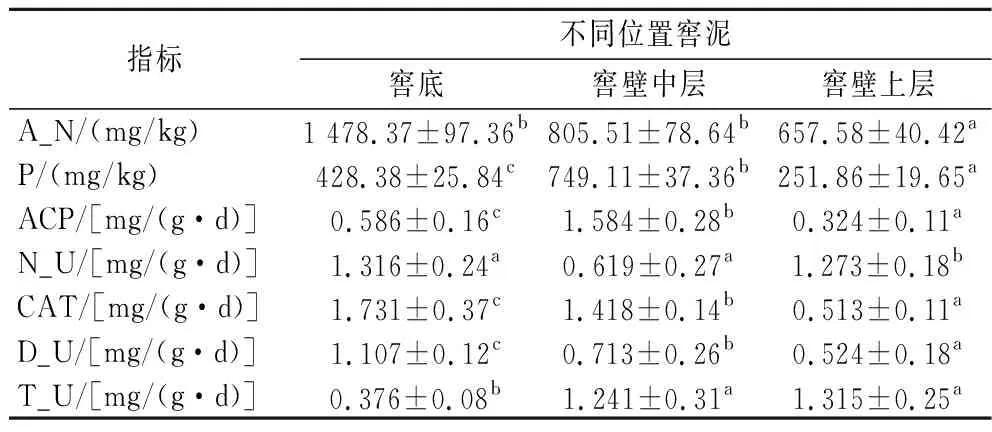
表1 窖泥理化與酶活性質Table 1 Physicochemical and enzymatic active substances of pit mud
2.2 不同位置窖泥細菌群落相似性分析
基于Beta多樣性距離矩陣進行層次聚類分析,UPGMA算法構建樹狀結構,呈現窖池不同位置窖泥細菌群落分布的差異程度。由圖2可知,所有窖泥樣品分為兩大簇,所有窖底、窖壁中層窖泥聚為一簇,窖壁上層窖泥單獨聚為一簇,不同位置的窖泥理化性質具有差異,窖泥中細菌對環境的適應性不同,從而在窖池發酵過程中,窖泥細菌群落存在獨特的空間分布特征。由圖3可知,提取到的主成分1和主成分2的特征值是0.847和0.489,且累計方差占78.76%,說明成分劃分合理。按照主成分1和主成分2的劃分,不同位置的窖泥各自距離較集中,結合聚類和PCoA分析,二者結果基本一致,不同位置的窖泥根據細菌群落能進行較好的聚類,說明其細菌群落相似度較高。圖4為通過絕對定量檢測出的窖泥樣本中16S rDNA的豐度,BM的16S rDNA的拷貝數顯著高于WM、WT,但都在相同數量級上。
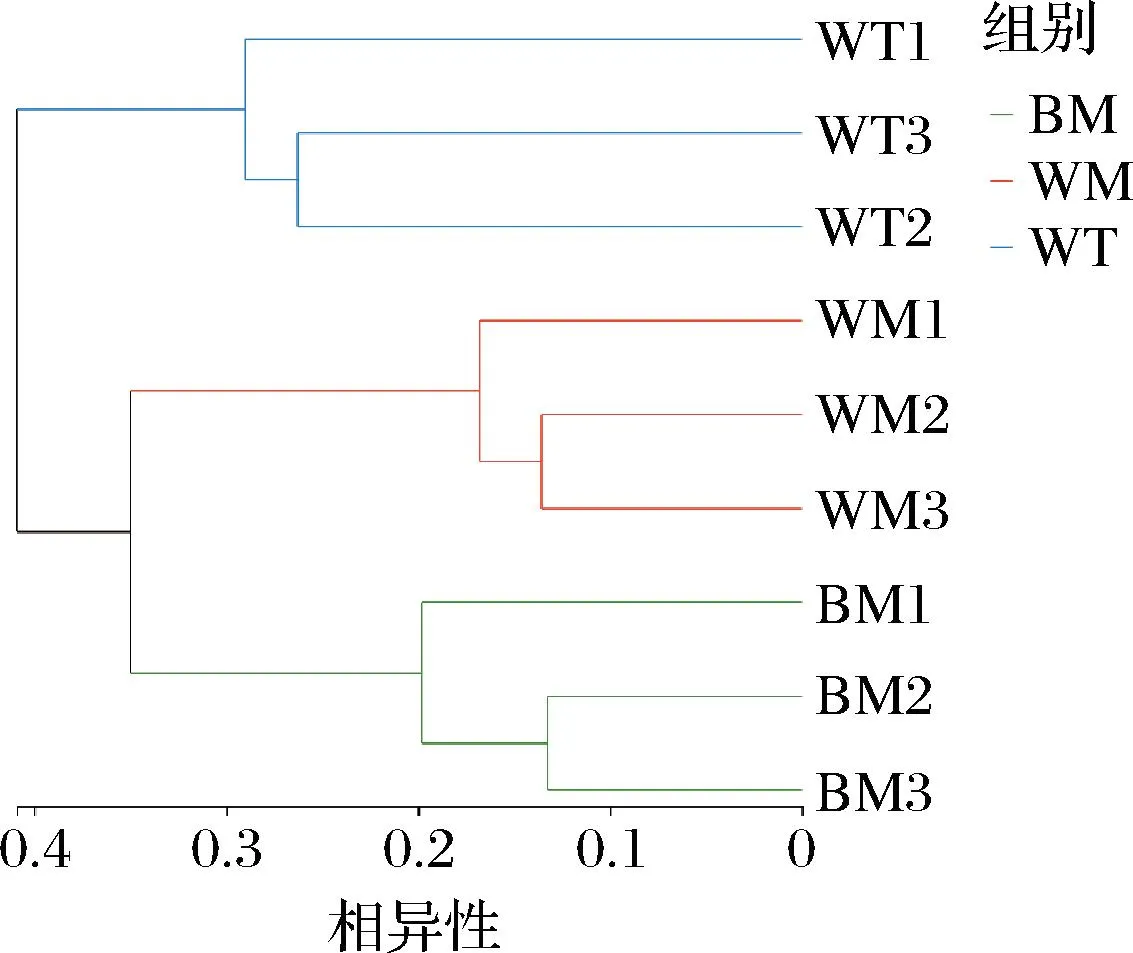
圖2 不同位置窖泥細菌群落聚類樹
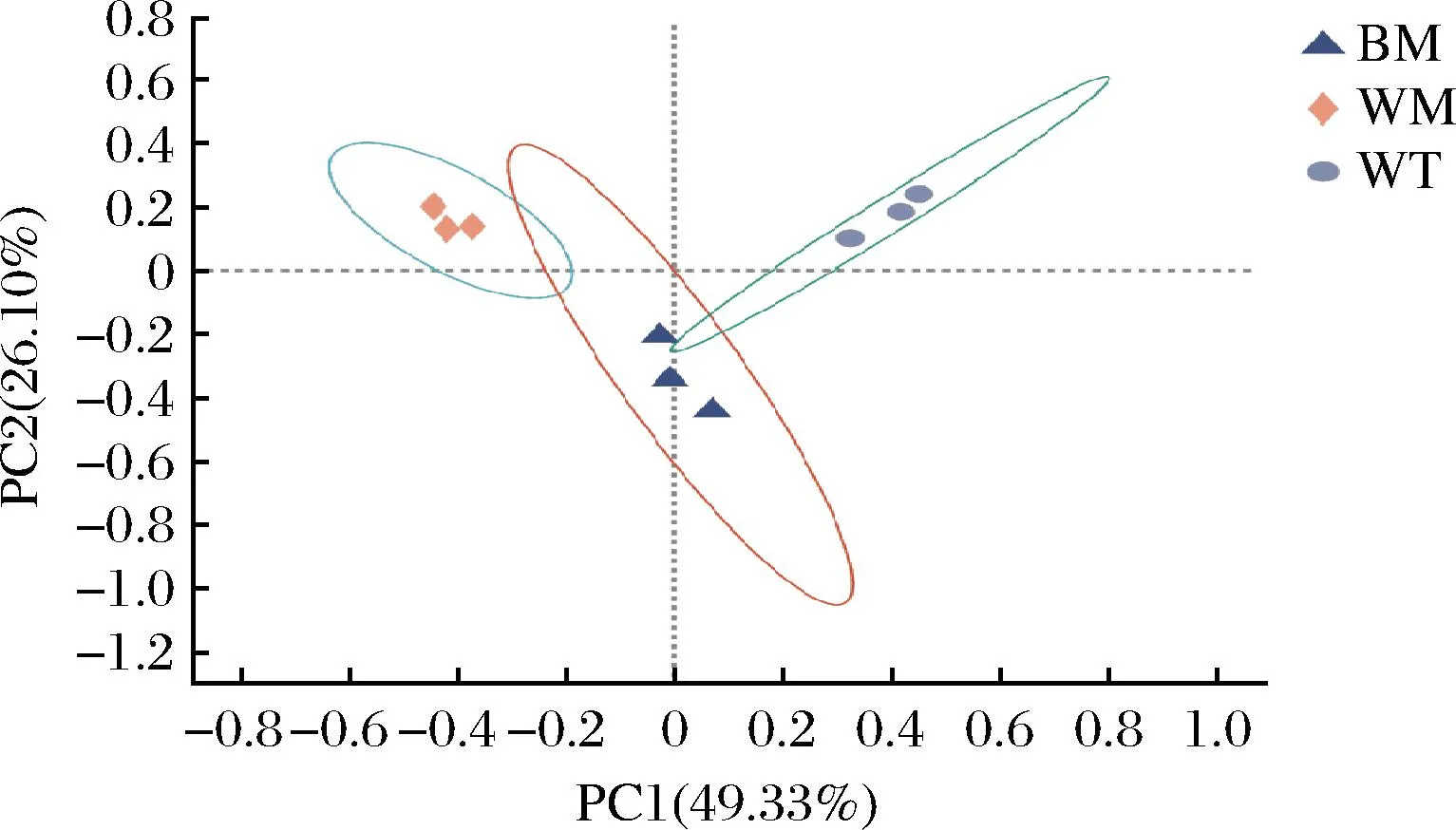
圖3 細菌群落多樣性PCoA圖
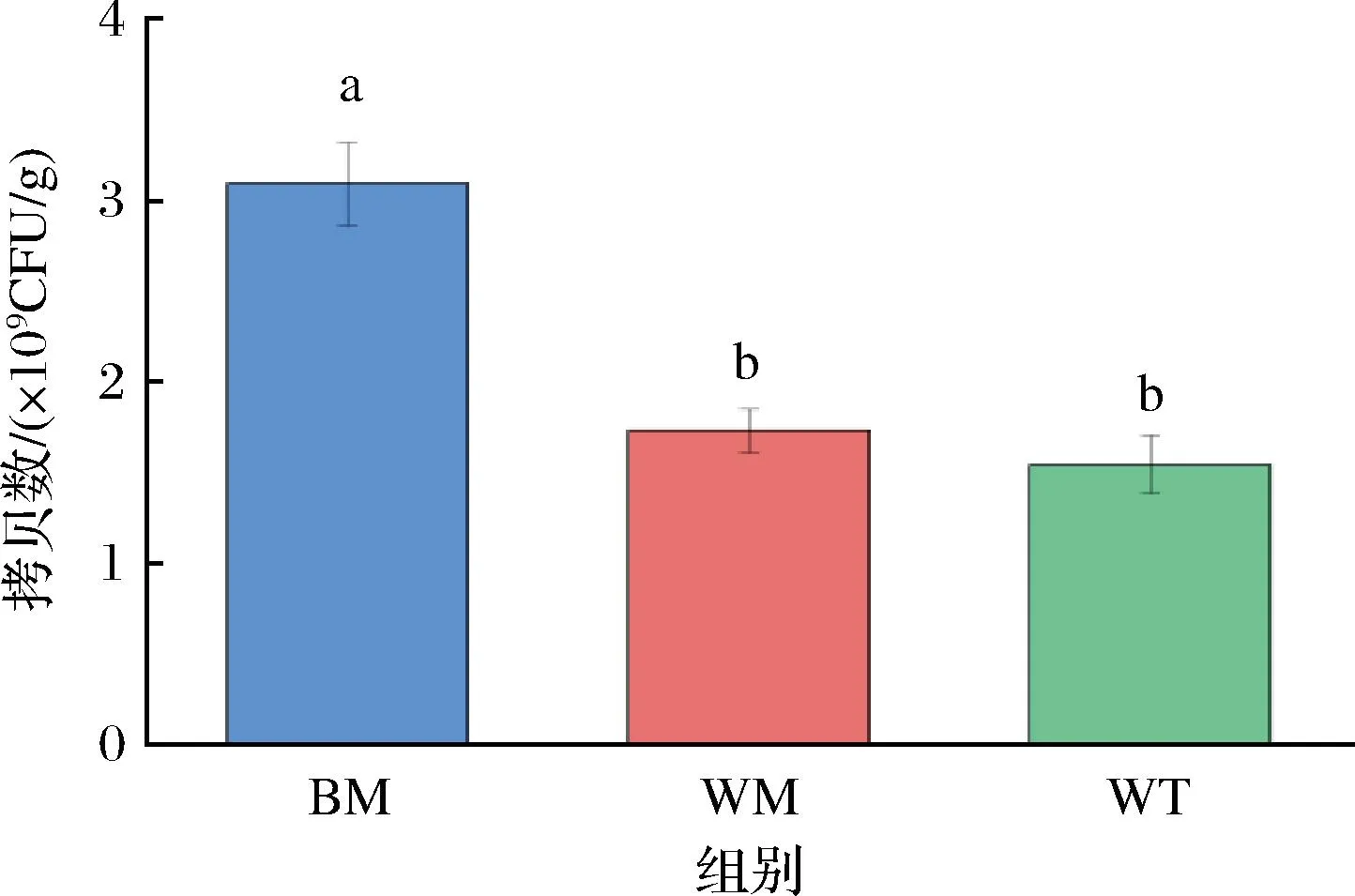
圖4 三組窖泥樣本中16S rDNA拷貝數
2.3 窖泥細菌群落的門水平和屬水平組成分析
將窖泥序列進行OTU物種注釋,得到排名前5的優勢菌門和排名前20的優勢菌屬,others表示排名靠后的菌屬。如圖5-a所示,厚壁菌門(Firmicutes)細菌是窖泥中的絕對優勢菌門,窖泥中產酸產香的關鍵細菌群落隸屬于Firmicutes門,不同位置窖泥Firmicutes門細菌的平均相對豐度都在76.4%以上;擬桿菌門(Bacteroidetes)、互養菌門(Synergistetes)細菌是窖底窖泥、窖壁上層窖泥的優勢菌門,其平均相對豐度都在1%以上,Bacteroidetes能將窖泥中的Fe3+轉化成Fe2+使窖泥顏色由紅棕黃褐等轉向灰白青,表現出老熟特征[14];窖壁中層窖泥特有的優勢菌門是放線菌門(Actinobacteria);窖壁上層窖泥特有的優勢菌門是綠彎菌門(Chlorflexi)。
將相對豐度≥1%的屬定義為優勢菌屬,如圖5-b所示,不同位置窖泥屬水平上的優勢菌屬存在差異,窖底窖泥的優勢菌屬有產己酸菌屬(Caproiciproduces)、乳桿菌屬(Lactobacillus)、乙酸互營菌屬(Syntrophaceticus)、產乙酸嗜蛋白菌(Proteiniphilum)、氨桿菌屬(Aminobacterium)、片球菌屬(Petrimonas)、沉積菌屬(Sedimentibacter)、泰氏菌屬(Tissierella)等;窖壁中層窖泥的優勢菌屬有Lactobacillus、Caproiciproduces、丙酸桿菌屬(Propionibacterium)、片球菌屬(Pediococcus)、腸球菌屬(Enterococcus)、漫游球菌屬(Vagococcus)等;窖壁上層窖泥的優勢菌屬有Fastidiosipila、Lactobacillus、DMER64、Caldiocprobacter等。Lactobacillus是窖壁中層窖泥的第一優勢菌屬,從窖泥的空間位置分布來看,Lactobacillus的相對豐度變化較明顯,在窖壁上層窖泥中的平均相對豐度最低(3.7%);Caproiciproduces是窖底窖泥的第一優勢菌屬,研究表明己酸菌和梭菌等菌群產生的中長鏈脂肪酸(如己酸)能抑制Lactobacillus的生長代謝[15],窖底窖泥Caproiciproducens相對豐度較高,其產生的中長鏈脂肪酸對Lactobacillus抑制作用增強,導致其優勢地位下降,與前人研究結果相似[13];Fastidiosipila是窖壁上層窖泥的第一優勢菌,該菌屬在老窖泥中豐度較高,與郭明遺[16]研究結果一致。總之,窖泥中細菌群落結構的分布與窖池的空間位置密切相關。
2.4 不同位置窖泥酶活力與細菌屬水平組成熱圖
提取豐度>1%的屬,進一步利用熱圖展示不同位置窖泥酶活力和細菌群落群的空間分布特征。由圖6可知,細菌群落與窖泥的空間位置有一定的關聯,但部分指標存在顯著差異,這與胡曉龍等[15]研究結果一致。不同位置窖泥的理化因子和酶活性分布特征如圖7所示,相比窖底窖泥,窖壁中層和窖壁上層窖泥的銨態氮含量分別降低了45.51%、55.52%,過氧化氫酶活力分別降低了18.08%,70.36%,蛋白酶活力分別降低了35.59%,52.66%,蛋白酶將蛋白質水解成游離氨基酸,游離氨基酸與糖發生反應后合成谷氨酸,對白酒質量有很大影響;而脫氫酶活力分增加了2.3倍、2.5倍;酸性磷酸酶可以水解有機磷,提供微生物所需的微量元素,該酶在窖壁中層活性最高的原因可能是窖壁中層的有效磷含量最高。過氧化氫酶、蛋白酶的活性與Caproiciproduces、Aminobacterium的相對豐度變化規律相似,脫氫酶活性與Caldicoprobacter、Sedimentibacter等菌屬的變化規律相似,是否具有顯著的相關性還需進一步分析。

圖6 不同位置窖泥屬水平細菌群落組成熱圖
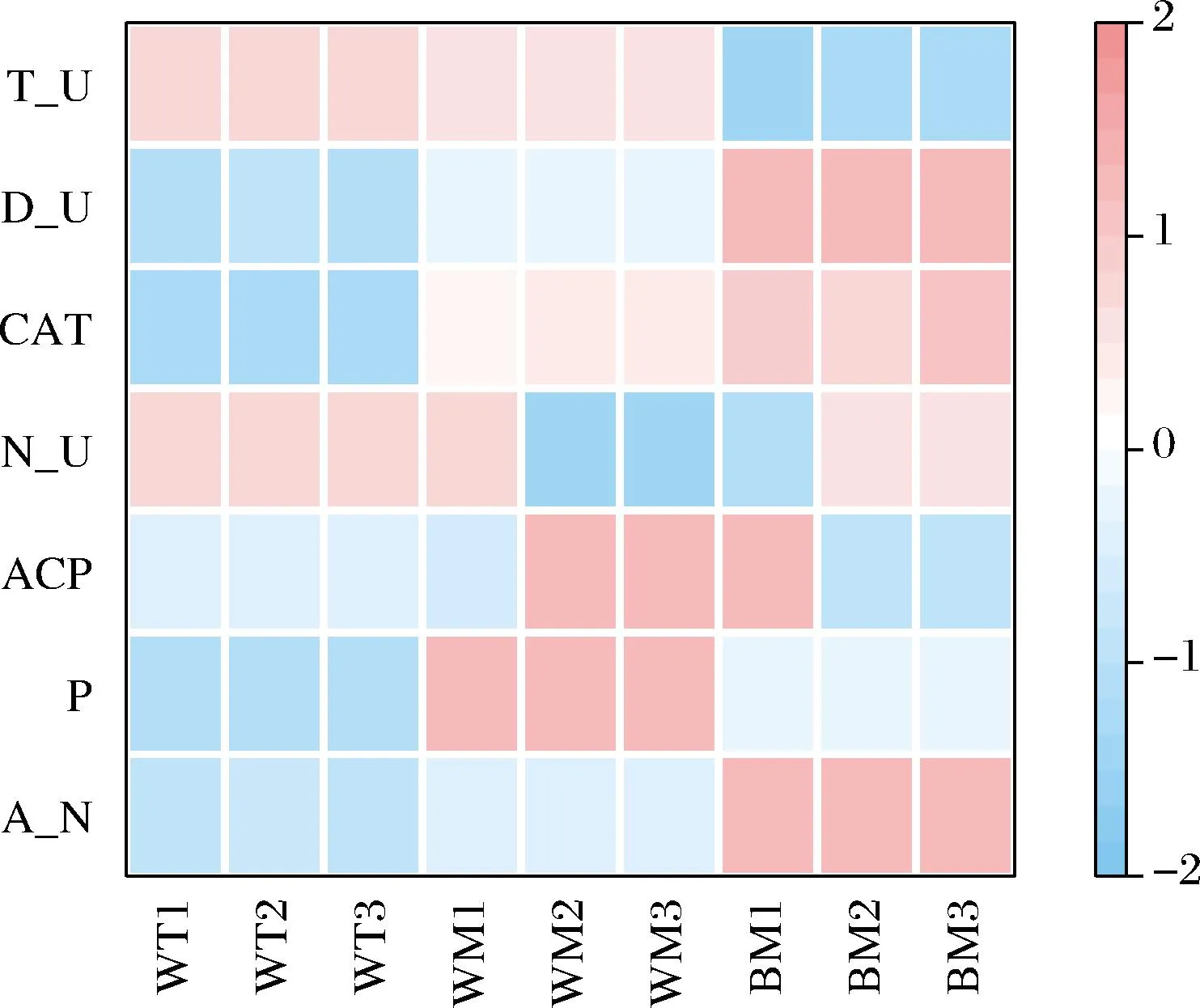
圖7 不同位置窖泥理化和酶活力熱圖
2.5 不同位置窖泥理化酶活力與細菌群落相關性分析
通過對窖泥和理化指標進行相關性分析,圖8結果表明,窖底窖泥的環境對銨態氮、蛋白酶活力的影響較大。由圖9可以看出,銨態氮與Aminobacterium呈顯著的正相關,與Enterococcus呈顯著的負相關;脲酶活力與Syntrophaceticus、Petrimonas、Tissierella呈顯著的正相關,與Propionibacterium、Enterococcus呈顯著的負相關;有效磷和酸性磷酸酶活力對窖壁中層窖泥的影響力最大,其次是過氧化氫酶,酸性磷酸酶活性與Lactobacillus、Propionibacterium、Pediococcus、Enterococcus、Vagocossus呈顯著的正相關;蛋白酶活力與Caproiciproduces、Aminobacterium呈顯著的正相關。
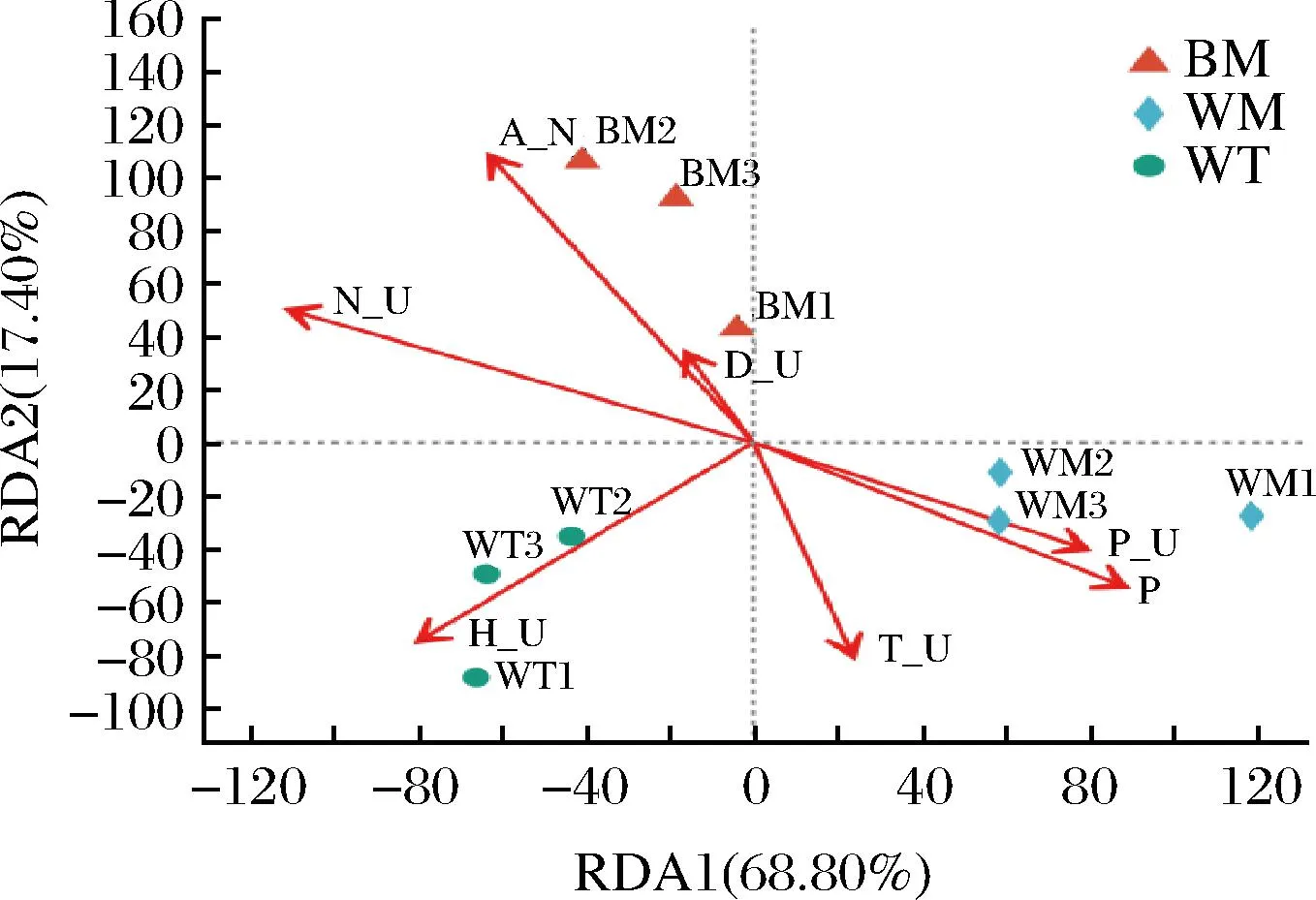
圖8 酶活性與細菌群落結構相關性RDA圖(屬水平)
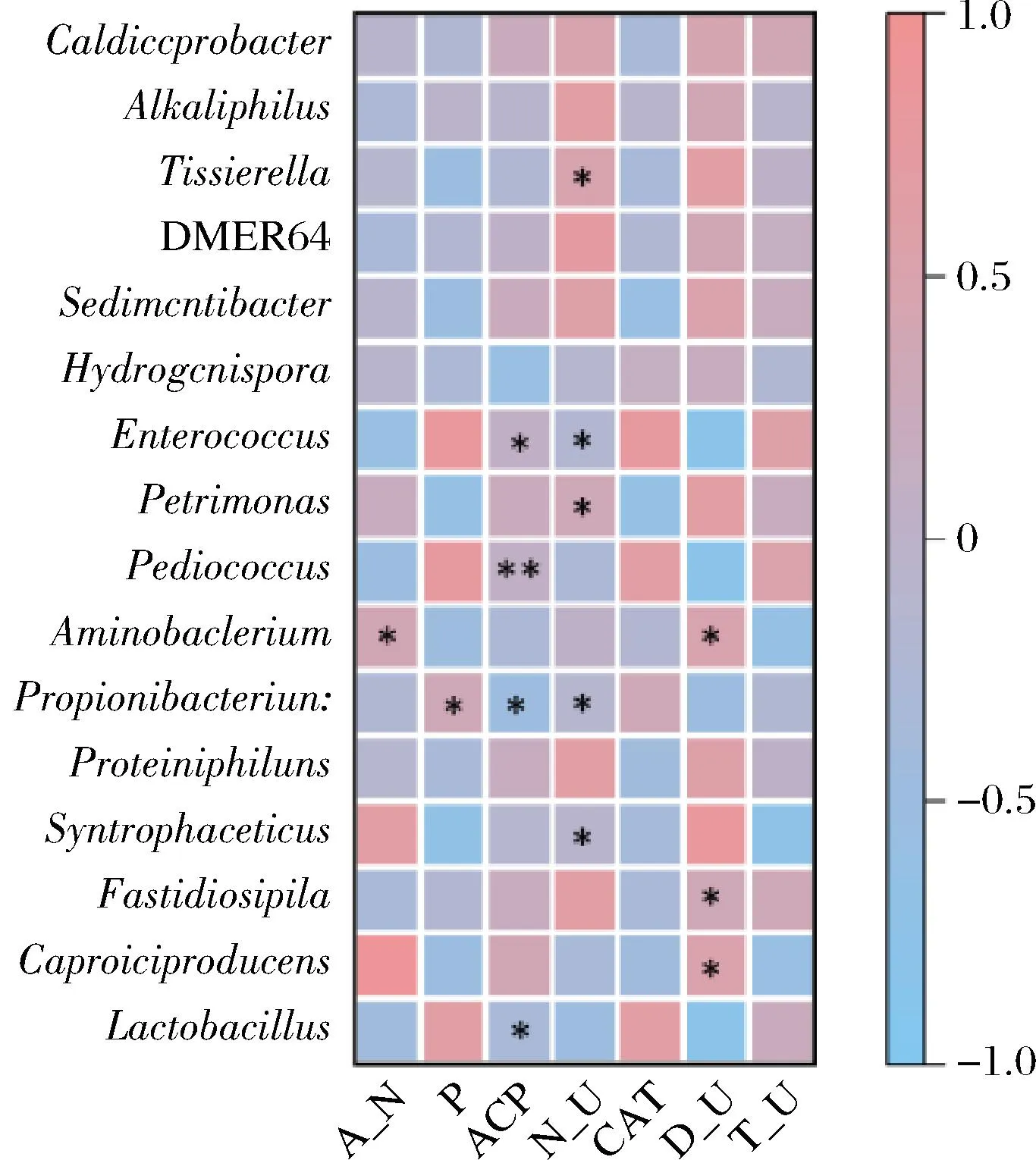
圖9 酶活力與菌群相關性熱圖
2.6 不同位置窖泥參與氮代謝的功能酶差異分析
土壤微生物是氮代謝過程中的主要驅動者,在窖泥這個特殊微生態環境中,通過微生物的一系列協同作用也可以完成氮代謝中的一些循環過程,通過PICRUSt2標記基因序列預測窖泥相關酶功能和豐度信息,對Ammonium(氨)的合成途徑進行了構建,如圖10所示,窖泥中脲酶和蛋白酶是參與有機氮向無機氮形式轉換的關鍵酶,分別在氮代謝和碳酰胺循環中發揮極其重要的作用,其中蛋白酶促使蛋白質、肽類水解成氨基酸,脲酶促進窖泥中碳酰胺水解成氨,水解后的氨基酸在谷氨酸合成酶(glutamate synthase,GOGAT)的作用下生成谷氨酸,再通過谷氨酸脫氫酶(glutamate dehydrogenase,GDH)的催化作用形成氨,氨能通過亞硝酸鹽還原酶(nitrite reductase,nirS)的作用生成。
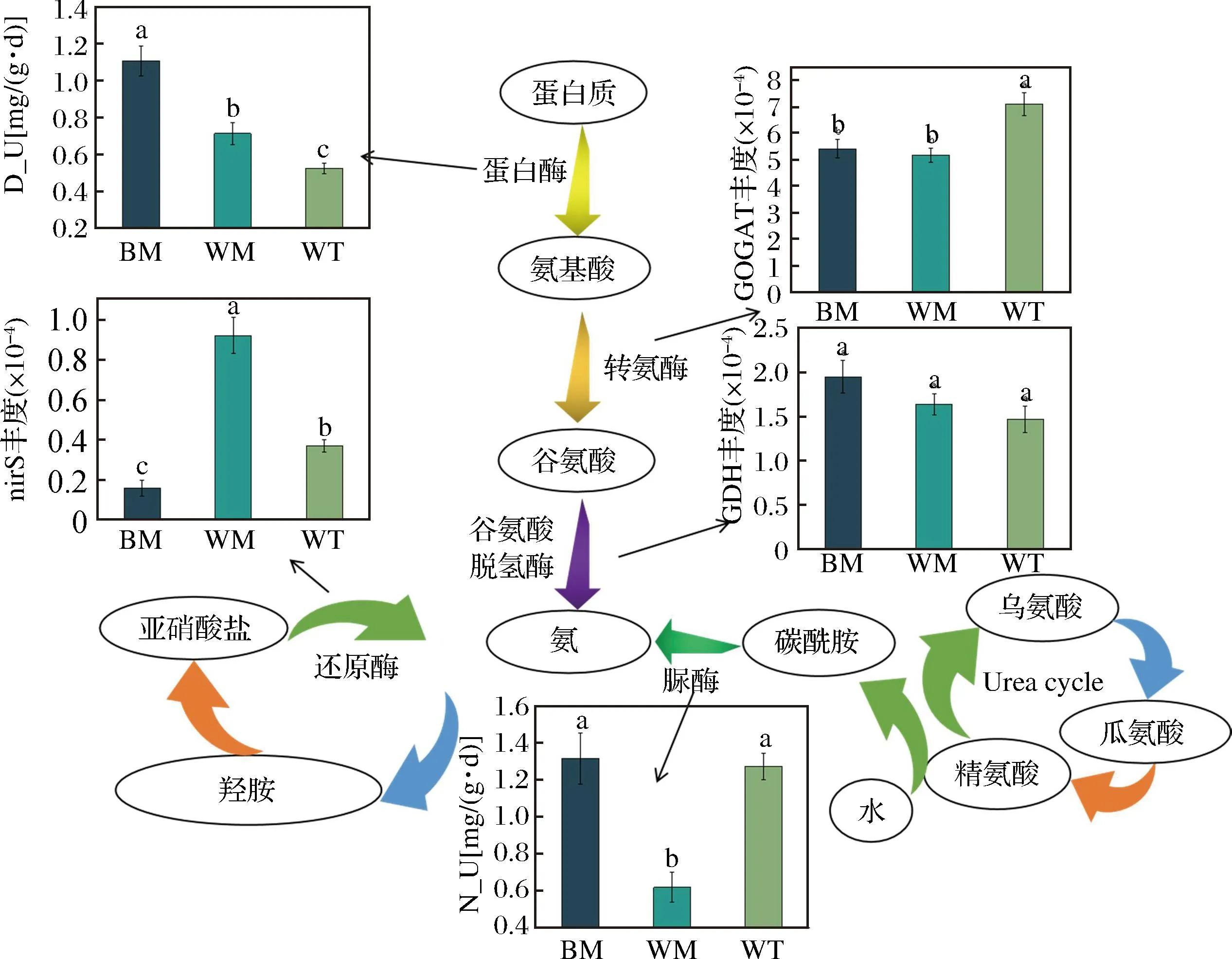
圖10 窖泥不同氮循環功能酶的分布特征
通過理化指標檢測,發現不同位置窖泥的酶活存在顯著的差異,隨著窖池位置的深入,蛋白酶活力逐漸變高,這與常文化等[17]研究土壤蛋白酶變化趨勢相反,可能是窖泥在馴化過程中,不斷的對土壤微生物進行篩選,最后形成了窖泥獨特的細菌群落結構,導致了蛋白酶活力與普通土壤的差異。脲酶在窖底和窖壁上層窖泥中活性最高,可能是窖泥中存在較高的腐殖質含量,利于微生物生長,其活躍代謝使得酶活力較高[18];結合圖11與表1可知,窖泥中不同酶活力的差異與預測結果基本相符合,功能酶的預測結果表明,窖泥中的細菌群落具有完成氮代謝和氨循環的潛力,并且不同位置窖泥參與代謝的關鍵酶存在顯著的差異。
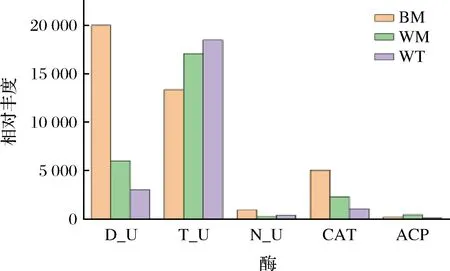
圖11 酶活力差異與PICRUSt功能預測結果的比較
3 討論
本研究分析了理化因子、酶活力及細菌群落的空間分布規律,銨態氮的含量隨著窖泥的位置自下而上呈減小趨勢,銨態氮是微生物自身繁殖、合成各種蛋白質以及酶類所必需的物質,并涉及氨基酸代謝、硝化和反硝化,此外,氮源作為微生物生長發育的主要營養元素,與細菌群落密切相關[19]。適量的銨態氮對維持窖泥生境,提高酒質有著重要作用,與之呈正相關的Aminobacterium的相對豐度隨著窖泥的位置自上而下呈減小趨勢,可推測銨態氮的含量影響微生物屬的相對豐度,可能銨態氮通過硝化反應影響窖泥的pH值,間接影響窖泥的細菌群落結構,也可能是銨態氮作為氮源直接影響微生物的生長繁殖。窖壁中層窖泥酸性磷酸酶活力、脲酶活力最高,窖泥中的酸性磷酸酶用于分解有機磷釋放出有效磷,促進窖泥細菌的代謝[20];有研究表明品級越高的窖泥,脲酶活性越低[21],脲酶能夠特異性水解碳酰胺釋放銨態氮,碳酰胺是存在于窖泥中可以轉化為銨態氮的氮源,脲酶是轉化過程中必不可少的水解酶,可能是維持2種氮源的平衡,利于窖泥這種特殊環境下細菌群落的代謝,碳酰胺和銨態氮兩者之間轉換機制還未見報道,后續研究脲酶對這2種氮源的轉換可能會為濃香型白酒發酵條件的控制提供新的理論基礎。窖池中不同位置窖泥的理化性質和細菌群具有較強的相關性,銨態氮與Aminobacterium呈較強的正相關,該菌屬不僅可以降解氨基酸增加銨態氮的含量,還可以降解絲氨酸、甘氨酸并且以蘇氨酸為底物,產生可以被氫氣還原成乙醇的醋酸鹽[22-23],濃香型白酒發酵過程中會產生乙醇,乙醇作為濃香型白酒關鍵風味物質己酸的有效底物,因此Aminobacterium可能有助于濃香型白酒的風味形成,并且在Aminobacterium參與氨基酸發酵過程中與產氫產甲烷菌協同作用,以減少氫脅迫[24],不同的理化性質以及長期演化的微生物群落,使得Aminobacterium成為窖底窖泥的優勢菌屬。
蛋白酶與Caproiciproducens呈顯著的正相關,該菌屬具有產生參與酸代謝酶類的特性,能夠將乙醇作為底物合成己酸,能為白酒釀造代謝豐富的風味物質。酸性磷酸酶活性與Lactobacillus、Pediococcus、Enterococcus、Proteiniphilum呈顯著的正相關,其中乳酸菌種群較多,研究表明,乳酸菌代謝過程中積累的乳酸可以作為梭菌合成丁酸和己酸等風味物質的底物[25],同時乳酸也是窖泥中菌群形成完整代謝功能的主要壓力[26],通過抑制磷酸酶的活性是否可以達到降解乳酸的效果,將是后期的研究重點,脲酶活力與Syntrophaceticus、Proteiniphilum、Petrimonas、Tissierella、呈顯著的正相關,Syntrophaceticus與甲烷菌共存時能夠表現出乙酸氧化能力,將乙酸鹽轉化為氫氣和二氧化碳,隨后產甲烷菌利用氫氣將二氧化碳還原成甲烷[27],利于甲烷菌的生長代謝,甲烷菌是窖泥老熟的標志,適量的Syntrophaceticus存在與窖泥中,可能加快窖泥的老熟,形成完整的窖泥菌群代謝鏈,這也可能是脲酶活性與窖泥質量相關的原因。Petrimonas能夠進行無機鹽的還原、多環芳烴的降解[28],Tissierella的降解產物中含有乙酸[29],與特定菌體在協同作用下可以降解長鏈飽和脂肪酸,生成乙酸[30],窖泥中功能菌代謝產生的功能酶是濃香型白酒獨特風味形成的關鍵,窖池中不同位置窖泥的細菌群落結構不同,酶活性也具有差異,能夠在白酒發酵過程中及時調控,通過改變環境條件促進有益功能菌的代謝可能有助與濃香型白酒的提升。
4 結論
不同位置窖泥的酶活力和理化性質差異顯著,其中窖底窖泥蛋白酶、脲酶的活性最高,谷氨酸脫氫酶的豐度較高,而nirS酶豐度最低,表明窖底窖泥的氨來源主要是通過碳酰胺循環和氨基酸的分解。不同位置的窖泥細菌群落相對豐度存在顯著的差異,此外窖泥理化性質與其細菌群落的RDA相關性分析發現,銨態氮含量、有效磷含量、過氧化氫酶含量、酸性磷酸酶對窖泥細菌群落的解釋度較高,其影響著窖泥的細菌群結構特征,空間位置也對窖泥物質循環的關鍵酶產生了重要影響。

