瑞馬唑侖用于亞高原人群鎮靜誘導的90%有效劑量研究
吳 婕,張學蕊,朱洪寬,楊雪輝,沈國燦,李建鋼
(曲靖市第一人民醫院麻醉科,云南 曲靖 655000)
瑞馬唑侖是超短效γ-氨基丁酸A受體(γ-aminobutyric acid type A,GABAA)激動劑,血漿蛋白結合率90%,具有起效迅速、鎮靜作用可靠、恢復快、代謝產物無活性、藥物間相互作用的潛在性低、其鎮靜作用可被氟馬西尼逆轉等優點[1]。已有研究顯示,瑞馬唑侖用于在區域神經阻滯或椎管內麻醉下接受手術的患者可獲得滿意的鎮靜效果,有效消除患者的緊張、焦慮情緒,不良反應少[2]。已知高原低氧環境影響高血漿蛋白結合率藥物的藥代動力學,可使藥物清除率顯著降低和半衰期延長[3],高原環境的用藥方案須酌情調整。瑞馬唑侖用于亞高原人群鎮靜誘導的有效劑量尚少研究,本研究探討瑞馬唑侖用于區域神經阻滯或椎管內麻醉亞高原人群鎮靜誘導的90%有效劑量(90% effective dose,ED90),為瑞馬唑侖在亞高原人群的安全應用提供科學依據,現報道如下。
資料與方法
1.1 研究對象
本研究亞高原人群定義為出生并長期(近10年)居住于曲靖市(平均海拔2000米,醫學定義上屬于亞高原)人群;納入2022年6月-2022年12月間在云南省曲靖市第一人民醫院擇期在區域神經阻滯或椎管內麻醉下接受手術的53例患者。
1.1.1 納入標準
(1)充分了解、自愿參加本項研究,簽署知情同意書;(2)出生并十年內居住在本地區曲靖市,擇期在區域阻滯或椎管內麻醉下行手術患者;(3)ASA分級I和II級;(4)年齡18~65歲,性別不限;(5)BMI:18~30 kg/m2;(6)能與研究人員有效溝通。
1.1.2 排除標準
(1)術前使用影響鎮靜效果的其他藥物(γ-氨基丁酸受體激動劑、苯二氮類和非苯二氮類鎮靜催眠藥、阿片類鎮痛藥物、單胺氧化酶抑制劑等),末次使用時間距手術時間短于5個半衰期(以實際藥物說明書為準);(2)合并嚴重肝、腎、心腦血管、代謝系統疾病;如術前肝功能異常:天冬氨酸轉氨酶和/或丙氨酸轉氨酶 ≥ 1.5×正常上限(Upper limit of normal,ULN)和/或總膽紅素 ≥ 1.5 × ULN;術前腎功能異常:血肌酐 ≥ 1.5 ×ULN;(3)合并偏頭痛、癲癇發作等神經系統疾病;(4)合并精神疾病;(5)術前一天坐位收縮壓 ≥ 160mmHg 和/或舒張壓 ≥ 100mmHg);坐位收縮壓 ≤ 90mmHg;(6)已知對苯二氮類藥物及瑞馬唑侖賦形劑過敏或禁忌;(7)研究期間可能因酒精、毒品、藥品戒斷而影響藥物的有效性及安全性評價的患者;(8)妊娠或哺乳期的女性。
患者及近親屬或法定代理人簽署知情同意書,滿足所有納入標準且不符合任一排除標準的方可入組本試驗。本研究已獲得曲靖市第一人民醫院醫學倫理審查分會批準(批件號:倫審2022-011(科)-01)。
1.2 研究方法
1.2.1 麻醉操作和藥品配制
術前訪視評估納入符合標準患者并簽署知情同意;患者術前6h 禁食,2h 禁飲,入手術室后監測無創血壓、心電圖、脈搏氧飽和度;開通上肢淺靜脈輸液通道;面罩吸氧5L/min。根據患者的目標劑量和體重計算瑞馬唑侖(某公司,國藥準字H20190034)總量,稀釋至20mL,三方核查無誤。常規行椎管內麻醉或區域神經阻滯麻醉,待外科醫生切皮,患者無疼痛主訴后,使用微量注射泵靜脈泵注瑞馬唑侖藥液,輸注速度1200mL/h,注射器排空所需時間1min。
1.2.2 觀察指標
用藥前記錄患者的改良警覺/鎮靜(modified observer’s assessment of alert/sedation,MOAA/S)評分,開始泵注瑞馬唑侖時保持環境安靜,讓患者從1至100大聲循環計數,其間使用MOAA/S量表評估鎮靜深度,記錄第1、3、5、7、10 min的MOAA/S評分。完成MOAA/S評分后繼續靜脈泵注瑞馬唑侖0.4~0.5 mg·kg-1·h-1維持腦電雙頻指數(bispectral index,BIS)于55~65[4]。若患者在給藥后任一時間節點的鎮靜深度達到MOAA/S評分<2分,則定義為陰性(達到預期鎮靜深度);若患者未停止計數或雖入睡但各時間節點的MOAA/S評分始終≥2分,則定義為陽性(未達到預期鎮靜深度)。根據預試驗,瑞馬唑侖用量為0.075mg/kg時,患者首次出現停止數數,故本研究首例入組患者的瑞馬唑侖用量為0.075mg/kg,下一例患者的瑞馬唑侖目標用藥劑量根據上個患者的結果,參照拋偏倚硬幣(biased coin design,BCD)法[5,6]決定。若上個患者結果為陽性,則下個患者瑞馬唑侖升高 1個劑量梯度;若上個患者用藥后被判定為陰性,采用隨機信封法決定下一例患者瑞馬唑侖劑量,下一例有11%的概率降低瑞馬唑侖1個劑量梯度,有89%的概率維持上一例的劑量;設定瑞馬唑侖相鄰劑量梯度為0.025 mg/kg。麻醉過程中發生低氧血癥(SpO2<90%)時增加吸入氧濃度和氧流量,必要時抬下頜,面罩供氧,人工輔助通氣;出現低血壓(收縮壓下降幅度超過基礎值20%或收縮壓<90 mmHg),給予多巴胺2mg 或去甲腎上腺素4ug;如出現心動過緩(HR<45次/min),給予阿托品0.3mg,必要時可重復給予。
記錄瑞馬唑侖輸注前和輸注后第1、3、5、7、10min的MOAA/S評分,同時記錄相應節點的心率、血壓和氧飽和度。觀察不良反應,包括嗆咳,注射痛、惡心嘔吐、低氧血癥、心動過緩、瘙癢、尿潴留、藥物過敏的情況。本試驗觀察期為手術開始至術后72 h內,其中患者離院至術后72 h情況采用電話隨訪方式收集。
1.3 統計分析
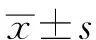
2 結果
完成觀察的53例患者中,男30例、女23例,平均年齡 43.8±12.7歲,平均BMI 23.1±2.8 kg/m2,ASA I級 18 例、Ⅱ級 35例。椎管內麻醉37例,神經阻滯麻醉16例。瑞馬唑侖鎮靜誘導序貫試驗,見圖1。

圖1 瑞馬唑侖用于亞高原人群鎮靜誘導序貫圖
Isotonic回歸計算得到所需ED90為0.176(95%CI:0.166~0.192mg/kg),概率回歸法計算得到ED90為0.178(0.164~0.207)mg/kg。瑞馬唑侖的鎮靜誘導量-效關系,見圖2。

圖2 瑞馬唑侖用于亞高原人群鎮靜量-效關系圖
與給藥前比較,給藥后3 min,5 min,7 min,10min患者血壓呈明顯下降趨勢(P<0.01),差異有統計學意義,但總體下降幅度在20%內。與給藥前比較,給藥后1、3、5、7min患者心率無顯著差異(P>0.05);至第10min,心率稍下降,差異有統計學意義(P<0.05),但仍在臨床正常值(60~100次/分)范圍內。與給藥前比較,給藥后10min內患者脈氧飽和度均在臨床正常值(脈氧飽和度>90%)范圍內。與給藥前比較,給藥后第1、3、5、7min內患者MOAA/S評分明顯下降(P<0.01),差異有統計學意義;至給藥后第10min MOAA/S評分與給藥前相比差異無統計學意義(P>0.05),見表1。

表1 不同時間點收縮壓、舒張壓、平均動脈壓、心率、MOAA/S評分比較(n=53)
用藥后,6例(11.3%)患者出現低氧血癥,予以抬下頜面罩供氧后恢復正常;6例(11.3%)患者出現輕微嗆咳;4例(5.7%)患者血壓下降超術前20%,使用去甲腎上腺素4ug提升血壓;術后24、72h隨訪患者,患者無明顯不適。
3 討論
瑞馬唑侖入血后約90% 與人血清蛋白結合,其藥物分解代謝不依賴肝腎功能,通過血漿中非特異性膽堿酯酶水解為唑侖丙酸,代謝產物主要經尿液排出[7]。高海拔地區可誘發生理變化,導致心血管系統、肺系統、胃腸系統、藥物代謝酶系統、腎臟排泄系統等多個生理系統出現低氣壓缺氧反應[8,9],導致人血漿總蛋白和白蛋白濃度升高,藥物蛋白質結合增加[10]。因此,高原環境可能影響瑞馬唑侖的吸收、分布、代謝和排泄,改變藥物藥代動力學。本研究發現,在亞海拔高原地區,椎管內麻醉或神經阻滯下單次靜脈推注瑞馬唑侖鎮靜,概率回歸法計算得到ED90為0.178(95%CI:0.164~0.20 7 mg/kg),初步探索了瑞馬唑侖用于亞高原人群鎮靜誘導的按體重給藥方案,驗證安全性、有效性,為瑞馬唑侖用于高原地區患者個體化鎮靜誘導提供參考。
一項安慰劑、咪達唑侖、瑞馬唑侖對照評估瑞馬唑侖的安全性、藥代動力學和藥效學的遞增劑量研究中,瑞馬唑侖0.075 mg/kg是獲得鎮靜作用的最低劑量,且鎮靜作用呈劑量依賴性[11]。本研究預試驗中單次靜注瑞馬唑侖0.075mg/kg時也觀察到患者停止計數,與該報道一致,故將0.075mg/kg設為本研究的初始劑量。瑞馬唑侖鎮靜誘導效果確切,可達到MOAA/S評分≤2 分的鎮靜深度;本研究中單次靜脈推注后10min患者MOAA/S評分可恢復到用藥前,提示體內代謝迅速,適于臨床短小手術的鎮靜誘導,尤其消化內鏡、和支氣管鏡診療操作、關節復位等手術,有助于順利實施手術和縮短蘇醒時間和住院時間[12,13]。
本研究應用瑞馬唑侖的不良反應總發生率約28%,無嚴重不良反應,提示瑞馬唑侖有輕度抑制循環、呼吸的風險,應用時須嚴密監測。但安全性高于丙泊酚[14-17]。本研究尚存在以下不足:瑞馬唑侖的預期效果受患者背景病及其嚴重程度、手術種類及復雜程度等多因素干擾,故本研究選擇ASA分級I和II級,行短小手術的患者,受試人群相對局限,后期會擴大人群進一步研究;另外,研究設計的劑量梯度偏大,可能造成最終結果和95%可信區間增大;研究未針對性別分組,難以發現瑞馬唑侖鎮靜效果的性別差異[18];未與平原、高原人群對比,有待進一步探索。
綜上所述,瑞馬唑侖用于亞高原人群鎮靜誘導安全有效,ED90為0.178 mg/kg。

