馬鈴薯高效再生及遺傳轉化體系的優化
張薇
摘要 為優化馬鈴薯高效再生及遺傳轉化體系,研究鄂馬鈴薯3號莖段外植體在不同激素濃度配比下愈傷組織及分化情況,獲得最佳愈傷組織及分化激素配比,再采用根癌農桿菌的遺傳轉化進行篩選,獲得最佳轉化體系,為馬鈴薯優質品種的基因工程育種提供依據。結果表明,不同激素濃度配比下愈傷組織及分化率差異較大,其中2.0 mg/L ZR+0.1 mg/L IAA 激素配比下可高效再生出芽,出芽率高達100%,芽長勢粗壯。通過構建植物表達載體pCambia1301,以GV3101為介導菌株,預培養2~3 d,共培養2~3 d,350 mg/L羧芐青霉素,50 mg/L卡那霉素篩選濃度轉化效果較好,轉化效率可達65%,其中轉化苗在0.8 mg/L IBA+0.2 mg/L NAA激素配比的培養基中可形成再生植株,再生率達80%,苗莖粗壯,根系發達。
關鍵詞 馬鈴薯;莖段;激素;遺傳轉化;轉化率
中圖分類號 S532? 文獻標識碼 A? 文章編號 0517-6611(2024)03-0035-05
doi:10.3969/j.issn.0517-6611.2024.03.009
Optimization of High Efficiency Regeneration and Genetic Transformation System in Potato
Abstract In order to optimize the efficient regeneration and genetic transformation system of potato, the effects by using stem segment of Hubei potato No.3 as explants were studied in different hormone concentration ratios, and the optimal callus and differentiation hormone ratio were obtained. Then, the genetic transformation of Agrobacterium tumefaciens was used for screening to obtain the best transformation system, which provided the basis for genetic engineering breeding of high quality potato varieties. The results showed that the callus and differentiation rate were great different under the ratio of different hormone concentration. The hormone ratio of 2.0 mg/L ZR and 0.1 mg/L IAA could regenerate the buds efficiently, the germination rate was as high as 100%, and the bud growth was strong. By constructing expression vector pCambia1301 in plant, GV3101-mediated strain, pre-cultured for 2-3 days, and co-cultured for 2-3 days, and 350 mg/L carbenicillin, and 50 mg/L kanamycin to screen the concentration was better. The transformation efficiency could reach 65%. The transformed seedlings could form regenerated plants in the medium of 0.8 mg/L IBA and 0.2 mg/L NAA hormone. The regeneration rate could reach 80%, the stems were thick and the roots were developed.
Key words Potato;Stem segment;Hormone;Genetic transformation;Conversion rate
馬鈴薯(Solanun tuberosum L.)為茄科茄屬一年生草本塊莖植物[1],是我國主要糧食作物之一,產量排在小麥、玉米、水稻之后占第四位[2]。馬鈴薯具有生長周期短、營養豐富、加工產品眾多等特點,在農業生產及人民生活中占有重要地位。
馬鈴薯栽種常采用無性繁殖的方式[3],即塊莖的種苗繁育方式。這導致許多品種發生退化,且隨著栽培年限的延長更加嚴重。研究發現其原因在于各種病毒、細菌、真菌等對馬鈴薯塊莖和種苗的侵染。采用植株組織培養的方式可連續產生優質種苗和無毒種薯。通過馬鈴薯莖尖的脫毒、葉片和莖段等器官的快繁都能達到較好的效果[4-6]。另外,通過基因工程技術培育抗病、抗蟲及抗逆性強、品質改良的種薯[7-8]。
許多國內外研究者[9-12]對馬鈴薯再生體系進行了研究,MS為常用的基本培養基;莖尖、莖段、薯塊等是再生途徑中主要采用的外植體;實驗常采用的激素有細胞分裂素6-BA和ZT,細胞生長素IAA、NAA、2,4-D、赤霉素。雖然馬鈴薯遺傳轉化體系已有報道,但由于適用的轉化受體及外植體材料存在差異[13-15],轉化過程也有從愈傷的間接再生體系和直接分化再生體系的存在[16-18],導致馬鈴薯試驗所需試驗條件及培養基組成等差異明顯。筆者研究了不同激素配比對馬鈴薯品種鄂馬鈴薯3號莖段愈傷組織誘導及分化的影響,在此基礎上優化了根癌農桿菌的遺傳轉化體系,為馬鈴薯優質品種的選育奠定基礎。
1 材料與方法
1.1 試驗材料
采用鄂馬鈴薯3號無菌瓶苗莖段作為外植體。
1.2 培養基
以MS培養基,附加不同6-BA、ZR、NAA、IAA、GA3激素,20 g/L蔗糖,8 g/L瓊脂,pH 5.8,作為愈傷誘導及分化的基本培養基。以MS+30 g/L蔗糖+pH 5.8作為根癌農桿菌轉化時侵染液。以MS+30 g/L蔗糖+8 g/L瓊脂+pH 5.8,附加不同濃度IBA和NAA,作為轉基因植株再生的基本培養基。以LB作為菌體培養的基本培養基,即5 g/L酵母提取物,10 g/L蛋白胨,10 g/L氯化鈉,17 g/L瓊脂,pH 7.0,附加50 mg/L利福平(Rifampin,以下簡寫為Rif)和50 mg/L卡那霉素(Kanamycin,以下簡寫為Kan)。
1.3 愈傷組織誘導及芽的分化
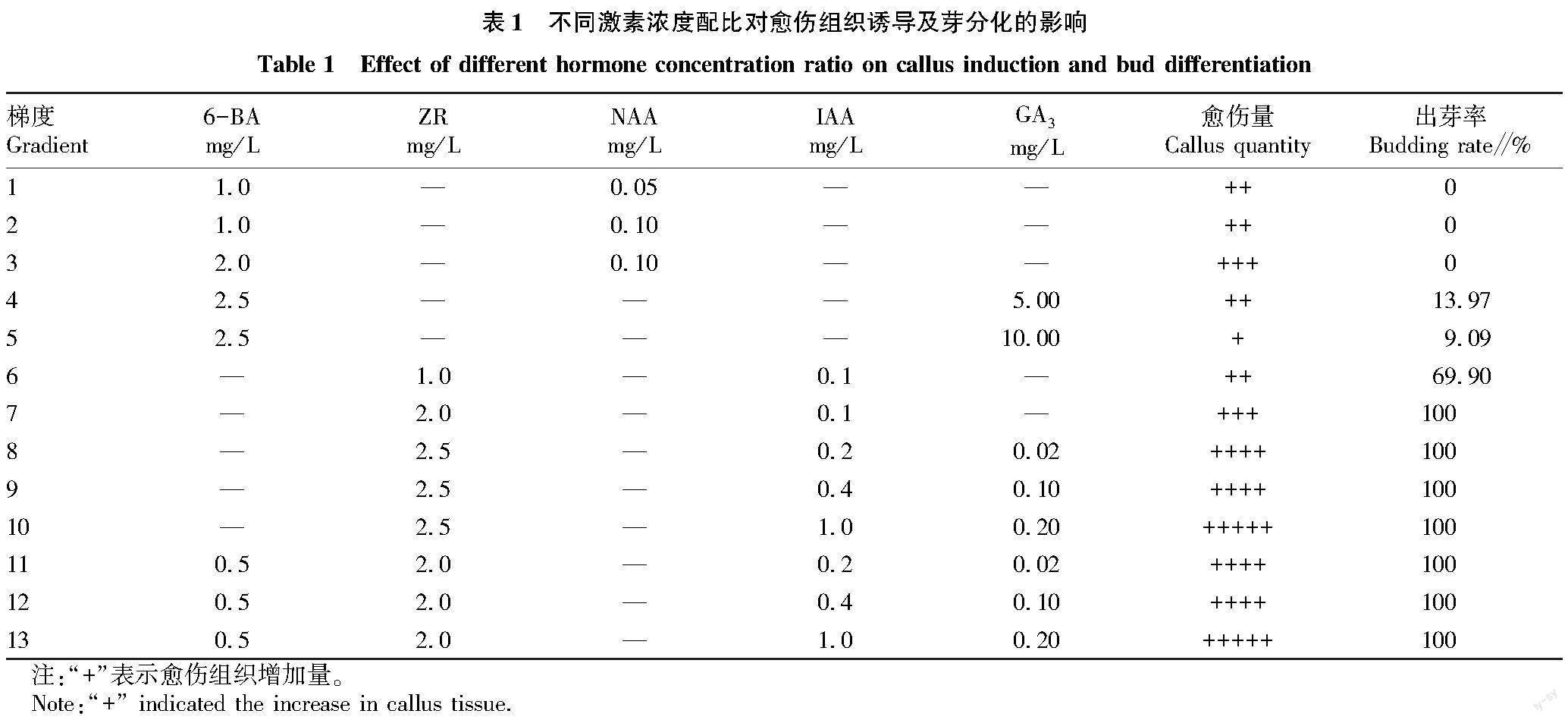
將苗齡15~20 d的馬鈴薯無菌瓶苗莖段切成長0.5~0.8 cm小段,接種于附加不同濃度6-BA、ZR、NAA、IAA、GA3的13種梯度培養基(表1)中,進行愈傷組織的誘導及分化,每個梯度3個重復。20~25 ℃光照培養,1 500~2 000 lx光照16 h,培養20 d后觀察愈傷出愈情況及出芽率(出芽率=出芽的外植體數/外植體總數×100%)。
1.4 遺傳轉化體系的構建
1.4.1 農桿菌菌液制備。
構建植物表達載體pCambia1301,利用GV3101菌株,獲得農桿菌菌液。農桿菌單菌落在附加50 mg/L Rif和50 mg/L Kan的LB液體培養基中28 ℃、200 r/min振蕩過夜培養。4 000 r/min離心10 min,棄上清,收集菌體,加入MS(附加200 μmol/L乙酰丁香酮)液體培養基中重懸20~30 min,稀釋至OD600=0.4~0.6,備用。
1.4.2 莖段的預培養。
將苗齡15~20 d的馬鈴薯無菌瓶苗莖段切成長0.5~0.8 cm小段,置于預培養基中,20~25 ℃,避光培養2~3 d。預培養基選用愈傷誘導效果較佳的2.5 mg/L ZR+1.0 mg/L IAA+0.20 mg/L GA3激素配比培養基(表1 10號梯度)。
1.4.3 侵染及共培養。
預培后的莖段放入無菌培養皿(90 mm×90 mm)中,倒入農桿菌菌液,期間不斷振蕩,侵染8 min,莖段轉入吸干紙上吸干表面殘留菌液,接種于墊有濾紙的共培培養基中,20~25 ℃,避光培養2~3 d。選用激素配比為2.5 mg/L ZR+1.0 mg/L IAA+0.2 mg/L GA3(表1 10號梯度)作為共培培養基,并附加200 μmol/L乙酰丁香酮。
1.4.4 轉化莖段的篩選及抗性芽的獲得。
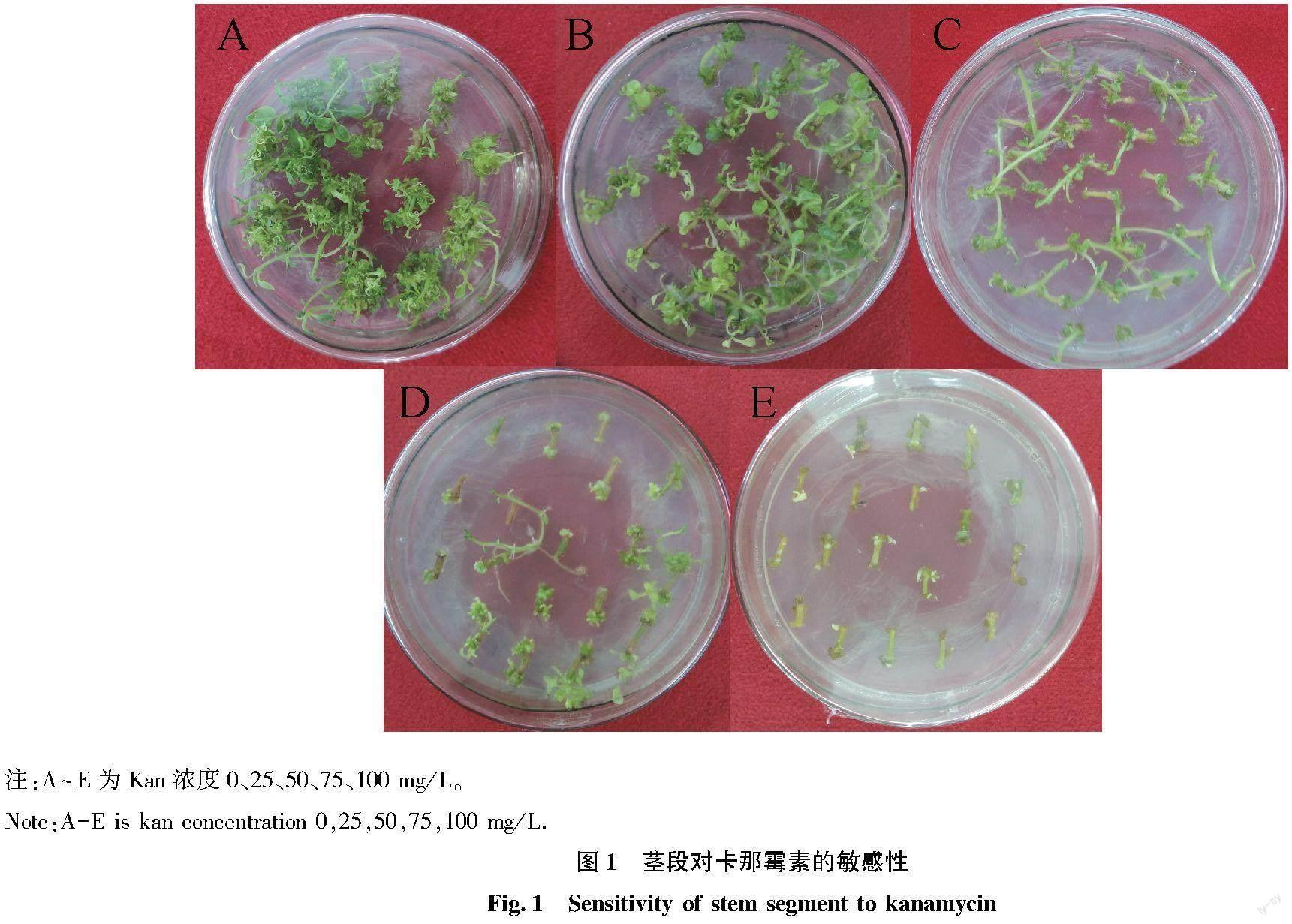
共培后將莖段轉入篩選培養基中,20~25 ℃光照培養,每15~20 d換一次板,直至分化出抗性芽。選用2.0 mg/L ZR+0.1 mg/L IAA激素配比培養基(表1 7號梯度)作為篩選培養基,附加抑菌劑350 mg/L羧芐青霉素和卡那霉素。利用濃度梯度試驗確定Kan最適濃度,設立5個濃度梯度(0、25、50、75、100 mg/L),每個梯度3個重復。20~25 ℃光照培養16 h,每15 d換一次板,觀察第40天時外植體的篩選及出芽情況。
1.4.5 轉化抗性植株的再生。
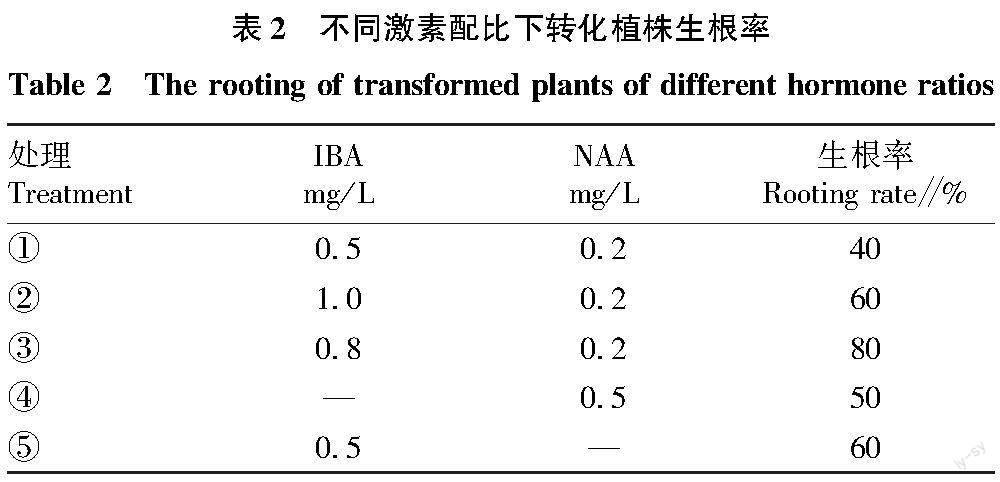
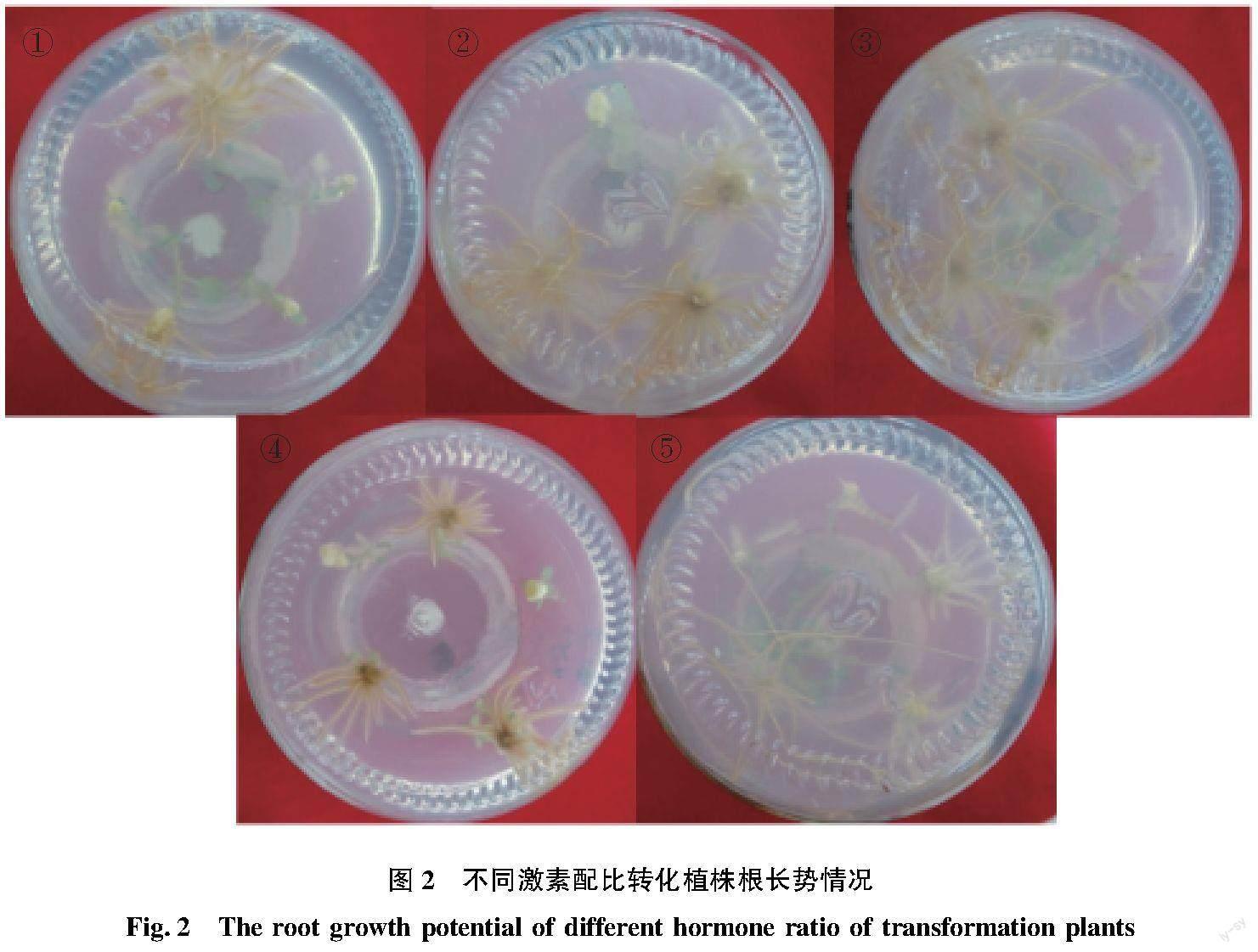
轉化苗再生培養基為MS+30 g/L蔗糖+8 g/L瓊脂+pH 5.8,附加不同激素濃度的NAA和IBA進行配比,30 mg/L Kan 和350 mg/L羧芐青霉素,根據預試驗的結果設置5個處理(表2),將已分化出1~2 cm小苗,從基部切下,插入生根培養基中,每瓶5棵生根苗,每個梯度3個重復。觀察轉化抗性植株生根率(生根率=已長根植株數/總植株數×100%)及根長勢情況。
1.4.6 轉化植物的PCR鑒定。
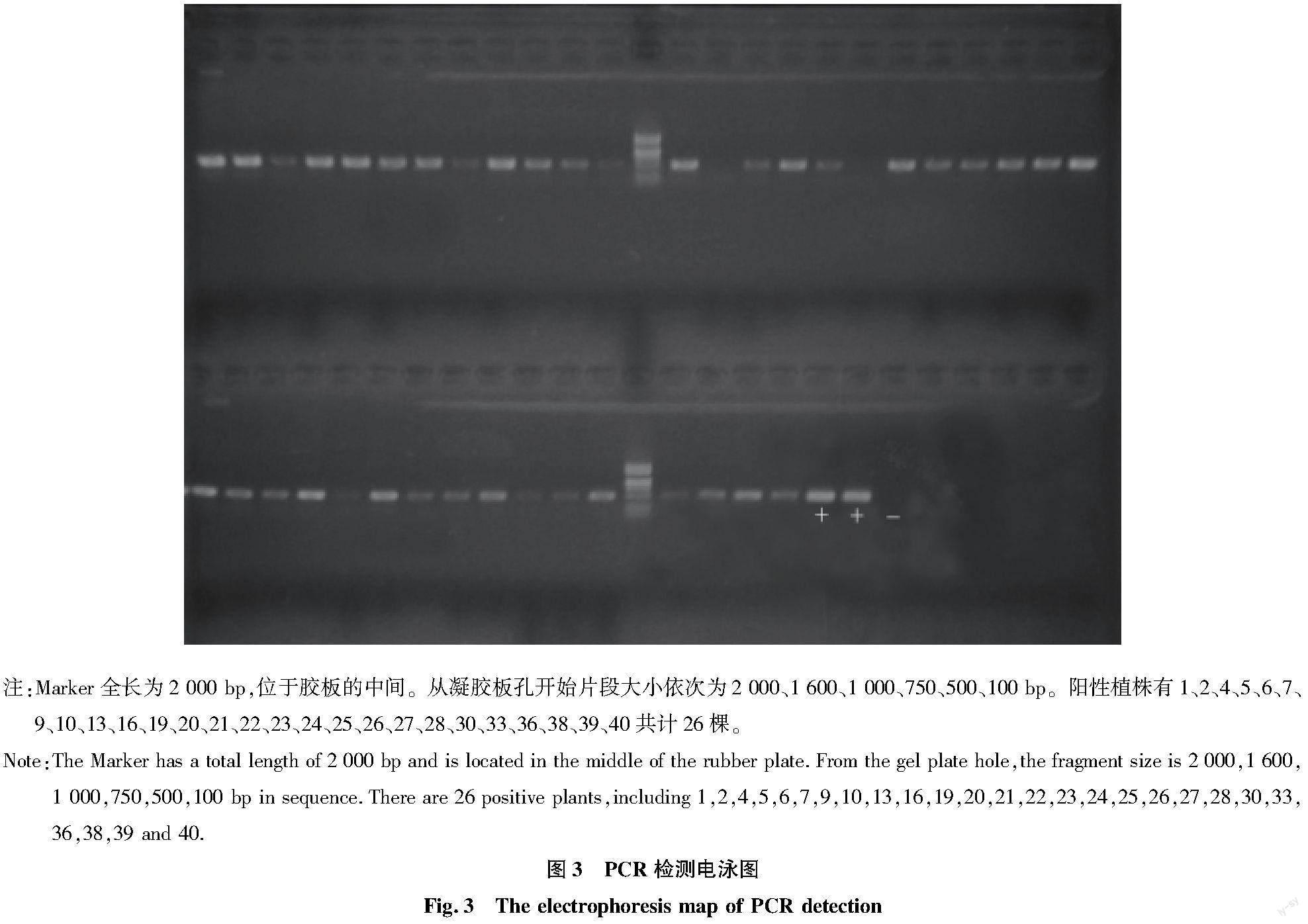
待轉化植株生根后,采用CTAB法提取DNA。未轉化生根野生苗基因組DNA為陰性對照,植物表達載體質粒為陽性對照,利用Kan抗性基因NPTII的2個特異引物(5′→3′)CGTTGTCACTGAAGCGGGAGGG和GAGCGGCGATACCGTAAAGCAC進行PCR擴增。PCR反應體系為94 ℃ 5 min,94 ℃ 30 s,60 ℃ 30 s,94 ℃ 5 min,72 ℃ 8 min,35個循環,反應結束后4 ℃保溫。PCR反應條件為 10 μL Mix+7.4 μL ddH2O+0.3 μL引物-F+0.3 μL引物-R+2 μL DNA,反應結束后用1.2%瓊脂糖凝膠電泳進行檢測。對檢測結果進行統計和分析,計算該轉化體系下的轉化效率(轉化率 =已檢出Kan抗性的陽性植株數/總再生植株數×100%)。
2 結果與分析
2.1 不同激素配比對愈傷組織誘導及芽分化的影響
使用細胞分裂素6-BA和ZR,細胞生長素NAA和IAA,以及赤霉素GA3 3類植物激素,并根據前人研究結果,設計了5種激素不同濃度配比的13個處理梯度。結果表明,鄂馬鈴薯3號莖段可直接分化出芽(梯度1~3號除外),不同激素配比下的愈傷誘導和芽分化情況差異明顯(表1)。
2種激素配比下(梯度1~7號),出愈率較高的是3號(2.0 mg/L 6-BA+0.10 mg/L NAA)和7號(2.0 mg/L ZR+0.1 mg/L IAA)2個處理,外植體莖段傷口處長出愈傷組織,呈綠色。3種和4種激素配比下(8~13號),出愈率明顯高于2種激素配比,外植體莖段各部位均有愈傷長出,傷口處較多,呈淺綠色。
6-BA與NAA激素配比下未分化出芽,且與GA3配合使用時出芽率極低,分化出的芽較細,無明顯葉片,表明6-BA不利于鄂馬鈴薯3號莖段的分化,但對愈傷組織的誘導能夠起到一定的作用。ZR與GA3、IAA和6-BA多種激素配比(梯度8~13號)下出芽率均達100%,但所出芽較細,無明顯葉片,苗弱;ZR與IAA配比(梯度6~7號)時能得到較高的出芽率,分化出的芽較粗,葉片較大且呈深綠色,苗壯,其中7號(2.0 mg/L ZR+0.1 mg/L IAA)出芽率可達100%。結果表明,ZR和GA3這2種配比其他激素時,可以促進鄂馬鈴薯3號莖段的分化出芽,但ZR誘導產生的芽較壯,GA3誘導產生的芽較弱。考慮操作的方便性、芽生長的狀態、試驗成本等,鄂馬鈴薯3號莖段愈傷誘導及分化出芽的最佳激素配比為2.0 mg/L ZR+0.1 mg/L IAA。
2.2 遺傳轉化體系的建立
2.2.1 卡那霉素濃度對外植體出愈率和出芽率的影響。
在預培、侵染及共培后,將莖段置于含有不同濃度Kan(0、25、50、75、100 mg/L共計5個處理梯度)的培養基中,40 d后觀察愈傷組織及出芽情況(圖1)。當Kan濃度為0和25 mg/L時,不能有效抑制愈傷組織生長及芽的分化,無法進行有效的篩選,且增加了后期檢測抗性植株的難度;當Kan濃度為50 mg/L時愈傷誘導率較低,出芽率為80%;當Kan濃度為75 mg/L時愈傷組織誘導率急劇降低且莖段外植體多數褐化,出芽率為27.8%;當Kan濃度為100 mg/L時莖段全部褐化壞死,且出芽率為零。因此,選取50 mg/L Kan是理想的篩選濃度,既能有效地抑制愈傷的誘導及芽的分化,又不致于細胞迅速死亡。
2.2.2 IBA和NAA配比對轉化植株根誘導及再生的影響。
5個處理均能誘導出根,且所誘導出的根長勢情況及誘導率均存在一定差異(表2和圖2),根誘導率為處理③> 處理①(⑤)>處理②>處理①,生根率最高可達80%。2種激素(IBA和NAA)不論是單獨使用還是配合使用均能誘導抗性苗長根,單一激素使用時(④和⑤),IBA誘導產生的根較長較細,NAA誘導產生的根較短較粗;2種激素配合(①~③)使用誘導產生的根比單獨使用NAA時要長,比單獨使用IBA時要粗,由此可知,2種激素配合使用對根的發育及生長更有利。表明選擇處理③ 0.8 mg/L IBA+0.2 mg/L NAA作為轉基因植株再生的培養基。
2.2.3 PCR檢測轉化效率。
對已獲得的轉化再生抗性植株進行PCR檢測(圖3),檢測40棵抗性植株,有26棵具Kan抗性的抗性植株,轉化效率為65%,其中還有少量呈現弱帶的抗性植株,可能是DNA提取時DNA濃度較低或轉化后的拷貝數較低導致。
3 結論與討論
該研究表明,鄂馬鈴薯3號作為無性繁殖的作物,容易誘導愈傷組織、不定芽和再生植物,整個試驗周期較短、出芽率高、再生植物粗壯,在此基礎上進行根癌農桿菌的遺傳轉化研究也得到了較高的轉化率(65%),是基因工程育種中優質種薯獲得的來源。另外,受體系統的建立,關系到組織培養及基因轉化的成敗,該試驗選用試管苗莖段作為外植體,進行組織培養,具有取材方便、不易污染等優點,成功建立和優化了該品種莖段外植體的愈傷組織誘導及分化培養體系,可以直接通過外植體一步分化出苗,出芽率達100%。
由于植物快繁過程中生長素和分裂素等激素的水平和配比,對誘發細胞的分裂、生長和分化起著決定性作用[19]。因此,該試驗研究了5種激素水平下的13種處理方式莖段外植體愈傷組織誘導及分化試驗,結果表明,在2 mg/L ZR+0.1 mg/L IAA激素配比下能夠較好地進行愈傷誘導及芽的分化,分化率高達100%。在馬鈴薯組織快繁的研究中,研究者[20-22]常用激素NAA、6-BA、GA3 3種進行芽的分化,分化率都未達100%;王萍等[11]研究表明ZT是誘導馬鈴薯分化較為理想的激素,分化率達57.14%,很少用到激素ZR,而該試驗嘗試使用ZR,且表明ZR能夠成功地誘導馬鈴薯愈傷組織及芽的分化,分化率高達100%,認為ZR是一種應用于馬鈴薯芽分化時較好的一種植物生長調節劑。
選用組培最佳試驗結果的基礎上進行根癌農桿菌遺傳轉化的優化,確定了鄂馬鈴薯3號莖段外植體的最佳Kan選擇壓為50 mg/L,再生抗性芽率達80%,轉化植株陽性率達65%,使用0.8 mg/L IBA+0.3 mg/L NAA配比下轉化芽再生植株根粗壯。試驗選擇壓與薯塊[23-24]Kan選擇壓相同,而葉片[25]的選擇壓為20 mg/L Kan,出現這一現象的原因可能是基因型和試驗外植體選取的不同,后期需根據實際情況進行選擇壓敏感性試驗,以獲得最佳選擇壓。轉化苗生根時使用激素IBA或NAA只能增強或減弱苗根的長勢,Veale等[15]不添加激素直接進行生根,羅源[18]在轉化苗生根時添加激素NAA,而該試驗選用IBA和NAA配合使用獲得較高的生根率,根長勢粗壯。
參考文獻
[1] 吳林科,郭志乾,王曉瑜.優質馬鈴薯生產技術[M].銀川:寧夏人民出版社,2005.
[2] 王凱.冬作馬鈴薯氮磷鉀營養特性與合理施肥的研究[D].廣州:華南農業大學,2016.
[3] 劉俊秀.馬鈴薯組織培養基試管苗保存研究[D].呼和浩特:內蒙古農業大學,2015.
[4] 付雪嬌,孟令文.馬鈴薯品種遼薯6號莖尖脫毒及快繁技術研究[J].遼寧農業科學,2017(5):85-87.
[5] 張玲.馬鈴薯組織培養技術研究[J].西南科技大學學報(自然科學版),2004,19(1):88-90.
[6] 王芳,黃堅,嚴成其,等.花旗馬鈴薯品種莖尖脫毒與快繁技術[J].浙江農業科學,2017,58(9):1577-1578,1583.
[7] 楊永智.農桿菌介導法馬鈴薯遺傳轉化體系的優化[J].江蘇農業學報,2013,29(4):738-742.
[8] 叢培琳,盧翠華,邸宏,等.Bt-CryV基因對馬鈴薯的遺傳轉化[J].東北農業大學學報,2008,39(9):16-20.
[9] 蒲秀琴.3種青海省主栽馬鈴薯外植體的組織培養和植株再生[J].江蘇農業科學,2014,42(4):52-54.
[10] 白云,馬箭超,聶文丹,等.一種簡易快速獲得脫毒馬鈴薯幼苗的方法[J].河北師范大學學報(自然科學版),2017,41(2):169-171.
[11] 王萍,王罡,季靜.馬鈴薯兩個基因型不同外植體的組織培養與植株再生[J].中國馬鈴薯,2006,20(6):326-328.
[12] 羅源,陳耀鋒,李春蓮,等.馬鈴薯莖段愈傷組織培養體系的優化[J].西北農林科技大學學報(自然科學版),2007,35(10):159-162.
[13] HEERES P,SCHIPPERS-ROZENBOOM M,JACOBSEN E,et al.Transformation of a large number of potato varieties:Genotype-dependent variation in efficiency and somaclonal variability[J].Euphytica,2002,124(1):13-22.
[14] 康霞,徐剛,王玉萍.根癌農桿菌(Agrobacterium tumefaciens)介導的馬鈴薯高效遺傳轉化體系篩選及優化[J].中國沙漠,2016,36(1):225-231.
[15] VEALE M A,SLABBERT M M,VAN EMMENES L.Agrobacterium-mediated transformation of potato cv.Mnandi for resistance to the potato tuber moth(Phthorimaea operculella)[J].South African journal of botany,2012,80:67-74.
[16] 李璐.農桿菌介導的馬鈴薯遺傳轉化體系的優化及StNTP基因功能的驗證[D].武漢:華中農業大學,2017.
[17] 程永芳,張麗,宋玉霞.馬鈴薯高效遺傳轉化受體體系的建立[J].西北農業學報,2016,25(9):1350-1357.
[18] 羅源.馬鈴薯再生體系的建立及HAL1基因遺傳轉化研究[D].楊凌:西北農林科技大學,2007.
[19] 顏昌敬.植物組織培養手冊[M].上海:上海科學技術出版社,1990.
[20] 王憲.二倍體馬鈴薯再生體系建立及耐鹽愈傷組織的篩選[D].哈爾濱:東北農業大學,2012.
[21] 欒雨時,徐品三,夏秀英,等.適于馬鈴薯莖段再生的植物激素配比選擇[J].中國馬鈴薯,2004,18(3):143-144.
[22] 王桂梅,楊林棟.馬鈴薯莖尖組織培養方法優化研究[J].安徽農學通報,2012,18(9):48-49.
[23] 聶利珍.應用擬南芥CDPK1基因提高馬鈴薯抗旱性的研究[D].呼和浩特:內蒙古農業大學,2015.
[24] 李丹,尚菲.影響馬鈴薯遺傳轉化效率的因素探討[J].隴東學院學報,2016,27(3):53-55.
[25] 王丹,朱常香,鄭成超,等.根癌農桿菌介導的馬鈴薯遺傳轉化條件的優化[J].山東農業大學學報(自然科學版),2002,33(1):23-27.

