分布式甲醇重整制氫動力學及反應器強化研究
牛叢叢,欒學斌,徐 潤,夏國富
(中石化石油化工科學研究院有限公司,北京 100083)
能源是國家經濟和社會發展的基礎。在“碳達峰、碳中和”背景下,我國能源消費結構正朝著以氫能、太陽能和新一代核能為代表的清潔能源優化發展。氫能使用過程沒有CO2排放,生成的水可參加到地球大氣的水循環系統中,因此氫能是未來應對氣候變化、建設脫碳社會的理想能源[1-2]。甲醇是高含氫有機氫載體,其氫質量分數為12.5%,遠高于美國能源部制定的氫載體儲氫質量分數7.5%的要求[3]。除此以外,以甲醇為原料的制氫技術還具有以下優勢:甲醇是大宗商品,運輸方便、安全性高、經濟性好;甲醇來源除煤制甲醇外,還可以通過捕集CO2加氫還原獲得;甲醇制氫的氫氣產量高、CO含量低、流程簡單[4-5]。
甲醇重整制氫是成熟的工業制氫技術,并已在煉油、精細化工、制藥、特種鋼鐵等行業得到了廣泛應用[5-7]。然而,傳統化工制氫裝置因占地和空間等因素限制,并不適用于加氫站的站內制氫技術要求,必須對現有甲醇重整制氫技術進行二次開發。高活性催化劑是制氫設備小型化的前提條件,催化劑活性與反應器結構的匹配性是分布式甲醇制氫技術的關鍵。甲醇重整制氫為吸熱過程,由于床層熱阻的存在,床層內會存在明顯的溫度梯度和冷點。催化劑活性越高,單位體積床層吸熱量越大,溫差越顯著;而溫度分布不均和局部低溫會導致催化劑表觀活性大幅下降,造成反應器出口甲醇轉化率降低,進而降低分布式甲醇制氫裝置的整體效率。綜上,催化劑表觀利用效率與反應器的傳質、傳熱性能密切相關。
在各種制氫反應器中,微通道反應器具有微米級反應通道、較大的比表面積,而且傳質、傳熱性能優異,但由于其容量過小,主要應用于500 L/h以內的微型制氫系統,有限的產氫能力限制了其在分布式制氫場景的應用[8-13]。相比之下,中小型甲醇重整反應器更適合于分布式制氫場景,但其傳質、傳熱性能亟需強化。然而,目前關于中小型甲醇重整反應器的強化研究報道較少[7]。
基于此,本課題利用RSR-501型高效甲醇重整制氫催化劑,開展甲醇重整制氫反應動力學和中小型甲醇重整反應器過程強化研究。首先,通過條件試驗和模型擬合,獲得可準確描述甲醇重整制氫本征反應性能的動力學模型,并基于對顆粒尺度的擴散-反應分析,優化催化劑顆粒尺寸;進而,利用固定床反應器模擬探究高空速條件下催化劑活性與反應器結構的匹配問題,并優化反應器結構尺寸以強化傳熱、提高綜合能效,為中小型甲醇制氫撬裝反應器的開發和過程強化研究提供借鑒。
1 反應動力學模型
1.1 條件試驗
RSR-501型甲醇重整催化劑,為中石化石油化工科學研究院有限公司開發的工業催化劑,主要由氧化銅和氧化鋅組成,其質量分數分別為71%和13%。
為獲取甲醇重整反應動力學模型,首先利用實驗室固定床反應器測定了不同反應條件下RSR-501催化劑上甲醇重整的本征反應性能。具體試驗參數:催化劑裝填量為10 mL,顆粒尺寸為20~40目,并以40 mL瓷球作稀釋劑,稀釋后床層總裝填高度為220 mm。電加熱爐為開啟式5段加熱、5段控溫爐,可維持恒溫區高度為500 mm,床層近似等溫控溫(溫差不大于1 ℃)。不同工藝參數的考察范圍:反應溫度為230~260 ℃,反應壓力為1.5~2.0 MPa,體積空速為2.0~4.0 h-1,進料水醇摩爾比[n(H2O)∶n(CH3OH)]為1.78。條件試驗評價結果及對應條件下的熱力學平衡數據如表1所示。

表1 RSR-501催化劑上不同反應條件下甲醇重整本征反應性能和熱力學平衡數據
甲醇重整制氫反應體系為多組分反應體系,主要發生蒸汽重整(SR)、甲醇分解(DE)和水煤氣變換(WGS)3種反應,分別如式(1)~式(3)所示[14]。

(1)

(2)

(3)
其中SR和DE反應程度決定了原料甲醇的轉化率,而WGS反應程度影響CO和CO2的選擇性。
首先分析原料空速對反應性能的影響,對比C1~C3,C4~C6,C7~C9試驗結果,由表1可知,在250 ℃、反應壓力恒定條件下,隨著空速提高,甲醇轉化率逐漸下降,反應逐漸遠離熱力學平衡。進而,從反應熱力學角度分析溫度和壓力的影響,觀察A1~A4及B1~B4試驗結果,由表1可知,在維持反應壓力和液相空速不變條件下,將反應溫度由230 ℃提高至260 ℃,甲醇轉化率明顯增加,CO選擇性提高而CO2選擇性降低。這是由于SR和DE反應均為吸熱反應,而WGS反應為放熱反應,提高反應溫度促進了SR和DE反應平衡向右移動,而抑制了WGS反應。相比之下,壓力對產品選擇性的影響較小,在反應溫度為250 ℃、體積空速為2.3 h-1時,反應壓力從1.5 MPa提高至2.0 MPa,甲醇轉化率僅從97.42%降至95.14%。這是由于SR和DE反應均為體積增大的平衡反應,壓力增加有利于逆向反應,故而甲醇轉化率下降;同時,WGS反應平衡不受壓力影響。
1.2 反應動力學模型
依據反應機理中涉及的反應數量,甲醇蒸汽重整動力學模型可分為單速率模型(SR)、雙速率模型(SR-DE,DE-WGS,SR-rWGS)以及三速率模型(SR-DE-WGS),其中rWGS為逆水煤氣變換反應。單速率模型僅能預測原料消耗速率,無法得到產物選擇性信息,一般較少采用。SR-DE機理認為SR和DE反應同時發生,兩者速率差異決定了CO和CO2選擇性的差異;DE-WGS和SR-rWGS機理均為串聯機理,前者認為CO為初級產物,再通過WGS反應生成二級產物CO2,而后者剛好相反,認為CO是二級產物[15]。SR-DE-WGS機理是最復雜的綜合機理,最早由Peppley[16]提出,該機理認為SR和DE反應同時發生,并且CO和CO2可通過WGS反應相互轉化。由于式(1)~式(3)反應的獨立反應數為2,即其中任一反應均可由其余兩種反應來表示,因此很難通過數據擬合的手段來區分雙速率模型和三速率模型。
由表1可知:在遠離反應熱力學平衡的條件下,產品氣中CO含量明顯低于水煤氣變換反應的熱力學平衡值(見試驗A1,B1,B2,C3,C6,C9),說明實際反應過程不可能先通過DE反應生成CO,CO再經WGS反應生成CO2,從而否定了DE-WGS反應機理[15,17-18];同理,若SR-rWGS機理成立,則CO選擇性會隨著停留時間增加而增大,但實際CO選擇性隨著空速的變化規律并不完全支持此機理(見試驗C1~C9)。因此,該反應過程遵循SR-DE反應機理的可能性較大,但也無法排除SR-DE-WGS機理的可能性,仍需要通過其他手段予以佐證,如同位素標記試驗等。
考慮到三速率模型的復雜性,從工程應用的角度出發,本研究采用雙速率模型,即SR-DE機理對試驗數據進行擬合。從表1可知:隨著反應溫度提高,甲醇轉化率逐漸提高(試驗A1~A4及B1~B4),最終達到熱力學平衡;而CO選擇性基本一直隨著溫度的升高而增大,說明DE反應比SR反應具有更高的反應活化能,高溫更有利于DE反應的發生。
依據形式不同,動力學模型可分為冪函數模型和L-H型動力學模型[15]。其中,包含熱力學平衡常數的冪函數模型雖然未考慮基元反應的機理步驟,但形式更加簡單、更具實用性,因此許多學者對冪函數模型進行了廣泛的研究[9,16-21]。
基于SR-DE機理的冪函數反應動力學模型如式(4)~式(7)所示。
(4)
(5)
(6)
(7)
式中:r為反應速率,mol/(g·h);k為指前因子;a1,a2,b1,c1,c2,e1,e2分別為待定指數項,無因次;E為反應活化能,J/mol;p為組分分壓,MPa;β為反應可逆因子,無因次;K1、K2分別為反應平衡常數。
吳倩等[19]基于商業甲醇制氫催化劑,在溫度為220~280 ℃、壓力為1.3~2.7 MPa、體積空速為0.8~2.0 h-1、n(H2)∶n(CH3OH)為1.78~2.63的條件下,采用SR-DE冪函數動力學模型研究了甲醇重整制氫反應動力學,并優化了動力學模型參數。由于本研究動力學參數與文獻[19]相近但催化劑不同,因而需要在其基礎上利用條件試驗數據對模型的反應活性參數進行修正。因此,將表1中未達平衡轉化率的試驗數據(共9組)和假設的動力學模型代入典型的理想平推流反應器模型[14]中,進行動力學模型的參數校正,得到SR和DE反應的動力學校正系數,結果如圖1所示。由圖1可知,與文獻[19]報道動力學模型相比,本研究使用RSR-501催化劑時SR和DE反應的動力學校正系數分別為1.8~2.8和1.5~2.5。為簡化計算,將由試驗數據擬合得到的校正系數進行算數平均處理,得到使用RSR-501催化劑時SR和DE反應的動力學校正系數分別為2.1和1.9。因此,可以認為RSR-501的催化活性提高約1倍。

圖1 不同試驗點的活性校正系數
1.3 催化劑顆粒尺寸優化
甲醇重整制氫催化劑通常采用共沉淀法制備,催化劑細粉經壓片成型后得到毫米級圓柱形顆粒,用于列管式固定床反應器。考慮到內擴散阻力與催化劑活性息息相關,因此需要考察大顆粒催化劑內傳質阻力的大小,并優化催化劑顆粒尺寸。
梯爾(Thiele)模數(Φ)的平方與有效因子(η)的乘積(Φ2η)可用于判定內擴散阻力的影響,由式(8)計算得到。當Φ2η<0.16時,η≈1,內部傳質對反應速率無明顯影響;當Φ2η>3.0時,η<1/3,內部傳質對反應速率有明顯影響;當Φ2η介于0.16和3之間時,內部傳質對反應速率有影響但不顯著[22]。
(8)
式中:Lp為擴散特征尺寸,m;(-rA)obs為試驗測定的甲醇表觀消耗速率,mol/(g·h);CAs為反應工況下氣相主體的甲醇摩爾濃度,mol/m3;De為有效擴散系數,m2/s,可通過Wilke-Bosanquet模型計算并采用空隙率(θ)和曲折因子(τ)校正得到,其計算式見式(9)~式(10)。
(9)
(10)
式中:Di,g為氣相綜合擴散系數,m2/s;Di,m和Di,k分別為氣相分子擴散系數和努森擴散系數,可分別通過Fuller公式和分子動理論計算得到[23]。
利用式(8)計算圓柱形催化劑不同尺寸(直徑×高度)時,內擴散阻力對反應表觀反應速率的影響,結果如圖2所示。由圖2可知:在考察的溫度范圍內,裂解反應的Φ2η值遠低于臨界值0.16,說明內傳質阻力對裂解反應速率無明顯的影響,即裂解反應為動力學控制;對于蒸汽重整反應,當催化劑顆粒尺寸從5 mm×5 mm減小至4 mm×3 mm時,內擴散阻力對反應速率仍有影響,但Φ2η值已大幅減小(約50%)。上述結果說明,裂解反應的η近似等于1,而蒸汽裂解反應的η值需要通過顆粒建模計算獲得。蘭閃閃等[24]采用顆粒模擬耦合非均相反應器模型,詳細計算了Cu50Zn30Ce10Al10催化的裂解反應和蒸汽重整反應的有效因子,結果發現沿床層軸向不同位置處的裂解反應的η趨近于1,而蒸汽重整反應的η介于0.5~0.9之間。

圖2 不同尺寸圓柱形催化劑內擴散阻力影響
2 反應器模擬
甲醇重整制氫反應器內涉及化學反應、流體流動、傳質和傳熱的耦合等多重因素,局部催化活性和反應器熱負荷的平衡關系決定著反應器的性能及制氫過程的整體效率。建立固定床反應器數學模型,并與動力學模型耦合,可以探究催化劑活性與反應器結構的匹配關系,進行反應器結構尺寸的優化,實現過程強化。
2.1 反應器數學模型的建立
反應器數學模型的構建以甲醇水蒸氣重整單根列管反應器為研究對象。由于甲醇重整反應吸熱量較大,采用一維模型難以準確描述床層內的溫度分布,故選用二維模型描述反應床層內的反應-傳遞耦合規律。為簡化模型構建,采用以下假設條件:
(1)擬均相假設,催化劑床層均勻且各向同性,床層空隙率與位置無關。
(2)理想氣體假設。
(3)恒定壁溫,模型邊界為反應床層至反應器內壁面。
(4)穩態假設。
(5)原料在反應器入口條件下已完全氣化,所有物料均為氣態。
(6)假設整個床層內DE和SR反應有效因子恒定,不隨床層位置而變化,結合顆粒尺寸優化結果及文獻[24]中有效因子計算結果,當使用催化劑的顆粒尺寸為4 mm×3 mm時,反應器模型中甲醇裂解反應的η取值0.99,甲醇蒸汽重整反應的η取值0.75。
對組分i(CH3OH,H2O,CO,CO2,H2)分別建立物料守恒方程和能量守恒方程,如式(11)~式(12)所示。

(11)

(12)
并采用Ergun公式進行動量守恒計算:
(13)
(14)
計算的邊界條件為:
z=0時,Ci=Ci,0,T=T0。


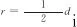
式中:r為床層中任意點到床層中心的徑向距離,m;z為床層中任意點到床層入口的垂直距離,m;Ci為氣相主體中各組分的濃度,mol/m3;ug為氣流線速率,m/s;ρb為床層堆密度,kg/m3;ρg為氣相混合物的密度,kg/m3;Cp,g為氣相混合物定壓摩爾熱容,J/(mol·K);ΔHj為j反應的焓變,J/mol;αw為壁給熱系數,W/(m2·K);λer為床層有效導熱系數,W/(m·K);μg為氣相混合物黏度,Pa·s;G為氣相的質量流速,kg/(m2·s);Ri為組分i消耗或生成的反應速率,mol/(kg·s);dp為顆粒當量直徑,m;di為管內徑,m;ε為床層空隙率,無量綱,可采用式(15)估算得到。
(15)
式中:φ為顆粒球形度,無量綱;dpe為等體積當量直徑,m。

(16)
λe=εpλg+(1-εp)λs
(17)
(18)

αw采用de Wasch等提出的關聯式估算[25],如式(19)~式(20)所示:
(19)
(20)

2.2 模型求解
采用COMSOL Multi-physics 6.1軟件的穩態求解器對2.1部分建立的反應器內物料、熱量和動量傳遞方程進行求解。其中物料衡算采用軟件中的化學模塊和多孔介質中濃物質傳遞模塊描述,熱量衡算采用多孔介質中熱量傳遞模塊描述,動量守恒采用Brinkman方程描述,混合氣體的物性參數以及反應熱等參數采用熱力學模塊進行估算。模型區域采用映射結構化網格,以床層內冷點溫度為指標進行了模型的網格無關性檢驗,結果如圖3所示。由圖3可知,當網格數量超過1 400之后,模擬結果可達到足夠的預測精度。

圖3 網格無關性檢驗結果
2.3 模型驗證
利用文獻[25]中的甲醇蒸汽重整反應器運行數據對所建反應器模型進行驗證,對比結果如表2所示。由表2可知,反應器床層出口溫度(Tout)、甲醇轉化率及出口氣體組成的模擬結果與文獻[25]數據吻合,驗證了反應器模型的可靠性。
3 結果與討論
3.1 催化劑活性與反應器結構匹配性
分布式甲醇制氫裝置需具備小型化和高能效的技術特點,故要求在較高空速下甲醇重整反應器出口仍能達到熱力學平衡轉化率,這對甲醇重整催化劑活性提出了更高的要求。基于此,使用直徑為32 mm的反應管(與傳統工業甲醇制氫反應器內徑一致)模擬了高空速反應條件下催化劑活性對反應器性能的影響。由于分布式甲醇制氫裝置空間限制,在綜合考慮反應器外形尺寸后,反應管床層有效高度(L)按1.6 m進行計算。考慮到分布式甲醇制氫工藝采用變壓吸附法(PSA)進行氫氣提純,旋轉閥PSA要求入口壓力一般不低于1.5 MPa,綜合考慮甲醇重整反應壓力選擇1.7 MPa。
因此,在體積空速 為1.2 h-1、n(H2O)∶n(CH3OH)為1.2、床層入口溫度(Tin)為 250 ℃、反應器壁溫(Twall)為 255 ℃、壓力為 1.7 MPa、反應器直徑為 32 mm的條件下,對比了分別選用文獻[26]報道的動力學參數和基于RSR-501活性校正后的動力學參數時的甲醇轉化率和床層溫度,結果見圖4和圖5。由圖4可知:在商業催化劑作用下,文獻[26]報道的床層出口甲醇轉化率未達到熱力學平衡轉化率,說明該商業催化劑不能滿足分布式甲醇制氫裝置的要求,但該催化劑作用下的反應器床層溫度分布較均勻,這是由于該催化劑活性偏低,在較高反應空速下難以將足夠的甲醇原料轉化,單位體積床層內的熱負荷相對較小,不會造成較大的床層溫差;而采用RSR-501催化劑后,反應在距離床層入口1.2 m處即可達到熱力學平衡,但反應管床層入口處出現了近50 ℃的溫度梯度,且冷點溫度低至205 ℃。上段床層的低溫一方面會降低催化劑利用效率,另一方面會增加氣相中水的冷凝析出風險。

圖4 不同催化劑作用下反應管中心處甲醇轉化率分布模擬值

圖5 不同催化劑作用下反應管內溫度分布二維軸對稱模擬結果
3.2 反應管結構尺寸優化
為提高催化劑利用效率,降低液態水析出的風險,需要在優化催化劑活性的基礎上強化反應管傳熱過程。在保持反應空速不變的前提下,優化反應管內徑,可減小床層徑向熱阻,從而提高反應管的熱流密度[22]。因此,在體積空速為1.2 h-1、Tin為250 ℃、Twall為255 ℃、壓力為1.7 MPa,n(H2O)∶n(CH3OH)為1.2的條件下,分別對反應管內徑為32,25,20 mm時的床層溫度分布和甲醇轉化率分布進行模擬,結果見圖6和圖7。由圖6可知,減小反應管內徑可顯著提高供熱效率,減小床層溫差,當反應管內徑為20 mm時,床層冷點溫度可提高至225 ℃以上。這主要歸因于優化管徑尺寸后αw關聯式[25]中靜態貢獻項的提高,而在空速不變的情況下,動態貢獻項基本不變。另外,床層溫差減小也提高了上部床層催化劑的利用效率,使得原料甲醇更快地達到熱力學平衡轉化率。由圖7可知,當采用內徑為20 mm的反應管時,在床層高度約0.8 m處即可達到熱力學平衡轉化率。

圖6 反應管內徑不同時床層溫度分布二維軸對稱模擬結果

圖7 不同內徑反應管管中心處甲醇轉化率分布模擬值
4 結 論
(1)基于甲醇制氫高效催化劑RSR-501,依據SR-DE反應機理,利用動力學試驗數據校正得到了冪函數型雙速率動力學模型。利用文獻數據驗證模型的可靠性,結果顯示該模型模擬值與試驗數據吻合性良好,說明該動力學模型具有較高的可靠性。
(2)內擴散影響判定結果顯示:在考察的工藝條件下,甲醇裂解反應為動力學控制,而甲醇蒸汽重整反應為擴散控制。將催化劑顆粒尺寸(直徑×高度)從5 mm×5 mm減小至4 mm×3 mm時,反應Φ2η值減小50%,有效強化了顆粒內傳質速率,提高了催化劑表觀活性。
(3)對長度為1.6 m的反應管進行模擬,結果表明:商業催化劑難以滿足加氫站甲醇制氫活性要求,而RSR-501型甲醇制氫催化劑可滿足高空速條件下的床層出口甲醇轉化率要求。對比不同直徑反應管的性能發現,使用內徑為32 mm反應管時床層溫度梯度較大,冷點低至205 ℃;而當反應管內徑為20 mm時,床層冷點溫度可提高至225 ℃以上。這說明,通過優化反應管尺寸,可強化反應管傳熱過程,提高供熱效率,減小床層溫差,提高催化劑利用效率和裝置整體能效。

