可吸收手術(shù)縫合線研究進(jìn)展
楊智超, 劉淑強(qiáng), 吳改紅, 賈 潞, 張 曼, 李 甫, 李慧敏
(太原理工大學(xué) 輕紡工程學(xué)院, 山西 太原 030024)
可吸收縫合線是指在人體內(nèi)外組織或器官出現(xiàn)破損或切口時(shí)用于將傷口進(jìn)行結(jié)扎、止血并且縫合,并在一定周期內(nèi)可以自行被機(jī)體組織吸收,而對人體組織和器官不產(chǎn)生有害影響的一種常見的醫(yī)用紡織品。可吸收手術(shù)縫合線一般在2~6個(gè)月從植入點(diǎn)消失[1],無需拆線等操作,是當(dāng)今國際上外科手術(shù)和臨床應(yīng)用中使用量最大的醫(yī)用紡織品之一,也是當(dāng)今國際生物醫(yī)用紡織領(lǐng)域的研究熱點(diǎn)之一。
縫合線可根據(jù)是否具備生物降解能力分為2類:可吸收縫合線和不可吸收縫合線。不可吸收縫合線在使用過后,無法被機(jī)體組織自行吸收,在傷口痊愈時(shí)需要進(jìn)行二次拆線的操作,這在一定程度上會對患者帶來較大的痛苦,此外,拆線后很大可能會在皮膚表面形成瘢痕,對患者皮膚的美觀程度會造成較大的影響。而可吸收手術(shù)縫合線由于其消除了患者二次拆線的痛苦,成為新一代縫合線中患者的福音,同時(shí),對于情況各異的傷口環(huán)境,在實(shí)際手術(shù)操作中,可以選擇降解時(shí)間不同的縫合線[2]。另外,在實(shí)際手術(shù)過程中,用于閉合組織切口的材料還有許多,例如手術(shù)夾、手術(shù)膠、微孔手術(shù)帶以及螺釘[3]等,但這些材料存在操作時(shí)效過長、組織滲漏、增加感染、引發(fā)瘢痕等問題。
針對不可吸收縫合線與可吸收縫合線的應(yīng)用,有眾多學(xué)者進(jìn)行研究。Lee等[4]通過對英國、愛爾蘭、澳大利亞與新西蘭的各大醫(yī)院的臨床醫(yī)生做出大量調(diào)查評估發(fā)現(xiàn),大部分的醫(yī)生與患者均會選擇使用可吸收縫合線,并提出可吸收縫合線會降低去除縫合線或供應(yīng)相關(guān)的醫(yī)療保健成本。Egbunah等[5]研究了修復(fù)唇裂疾病所用到的幾種材料:可吸收縫合線、不可吸收縫合線、組織黏結(jié)劑,對這幾種傷口閉合材料進(jìn)行評估發(fā)現(xiàn),當(dāng)使用不可吸收縫合線進(jìn)行唇裂修復(fù)時(shí),更有利于傷口愈合,但術(shù)后并發(fā)癥的發(fā)生率明顯較高,綜合比較得出可吸收縫合線總體效果更有利,同時(shí)表明可吸收縫合線擁有較好的閉合傷口能力,較少地發(fā)生傷口滲漏,在消除組織瘢痕,簡化操作方面都有積極作用。
本文就可吸收縫合線的發(fā)展歷程以及縫合線的相關(guān)性能要求,詳細(xì)闡明了構(gòu)成可吸收縫合線的不同材料和分類、國內(nèi)外對于可吸收縫合線的研究進(jìn)展,并對可吸收縫合線在發(fā)展中存在的問題以及未來的發(fā)展趨勢進(jìn)行了分析。
1 發(fā)展歷程及性能要求
1.1 縫合線發(fā)展歷程
人類使用縫合線用來閉合傷口已經(jīng)有4 000多年的歷史[6],但可吸收縫合線的出現(xiàn)是在公元前1800年,就是誕生于亞歷山大的腸線,它是當(dāng)時(shí)唯一可以使用的可吸收縫合線。
隨著合成纖維行業(yè)的逐漸發(fā)展,人工合成類可吸收縫合線登上舞臺。20世紀(jì)60年代初期,國外首次開發(fā)出聚乙醇酸(PGA)可吸收縫合線,商品名為Dexon,在這個(gè)時(shí)期,一種通過化學(xué)交聯(lián)處理,可控制體內(nèi)吸收速率的膠原線也被開發(fā);20世紀(jì)70年代,聚對二氧環(huán)己酮(PDS)可吸收縫合線實(shí)現(xiàn)商業(yè)化,與此同時(shí),國外首次研發(fā)出甲殼素及其衍生物類可吸收縫合線;90年代以來,國外通過對聚乳酸進(jìn)行物理、化學(xué)改性以及優(yōu)化紡絲工藝來提高聚乳酸的各項(xiàng)性能,如Schmack等[7]采用高速熔融紡絲和紡絲拉伸工藝制備出力學(xué)性能優(yōu)異的聚乳酸纖維,從而提高聚乳酸縫合線的韌性和打結(jié)強(qiáng)度。制備可吸收手術(shù)縫合線材料的發(fā)展歷程詳見表1。

表1 可吸收縫合線材料的發(fā)展歷程Tab.1 History of absorbable suture materials
目前市面上主流的可吸收手術(shù)縫合線仍以進(jìn)口為主導(dǎo),大多數(shù)國產(chǎn)可吸收縫合線90%以上是基于進(jìn)口原線貼牌封裝。各大品牌無自主生產(chǎn)原線能力,原線嚴(yán)重依賴進(jìn)口。市場部分可吸收手術(shù)縫合線產(chǎn)品列于表2。
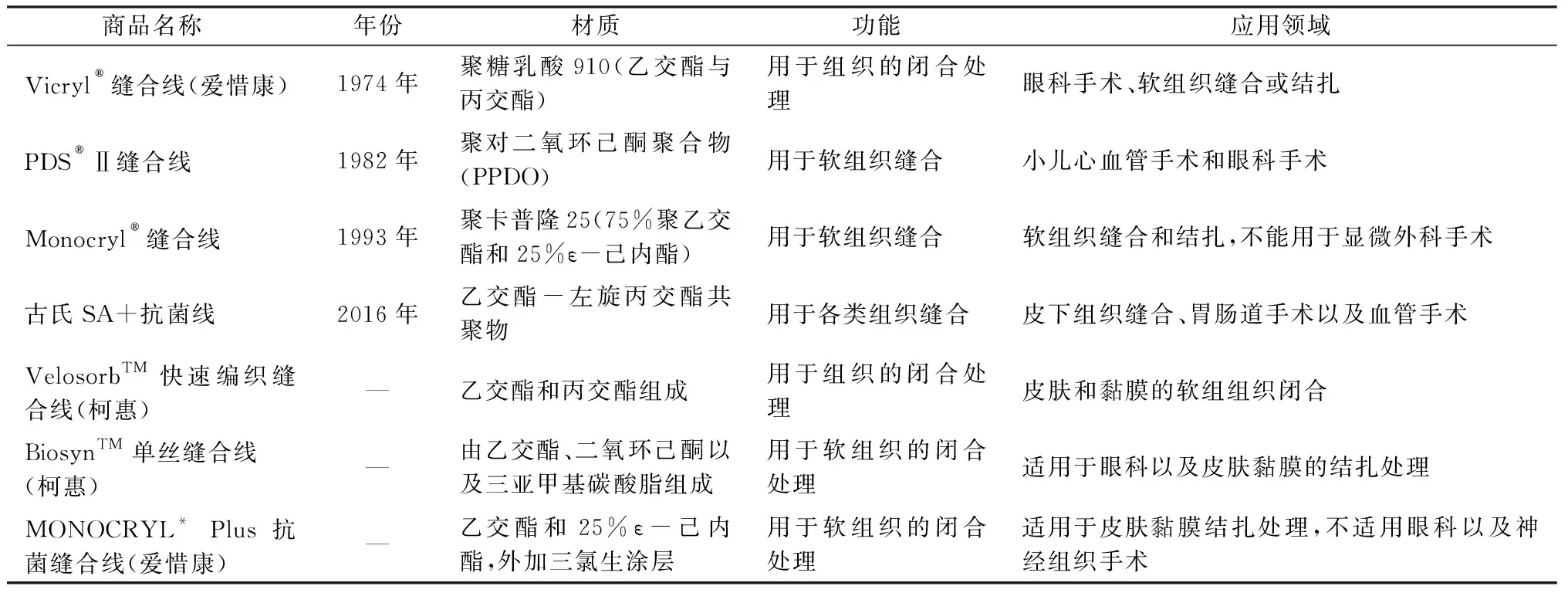
表2 部分市面可吸收手術(shù)縫合線產(chǎn)品Tab.2 Partial commercially available absorbable surgical suture products
1.2 可吸收縫合線性能要求
理想的可吸收縫合線應(yīng)該具備優(yōu)良的力學(xué)性能和生物學(xué)性質(zhì)。在力學(xué)性能方面:縫合線的設(shè)計(jì)應(yīng)該考慮在低應(yīng)變時(shí)具有理想的彈性和彈性模量,還應(yīng)當(dāng)具有較高的抗張打結(jié)強(qiáng)度,在實(shí)際外科手術(shù)操作過程中,以此來適應(yīng)打結(jié)后的縫合線其力學(xué)性能仍能保持在一定范圍內(nèi)的要求。另外,縫合線在被植入組織后,應(yīng)當(dāng)在相當(dāng)長的一段時(shí)間內(nèi)依舊保持其力學(xué)性能不受影響,對于可吸收縫合線,其斷裂強(qiáng)度應(yīng)保持的時(shí)間為1~4周[13]。在生物學(xué)性質(zhì)方面:首當(dāng)其沖的是縫合線應(yīng)當(dāng)具有良好的生物相容性,并不與傷口部位發(fā)生組織反應(yīng),不對細(xì)胞產(chǎn)生毒性,不對傷口部位造成感染風(fēng)險(xiǎn),更不應(yīng)在傷口愈合后,組織部位出現(xiàn)血凝塊、裂口以及細(xì)菌的黏附。另外,最終制備的縫合線應(yīng)不易與外科手術(shù)所使用的橡膠手套過分糾纏,以免增加總耗時(shí)使手術(shù)變得繁瑣,這就需要在選取制備縫合線材料時(shí)和在后整理上考慮,以增加縫合線的表面光滑度。王成芳[14]選用硬脂酸鈣為涂層劑,通過對未涂層的聚乙交酯可吸收編織縫合線與涂層后的縫合線作對比,發(fā)現(xiàn)編織線表面涂層后,能夠增加表面的潤滑性,使縫合線表面光滑平整,從而使縫合線能夠平滑地通過人體組織,以此保護(hù)整個(gè)手術(shù)順利進(jìn)行并減少病人痛苦。
在開發(fā)可吸收手術(shù)縫合線時(shí),應(yīng)當(dāng)牢牢把握縫合線的操作性能要求,通常在力學(xué)性能方面,學(xué)者應(yīng)當(dāng)側(cè)重于縫合線原材料的選取,在保證斷裂強(qiáng)力符合標(biāo)準(zhǔn)的同時(shí),還要增加其斷裂伸長率,以此來適配縫合線應(yīng)有的柔韌性。聚乳酸長絲直接制備出的縫合線存在柔韌性不足的缺點(diǎn),朱斐超等[15]通過綜述關(guān)于聚乳酸母粒改性的相關(guān)內(nèi)容,總結(jié)出一系列能夠紡制增強(qiáng)增韌性能的聚乳酸長絲,以此制備手術(shù)縫合線,另外,對纖維進(jìn)行改性也可改變縫合線原材料的力學(xué)性能;在生物學(xué)性質(zhì)方面,最重要的是要確定原材料的無毒害性,其次要考慮其生物相容性,以此來使縫合線穿入組織后擁有良好的細(xì)胞黏附性,以加快傷口的愈合。
2 可吸收縫合線分類及其應(yīng)用
2.1 天然可吸收縫合線
2.1.1 羊腸線
羊腸線作為人類歷史上誕生的第1類可吸收縫合線,已經(jīng)有上千年的歷史,在相當(dāng)長一段時(shí)間內(nèi)被用作閉合傷口的材料。
天然羊腸線的材料來源是綿羊、牛、袋鼠、馬或騾等動物的腸絨毛膜,在去除脂肪和其它多余組織后,通過鉻鹽、甲醛、明礬等弱交聯(lián)劑對羊腸線進(jìn)行處理,然后將1~5根腸線并合拉伸加捻,最終制成不同數(shù)量的股線,它可被人體吸收,制作工藝流程簡單,成本低廉,但同時(shí),羊腸線也存在一些缺點(diǎn),如打結(jié)強(qiáng)度較差,降解速率過快等,針對此類問題,可將加捻后的羊腸線經(jīng)過打磨處理,并將其浸泡于堿性溶液中,可以適當(dāng)增加其韌性,此外,羊腸線可以抵抗身體中酶的分解,從而具備有比普通腸線長約2倍降解時(shí)間的性能并且還擁有較好的抗拉強(qiáng)度。另外,在外科手術(shù)操作過程中,羊腸線易引發(fā)組織反應(yīng),從而造成傷口部位的感染(SSI,surgical site infection),加碘腸線在一定程度上可以緩解繼發(fā)感染的發(fā)生。
近五年來,腸線不單單被用于縫合傷口,有較多學(xué)者利用腸線的可吸收性來研究穴位埋羊腸線的方法,用于治療諸多疾病,如Xu等[16]利用填埋羊腸線的方法改善機(jī)體免疫能力,從而達(dá)到抑制肝癌細(xì)胞生長的目的;王鳴等[17]研究了不同長度羊腸線通過穴位埋線的方法治療肥胖癥的效果對比,對于單純性肥胖病患者進(jìn)行穴位埋線治療,可有效降低體脂率,并且穴位埋線療法具有療程短、操作便捷、對患者的傷害較小等特點(diǎn)。
2.1.2 膠原線
膠原線是從一些哺乳動物體內(nèi)提取出骨骼或筋腱,經(jīng)過煮煉等工序處理提取出其中的膠原蛋白,之后通過紡紗工藝制成的一種可吸收縫合線。膠原線與羊腸線最大的區(qū)別在于膠原線與人體組織的相容性較好,不會產(chǎn)生較大的排斥反應(yīng)[18],膠原線具有天然絲的優(yōu)異力學(xué)性能,滿足外科手術(shù)中的打結(jié)強(qiáng)度等力學(xué)指標(biāo),并具有手術(shù)縫合線應(yīng)有的平滑度,和較好的彈性,又有利于人體吸收。
可吸收縫合線植入人體后,其降解速率是一個(gè)非常重要的指標(biāo)。對于膠原線而言,可以采用化學(xué)交聯(lián)的方式來調(diào)節(jié)分子的交聯(lián)程度,從而達(dá)到控制膠原線降解速率的目的。溫永堂等[19]利用交聯(lián)劑與膠原蛋白進(jìn)行交聯(lián),進(jìn)而制備膠原可吸收縫合線,并研究了縫合線的力學(xué)性能與交聯(lián)劑濃度的關(guān)系。此外,膠原蛋白縫合線在骨科[20]等I、II類手術(shù)切口縫合[21]的應(yīng)用都很廣泛,并且縫合效果好,后期愈合效果和平整度好,傷口瘢痕少,術(shù)后切口的疼痛感輕。Zhang等[22]回顧性分析了2021年1月—2022年1月在整形外科632例面創(chuàng)兒童患者的診治痊愈形況,其中采用可吸收膠原線458例,不可吸收錦綸線174例。采用可吸收膠原線和美容縫合技術(shù)治療面部緊急創(chuàng)傷患兒傷口,傷口愈合良好,疤痕擴(kuò)張小,紅斑和色素異常發(fā)生率低,無明顯手術(shù)痕跡,無瘢痕肥大或萎縮。總體印象良好,避免了兒童患者拆線的痛苦,家屬滿意度高。盡管如此,膠原線還是存在一些缺點(diǎn),如強(qiáng)度和降解速率不穩(wěn)定,耐加工性差等。近年來,有學(xué)者擴(kuò)大原料研究范圍,從源頭上解決了傳統(tǒng)膠原蛋白強(qiáng)度不高等缺點(diǎn)的限制,發(fā)明出新型膠原蛋白類手術(shù)縫合線。Luan等[23]利用魚鰾,通過擇取魚鰾中的纖維組織膜,并去除附著的脂肪黏膜和血管,之后再分離細(xì)胞內(nèi)層膜制備出一種脫細(xì)胞交聯(lián)的單鏈魚鰾(DCSS)縫合線,魚鰾作為魚源性膠原蛋白,獨(dú)具其本身的優(yōu)勢特點(diǎn),即組織相容性極佳,強(qiáng)韌度較高,另外還具備傳統(tǒng)哺乳動物膠原蛋白的優(yōu)點(diǎn),完全滿足縫合應(yīng)用的強(qiáng)度,無菌性,吸收性,組織相容性和多功能性等關(guān)鍵參數(shù)。
2.1.3 甲殼質(zhì)
甲殼質(zhì)又稱甲殼素、幾丁質(zhì),殼聚糖則是甲殼素脫除乙酰基的產(chǎn)物,被認(rèn)為是比纖維素具有更大應(yīng)用潛力的功能性生物材料[24]。以甲殼質(zhì)為原料制備的縫合線具有很好的生物相容性,化學(xué)惰性,極低的組織反應(yīng),此外,甲殼質(zhì)本身具有良好的抗菌性能,能夠?qū)Ω腥镜膫谶M(jìn)行殺菌消炎,從而加快傷口愈合,甲殼質(zhì)縫合線在體內(nèi)的降解速率為25 d左右,可完全被組織吸收,在膽汁,尿液,胰腺炎中的抗拉強(qiáng)度高于Dexon和羊腸線[25],甲殼質(zhì)中的乙酰基數(shù)量決定甲殼質(zhì)縫合線降解速度,其數(shù)目越少,降解速度越快[26]。在甲殼質(zhì)可吸收縫合線的研究初期,普遍采用濕法紡絲工藝,東華大學(xué)實(shí)現(xiàn)了甲殼素纖維利用編織和加捻工藝制備甲殼質(zhì)可吸收縫合線[27],性能較好,可應(yīng)用于臨床使用。
力學(xué)性能是評估手術(shù)縫合線極為重要的指標(biāo)之一,因此海內(nèi)外眾多學(xué)者通過不同方法來加強(qiáng)縫合線的力學(xué)性能。Wu等[28]通過細(xì)菌纖維素納米晶體(BCNC)強(qiáng)化再生甲殼素纖維(RC),開發(fā)出一種制備縫合線的新型材料,結(jié)果顯示,制備的縫合線抗拉強(qiáng)度為(9.8±0.6)N,其降解速率也可通過對BCNC的濃度進(jìn)行調(diào)節(jié),表明細(xì)菌纖維素的加入有效地提高了產(chǎn)品的力學(xué)性能并對細(xì)胞增殖有促進(jìn)作用。Tan等[29]通過堿性處理和超聲降解,從魷魚軟骨中制備了一系列具有不同脫乙酰化程度和黏均分子量的超高分子質(zhì)量殼聚糖,并通過濕紡工藝制備了相應(yīng)的殼聚糖單絲以作為縫合線的制備原料,結(jié)果顯示脫乙酰化程度為85%、黏均分子量為1.16×106時(shí)表現(xiàn)出最佳的力學(xué)性能,干/濕抗拉強(qiáng)度為38.96 N/23.24 N,干/濕伸長率為14.6%/16.2%。
抗菌型可吸收縫合線因其靶向施藥,可控釋放等優(yōu)點(diǎn),近年來被廣泛研究。而殼聚糖天然的抗菌性也成為許多開發(fā)新型縫合線首選的材料。Zhang等[30]開發(fā)出殼聚糖-明膠/單寧酸/聚吡咯復(fù)合涂層并修飾于縫合線表面,當(dāng)皮膚產(chǎn)生傷口時(shí),周圍完好皮膚會產(chǎn)生電場并向傷口中心移動,而此時(shí)的電信號傳輸會有效調(diào)節(jié)細(xì)胞行為,包括黏附、增殖、遷移和分化,從而加速傷口愈合。聚吡咯是常見的導(dǎo)電聚合物,具有優(yōu)異的導(dǎo)電性能以及生物相容性,殼聚糖充當(dāng)抗菌劑,以此開發(fā)出具有電活性和抗菌性能的功能性可吸收縫合線。此研究為探索新一代生物活性縫合線提供了新思路。
2.1.4 海藻酸鹽
海藻酸鹽又稱海藻酸膠,是一種由β-D-甘露糖醛酸和α-L-古羅糖醛酸2種結(jié)構(gòu)單元組成的多聚糖。海藻酸鹽為原料制成的可吸收手術(shù)縫合線具有極好的吸濕性、凝膠性,抗菌性和生物相容性,高透氧性以及可降解性。
Harpe等[31]制備了一種新型的生物可吸收縫合線并能進(jìn)行局部藥物輸送。縫合線由海藻酸鈉、果膠、和明膠組成,后整理工藝選擇甘油作為塑化劑。由于海藻酸鹽能夠在各種多價(jià)陽離子存在下瞬時(shí)交聯(lián),而這種直接的交聯(lián)過程避免了使用無機(jī)溶劑,也不會改變生物聚合物結(jié)構(gòu)固有的生物相容性,體外分析顯示,藥物持續(xù)釋放至第28天完成,表現(xiàn)出優(yōu)異的緩釋性能,另外,所制備的縫合線可安全地降解并被機(jī)體吸收;Huang等[32]將陽離子聚電解質(zhì)ε-聚賴氨酸(PL)和陰離子天然多糖海藻酸鈉(SA)混合制備成SA/PL混合液,該混合液可自行通過靜電組裝的形式在接觸界面形成SA/PL復(fù)合膜,并可直接通過鑷子即從溶液中拉取得到復(fù)合長絲,在室溫下干燥后便得到成品縫合線。力學(xué)性能表征顯示,隨著PL含量的增加,SA/PL纖維的斷裂伸長率變低,而抗拉強(qiáng)度變高并且該復(fù)合纖維的尺寸可控。小鼠實(shí)驗(yàn)以及抗菌等實(shí)驗(yàn)結(jié)果顯示,SA/PL復(fù)合纖維可通過抵抗病原體感染、減少炎癥、抗傷口的異體過敏來促進(jìn)小鼠背部皮膚傷口的愈合和修復(fù)。該研究提供了一種全新制備可吸收縫合線的新方法新思路,并且該研究的制備工藝過程安全綠色無污染。
海藻酸鹽還多被用于功能涂層整理劑來改善縫合線的相關(guān)性能。Selvaraju等[33]利用海藻酸鈉的高度水溶性充當(dāng)固化劑,并將其與乙醇蜂膠提取物合成的銀納米顆粒相結(jié)合,通過上漿浸漬技術(shù)將蜂膠銀納米顆粒涂覆在手術(shù)縫合線上。體外抗菌分析表明,蜂膠銀納米顆粒涂層縫合線對臨床致病微生物具有顯著的抗菌活性;Lauren等[34]通過制備一種纖維素納米纖維與海藻酸鹽復(fù)合的水凝膠涂層整理材料(NFCA),將其涂覆于3-0號可吸收手術(shù)縫合線,以增強(qiáng)細(xì)胞黏附性和活性能夠,從而加快傷口的愈合。
2.2 合成類高分子可吸收縫合線
2.2.1 聚乳酸類縫合線
聚乳酸(PLA)作為新世紀(jì)最有潛力的生物醫(yī)用材料之一,已經(jīng)被廣泛開發(fā)為各種基聚乳酸材料的生物醫(yī)用品,尤其在手術(shù)縫合線方面,因其優(yōu)異的可降解性,良好的生物相容性,無毒性,優(yōu)良的力學(xué)性能,聚乳酸被視為制備手術(shù)縫合線最為理想的材料之一。
聚乳酸雖然具備降解性能,但是作為手術(shù)縫合線而言,純聚乳酸的降解速度過于緩慢且難以控制,對于傷口的閉合恢復(fù)不是很靈活,另外,聚乳酸天然結(jié)晶困難而表現(xiàn)出脆性較大,導(dǎo)致其作為縫合線的韌性無法滿足要求。Wu等[35]制備了一種聚乳酸(PLLA)和聚己內(nèi)酯(PCL)涂覆的聚二氧六環(huán)酮(PDO)縫合線,掃描電子顯微鏡(SEM)觀察發(fā)現(xiàn),涂層后的縫合線表面光滑,體內(nèi)研究表明縫合線涂層后,其降解特性發(fā)生了明顯變化。未涂層的縫合線在12周內(nèi)表現(xiàn)出最快的降解,顯示出力學(xué)強(qiáng)度的明顯下降。經(jīng)涂層的縫合線在植入12周后能夠保持20%以上的原始拉伸強(qiáng)度。張曉芳[36]開發(fā)出一種釋藥可控聚乳酸手術(shù)縫合線,采用PCL和PGA 2種降解速率不同的生物降解材料,通過調(diào)節(jié)組分配比,配制成載藥涂層整理液,針對情況不同的傷口,可選擇釋藥速率、釋藥周期不同的縫合線處理傷口。劉明芳等[37]利用脂肪酶處理縫合線,使表面羥基數(shù)量增多,然后接枝殼聚糖,結(jié)果顯示明顯改善了聚乳酸手術(shù)縫合線的親水性。劉淑強(qiáng)等[38]開發(fā)了載藥微球聚乳酸手術(shù)縫合線,首先采用乳化-溶劑揮發(fā)法成功制備了聚乳酸載藥微球,然后通過黏合劑醋酸淀粉將微球牢固負(fù)載于縫合線上,釋藥期達(dá)到8 d,達(dá)到良好的藥物緩釋效果。并且處理后的縫合線也保持了優(yōu)良的柔韌性和力學(xué)強(qiáng)度。
2.2.2 聚乙醇酸類縫合線
聚乙醇酸(PGA)具有優(yōu)良的力學(xué)性能、生物相容性、生物可降解性,無毒性且組織反應(yīng)小。PGA的分子間氫鍵作用力強(qiáng),分子鏈結(jié)構(gòu)高度規(guī)整,結(jié)晶度較大,一般為46%~52%。1970年,美國公司發(fā)布商品名為Dexon的PGA可吸收縫合線,是在腸線之后最為普遍商業(yè)化的縫合線[39]。
近五年關(guān)于PGA類縫合線國內(nèi)外報(bào)道較少,PGA天然降解速度過快,純PGA制備的縫合線不足以在一定時(shí)間內(nèi)為傷口提供相應(yīng)的力學(xué)支撐,因此,已有的關(guān)于PGA縫合線的研究是利用PGA材料降解速度快這種特性改善現(xiàn)有縫合線的降解性能,多作為涂層劑和載藥載體應(yīng)用于縫合。載藥縫合線的藥物釋放時(shí)間應(yīng)與傷口愈合時(shí)間保持一致,因此對縫線釋藥速率的調(diào)整就顯得尤為重要。Liu等[40]應(yīng)用聚己內(nèi)酯(PCL)和聚乙二醇(PGA)這2種具有不同降解率的可降解聚合物來負(fù)載茶多酚(TP)藥物,主體縫合線選用聚乳酸(PLA)材料進(jìn)行制備。通過調(diào)整PCL/PGA的組分配比,以此來調(diào)節(jié)藥物的釋放速率和釋放時(shí)間且縫合線的藥物釋放率在早期較快,后期較慢。另外,隨著藥物載體中PCL的增加,縫合線的抗張強(qiáng)度逐漸增加。當(dāng)PCL/PGA質(zhì)量比為70/30時(shí),縫合線的斷裂伸長率達(dá)到最高。Marimallappa等[41]通過對62名患者使用2種不同類別的縫合線:絲綢縫合線和PGA縫合線,在縫合處理一段時(shí)間后對比,發(fā)現(xiàn)PGA類縫合線相對于絲綢類縫合線表現(xiàn)出較低的細(xì)菌黏附,而絲綢類縫合線表現(xiàn)出較高的好氧性細(xì)菌黏附,結(jié)果表明,較少的細(xì)菌黏附和可吸收的PGA縫合線是口腔內(nèi)手術(shù)的更好選擇。
2.2.3 聚己內(nèi)酯類縫合線
聚己內(nèi)酯(PCL),又稱聚ε-己內(nèi)酯。PCL具有優(yōu)異的生物降解性和良好的生物相容性,并且具有優(yōu)良的有機(jī)高聚物相容性,可作為細(xì)胞生長的載體,不會與組織發(fā)生不良反應(yīng),在自然環(huán)境下6~12個(gè)月即可完全降解。此外,PCL具有較好的溫控性質(zhì),可以開發(fā)多種具有良好形狀記憶的產(chǎn)品。PCL已被廣泛應(yīng)用于生物醫(yī)用方面,尤其在縫合線的開發(fā)制備,成為最熱門的應(yīng)用材料之一。
Jing等[42]通過雙螺桿擠出機(jī)將熱塑性聚氨酯(TPU)和聚ε-己內(nèi)酯(PCL)進(jìn)行熔融復(fù)合,發(fā)現(xiàn)含有25%的TPU和75%的PCL的混合物具有最好的形狀記憶特性,其形狀固定率為98%,形狀恢復(fù)率為90%。最終制備出具有形狀記憶的手術(shù)縫合線,室溫下保持臨時(shí)形狀,在熱水浴中只需2 s即可自行打結(jié)。余璠[43]通過浸漬涂層法將聚己內(nèi)酯負(fù)載鹽酸川芎嗪作為藥物緩釋系統(tǒng)涂覆于PGA基編織縫合線上,制備出藥理與物理雙重刺激共存的載藥埋植線,埋線隨著 PCL 濃度的增大,涂層次數(shù)的增多,主體縫線的宏觀編織結(jié)構(gòu)趨于光滑。Hu等[44]通過靜電紡制備聚己內(nèi)酯(PCL)纖維,并與膠原蛋白(COL)和生長因子(bFGF)結(jié)合,以制備bFGF-COL/PCL縫合線,顯微觀察縫合線的纖維微觀結(jié)構(gòu)整齊度良好、并且具有較好的力學(xué)性能,bFGF-COL/PCL縫合線通過加速肉芽組織形成、膠原蛋白沉積和再上皮化,顯著促進(jìn)不同階段的傷口愈合。
2.2.4 聚乙烯醇類縫合線
近年來,聚乙烯醇(PVA)在生物醫(yī)用材料領(lǐng)域十分熱門,醫(yī)用型聚乙烯醇的安全性極高,對人體無害無毒副作用,具有優(yōu)異的生物可降解性和生物相容性,廣泛被制備成人工腎膜等藥用膜。
Lee等[45]開發(fā)了一種藥物釋放電子縫合系統(tǒng)(DRESS)以實(shí)時(shí)監(jiān)測縫合的完整性及傷口情況,能夠?qū)崿F(xiàn)連續(xù)的應(yīng)變監(jiān)測和熱通量控制并通過觸發(fā)藥物釋放增強(qiáng)組織再生。該系統(tǒng)由“殼-芯”結(jié)構(gòu)組成,芯層由銀納米粒子嵌入到聚氨酯多絲纖維中構(gòu)成,銀納米粒子的高導(dǎo)電性賦予整個(gè)縫合系統(tǒng)的高導(dǎo)電性;殼層由柔性聚乙烯醇接枝到聚(N-異丙基丙烯酰胺)組成一種熱膨脹涂層,該涂層在溫度變化時(shí)顯示出良好的膨脹和脫泡行為,從而使其適用于藥物輸送,以便按需釋放。Ranjbar等[46]通過對噴靜電紡技術(shù)制備聚乳酸(PLA)/鹽酸四環(huán)素(T)-聚乙烯醇(PVA)/殼聚糖(CS)納米纖維。將CS/PVA紡絲液從一個(gè)注射器噴出,PLA/T紡絲液從另一個(gè)注射器噴出,之后將收集好的復(fù)合納米纖維進(jìn)行加捻來制備縫合線,另外,鹽酸四環(huán)素的加入可以改善縫線的親水性,但其使用量超過2 g/d時(shí)將會引起肝毒性。抗菌實(shí)驗(yàn)顯示縫線對金黃色葡萄球菌和大腸桿菌顯示出理想的抗菌效果,并能有效防止細(xì)菌的附著。
2.3 抗菌免疫新型可吸收手術(shù)縫合線
盡管現(xiàn)代醫(yī)療保健水平取得了重大進(jìn)展,但對于外科手術(shù)部位的感染問題仍然對術(shù)后傷口的護(hù)理和痊愈構(gòu)成嚴(yán)重威脅。對于大部分傷口出現(xiàn)的感染問題,臨床通用的做法是口服抗生素類藥物施藥全身,此行為會直接對體內(nèi)部分臟器官造成影響,且間接治療傷口炎癥,長期服用不僅會使受損組織產(chǎn)生耐藥性,還會極大地威脅人體安全健康,因此,對于傷口處的抗菌處理,應(yīng)當(dāng)對其進(jìn)行靶向釋藥,此手段能夠高效地緩解傷口的感染問題。Otto等[47]通過29項(xiàng)隨機(jī)對照研究的meta分析發(fā)現(xiàn),三氯生抗菌涂層的手術(shù)縫合線顯著降低了術(shù)后感染率(24%)。另外,隨著手術(shù)縫合線的更新?lián)Q代,擁有越來越高附加值的抗菌型可吸收手術(shù)縫合線也相繼問世,目前賦予手術(shù)縫合線抗菌性能也成為當(dāng)今縫合線研究不可或缺的一部分。
納米涂覆是當(dāng)今制備抗菌型手術(shù)縫合線較為熱門的方法之一,將選定的抗菌性物質(zhì)加工成為納米顆粒,隨后通過涂層、沉積以及吸附等方法與縫合線相結(jié)合,賦予縫合線抗菌性能。Mehmet等[48]利用低溫真空沉積的方法,將納米銀均勻涂覆在聚乙醇酸類可吸收手術(shù)縫合線上,抗菌實(shí)驗(yàn)結(jié)果顯示,在溫度為200 K和300 K環(huán)境下進(jìn)行銀涂層的縫合線周圍可以看到明顯的細(xì)菌生長抑制區(qū),證明了此縫合線的滅菌效果良好,在預(yù)防手術(shù)感染和消除感染方面具有顯著優(yōu)勢。該研究提出了一種銀包覆抗菌生物材料在臨床應(yīng)用中的新方法,此外,也表明可通過低溫下的真空沉積來制備量子效應(yīng)的縫合線,但縫合線力學(xué)性能研究提出,在溫度300 K時(shí)涂覆銀離子的手術(shù)縫合線抗張強(qiáng)度明顯下降,發(fā)生了應(yīng)變惡化的現(xiàn)象,力學(xué)性能不能很好地保持。Sunitha等[49]開發(fā)出一種鹽酸環(huán)丙沙星(CPH)負(fù)載的金納米顆粒(CPG-NPs),然后通過吸附的手段將其結(jié)合到手術(shù)縫合線上,最終使用海藻酸鈉通過離子交聯(lián)進(jìn)行強(qiáng)化,作為縫線的剛性涂層。抗菌實(shí)驗(yàn)顯示,CPG-NPs縫合線的抑菌區(qū)為CPH包覆的縫合線抑菌區(qū)的2倍,此外,由于金納米顆粒的存在,使得CPH的負(fù)載面積大幅增加,從而使CPG-NPs縫合線的抗菌活性更強(qiáng),釋藥時(shí)間可持續(xù)72 h。該研究提出了一種新型手術(shù)縫合線的抗菌作用機(jī)制,能夠增加藥物的負(fù)載量并且可以在一定時(shí)間內(nèi)持續(xù)釋放藥物,對于縫合傷口管理模式提供了新思路。
3 結(jié)束語
醫(yī)用手術(shù)縫合線已成為當(dāng)今醫(yī)療行業(yè)不可或缺的一部分,而可吸收類(可降解)手術(shù)縫合線依據(jù)其優(yōu)異的性能也勢必將取代非吸收手術(shù)縫合線成為外科醫(yī)療手術(shù)中的主角,雖然其發(fā)展日趨成熟,但仍存在一些問題,具體如下:
1)天然類可吸收手術(shù)縫合線的相關(guān)研究較少,初代的天然可降解縫線如羊腸線存在力學(xué)性能差,易引發(fā)組織細(xì)胞反應(yīng)等不良機(jī)體反應(yīng);天然甲殼素纖維的生物相容性好,不易引發(fā)組織反應(yīng)并且還有天然的廣譜抗菌性能,成為當(dāng)今研究手術(shù)縫合線的熱點(diǎn)材料之一,但多數(shù)研究方向?qū)ぞ厶亲鳛楣δ苄钥咕繉油扛灿诳p合線的表面,以增加抗菌性能,而在縫合線的制備方面,采用甲殼素纖維進(jìn)行組裝的研究甚少。
2)合成類可降解材料成為近二三十年來開發(fā)新型手術(shù)縫合線的熱門材料,隨著科技的進(jìn)步與發(fā)展,越來越多的具備優(yōu)異性能的合成高分子材料將用于手術(shù)縫合線的開發(fā),但大多數(shù)的合成材料的降解速率及時(shí)間不可控,傷口的愈合程度應(yīng)與縫合線的降解程度相互匹配,若縫合線的降解過快,會導(dǎo)致傷口愈合遲滯并繼發(fā)感染,若縫合線的降解過慢,則會在皮膚表面留下瘢痕,因此,對于縫合線的降解可控顯得尤為重要。
3)負(fù)有抗菌性的可吸收縫合線仍是當(dāng)今乃至未來的研究主題,如何將抗菌性物質(zhì)穩(wěn)定均勻長效的負(fù)載到縫合線上仍是一大難題,雖有學(xué)者在不斷創(chuàng)新開發(fā)各種抗菌縫合線,但市售的抗菌類可吸收縫合線仍以進(jìn)口為主導(dǎo)。
目前為止,我國可吸收類縫合線的相關(guān)研究仍處于實(shí)驗(yàn)室階段,在實(shí)際產(chǎn)業(yè)化中仍然存在瓶頸并亟待解決,比如質(zhì)量穩(wěn)定性不夠?qū)е碌牧W(xué)性能欠佳,高檔次的可吸收縫合線沒有自主知識產(chǎn)權(quán)等,因此在未來的研究中,應(yīng)當(dāng)在提高可吸收縫合線附加值的同時(shí)考慮縫合線的勻質(zhì)化。

