基于天冬氨酸轉氨酶-血小板計數比的列線圖模型對肝細胞癌射頻消融治療后復發的預測價值
季亞香,奚 靜,劉春艷,吳 萍,章曉蘭,宋 蒨
手術切除和肝移植是肝細胞癌(hepatocellular carcinoma,HCC)的主要治療方式。近年來,B 超或CT引導下射頻消融(radiofrequency ablation,RFA)成為了一種可替代的新型治療方法。研究表明,RFA 與手術切除對早期HCC 的療效相似[1-3]。但RFA 治療后腫瘤復發仍然是亟待解決的問題。尋找敏感、可靠的預測標志物對降低HCC 復發具有重要的意義。除了腫瘤數量、腫瘤大小等生物學特征外,全身炎癥反應與肝功能狀況也與HCC 復發及預后密切相關。有學者提出,血清天冬氨酸轉氨酶(AST)與血小板計數(PLT)比值指數(AST-platelet ratio index,APRI)可作為慢性肝炎患者HCC 進展的風險預測因子[4-5]。有研究報道,術前APRI 與HCC 肝切除術后并發癥及肝功能衰竭有關,APRI 是接受手術治療的HCC 患者一項有價值的預后標志物[6-10]。本研究探討APRI 與RFA 后HCC 復發的關系,并基于APRI 與腫瘤生物學特征開發了預測HCC 復發的列線圖模型,以幫助臨床醫生制定個性化治療策略。
1 材料與方法
1.1 研究對象
納入2017 年1 月至2020 年12 月江蘇大學附屬武進醫院初診為HCC 并接受RFA 作為一線治療的患者204 例,年齡為(57.4±11.2)歲,男139 例(68.1%),女65 例(31.9%)。納入標準:①經影像學證實無血管侵犯或肝外遠處轉移;②肝功能Child-Pugh A 級或B 級;③無HCC 治療史,包括手術切除、經導管肝動脈化療栓塞、系統化療等。排除標準:①消融不完全者;②復發性HCC;③伴有其他未控制的血液系統疾病或惡性腫瘤;④臨床病理資料缺失或失訪者。本研究經醫院醫學倫理審查委員會批準,所有患者在RFA 治療之前均簽署書面知情同意書。
1.2 數據收集與定義
通過醫院電子病歷系統收集患者資料,包括年齡、性別、HBV/HCV 感染史、肝硬化、肝功能Child-Pugh 分級、腫瘤個數、腫瘤最大直徑、實驗室檢查指標(AST、ALT、Alb、TBil、PLT、AFP)等。
APRI 主要基于血清AST 與PLT 獲得,計算公式:APRI=[AST(U/L)/正常值上限(U/L)]/PLT(×109/L)。血清白蛋白-膽紅素分級(ALBI) 計算公式:ALBI=lg[血清總膽紅素值(μmol/L)]×0.66-血清白蛋白(g/L)×0.085。ALBI 分級標準[11],1 級:ALBI≤-2.60,2 級:-2.60<ALBI<-1.39,3 級:ALBI ≥-1.39。
1.3 RFA 治療與隨訪
采用MedSphere 公司S-1500 型射頻消融儀,消融功率為90~200 W,消融時間10~15 min。理想的消融邊緣應完全覆蓋腫瘤及腫瘤周圍邊緣超過0.5 cm,病灶消融治療后立即行增強CT 掃描,確認病灶是否已完全消融,如果有腫瘤殘余則補充消融治療,以實現對病灶的完全消融。
RFA 術后前兩年內每3 個月對患者隨訪1 次,之后每6 個月隨訪1 次,直至觀察到腫瘤復發或末次隨訪為止。每次隨訪內容包括肝膽脾超聲、腹部強化CT 或肝臟磁共振成像(MRI)以及實驗室檢查,如血常規、肝功能、血清AFP 等。主要觀察結果為無復發生存期(recurrence-free survival,RFS),即以患者首次接受RFA 治療的時間為起點,至出現HCC 復發的時間段。截止末次隨訪時仍無復發者定義為刪失。HCC 復發包括局部腫瘤進展、肝內復發和肝外轉移,所有復發患者均通過肝臟強化CT 或MRI 掃描證實。
1.4 統計學方法
采用SPSS 24.0 軟件處理數據,R 4.2.1 軟件用于列線圖模型的構建與校正曲線的繪制。正態分布的計量資料以均數±標準差表示,比較采用獨立樣本t檢驗,偏態分布的計量資料以中位數及四分位數間距表示,比較采用Mann-WhitneyU檢驗。計數資料以例數(%)表示,比較采用χ2檢驗或Fisher’s精確檢驗。通過受試者工作特征(receiver operation characteristics,ROC)曲線確定APRI 預測HCC 復發的最佳截斷值,采用Kaplan-Meier 法繪制生存曲線并計算中位RFS。Cox 回歸分析RFA 治療后HCC復發的影響因素,并選擇模型中的顯著變量建立列線圖。P<0.05 為差異有統計學意義。
2 結果
2.1 研究對象的一般特征
204 例患者中,150 例(73.5%)有HBV/HCV 感染,149 例(73.0%)伴有肝硬化,腫瘤最大直徑為(1.91±0.84) cm,AST 為63.0(42.0~91.0) U/L,ALT 為48.0(34.0~69.0) U/L,血小板計數為(182.9±81.7)×109/L,血清總膽紅素為(16.5±8.0) μmol/L,血清白蛋白為(38.1±4.5)g/L。隨訪時間為18.2(11.1~26.2) 個月,RFA 后HCC 復發117 例(57.4%),其中1 年內復發77 例,2 年內復發108 例。APRI 預測HCC 復發的最佳截斷值為0.501,APRI 的曲線下面積(area under curve,AUC)為0.678 (95%CI:0.603~0.752),診斷敏感度為71.8%,特異度為54.0%。
復發與無復發組患者基線特征比較見表1。與無復發組相比,復發組腫瘤直徑更大、AFP 和AST更高、白蛋白更低、ALBI 分級和APRI 更高。兩組患者的性別、年齡、HBV/HCV 感染、肝硬化、肝功能Child-Pugh 分級等差異無統計學意義(P>0.05)。
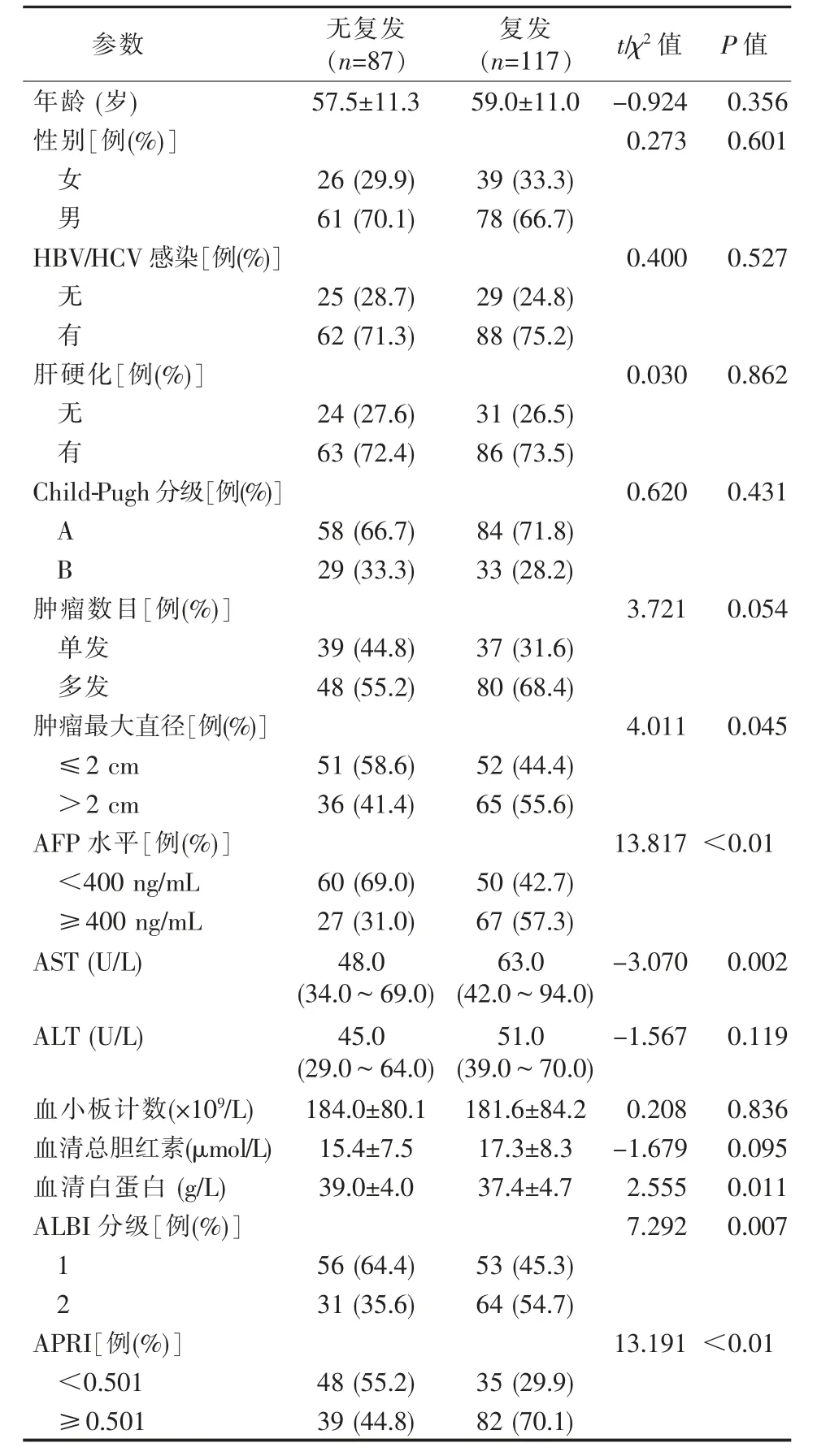
表1 射頻消融后復發與無復發患者的基線特征比較
2.2 RFA 治療后HCC 復發的影響因素
全組患者的中位RFS 為16.0 個月(95%CI:11.7~20.5),1 年、2 年和3 年RFS 率分別為57.1%、40.4%和31.2%。根據APRI 的最佳截斷值將所有HCC患者分為高APRI 組(≥0.501)121 例,低APRI 組(<0.501)83 例。生存曲線顯示,高APRI 組患者中位RFS 為11.5 個月(95%CI:6.9~15.1),低APRI 組患者中位RFS 未達到,差異有統計學意義(χ2=12.929,P<0.01),見圖1①。此外,高ALBI 分級亦與HCC 不良預后顯著相關,ALBI 1 級與2 級患者中位RFS 分別為26.0 個月 (95%CI:16.9~36.2) 和12.0 個月(95%CI:7.8~16.1),差異有統計學意義(χ2= 8.234,P=0.004),見圖1②。
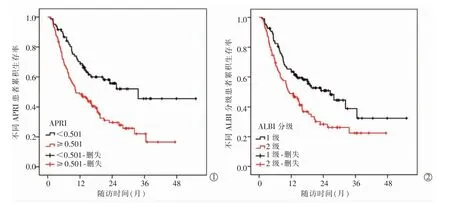
圖1 Kaplan-Meier 曲線展示不同APRI、ALBI 分級與患者生存的關系
單因素Cox 分析示腫瘤數目、 腫瘤最大直徑、血清AFP 水平、APRI 和ALBI 分級與RFA 治療后HCC 復發具有顯著相關性。將以上5 個顯著變量擬合到多因素分析中,結果發現多發腫瘤、腫瘤最大直徑>2 cm 、 血清AFP≥400 ng/mL 以及高APRI指數是HCC 復發的獨立風險因素,而ALBI 分級無預后意義,見表2。
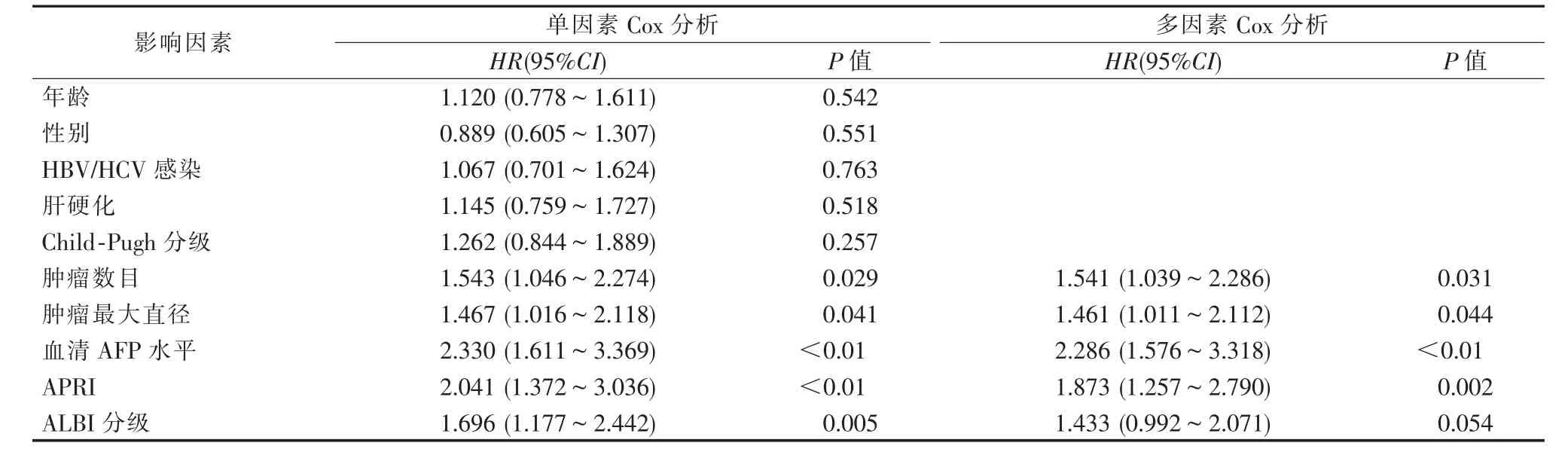
表2 Cox 回歸分析RFA 治療后HCC 復發的影響因素
2.3 列線圖模型的建立與評價
構建預測RFA 治療后HCC 個體復發的列線圖模型,見圖2。基于多因素Cox 回歸模型中的回歸系數,將腫瘤數目、 腫瘤最大直徑、 血清AFP 水平和APRI 指數分別賦予一個評分,而4 個變量得分的加權代表了HCC 復發風險。結果該列線圖模型預測HCC 復發的C 指數為0.769(95%CI:0.676~0.862),預測RFA 治療后1 年、2 年和3 年RFS 的AUC 值分別為0.707、0.719 和0.707。此外,校正曲線展示模型預測的1 年、2 年和3 年RFS 與實際概率之間具有良好一致性,進一步證實列線圖模型對HCC復發的預測價值,見圖3。
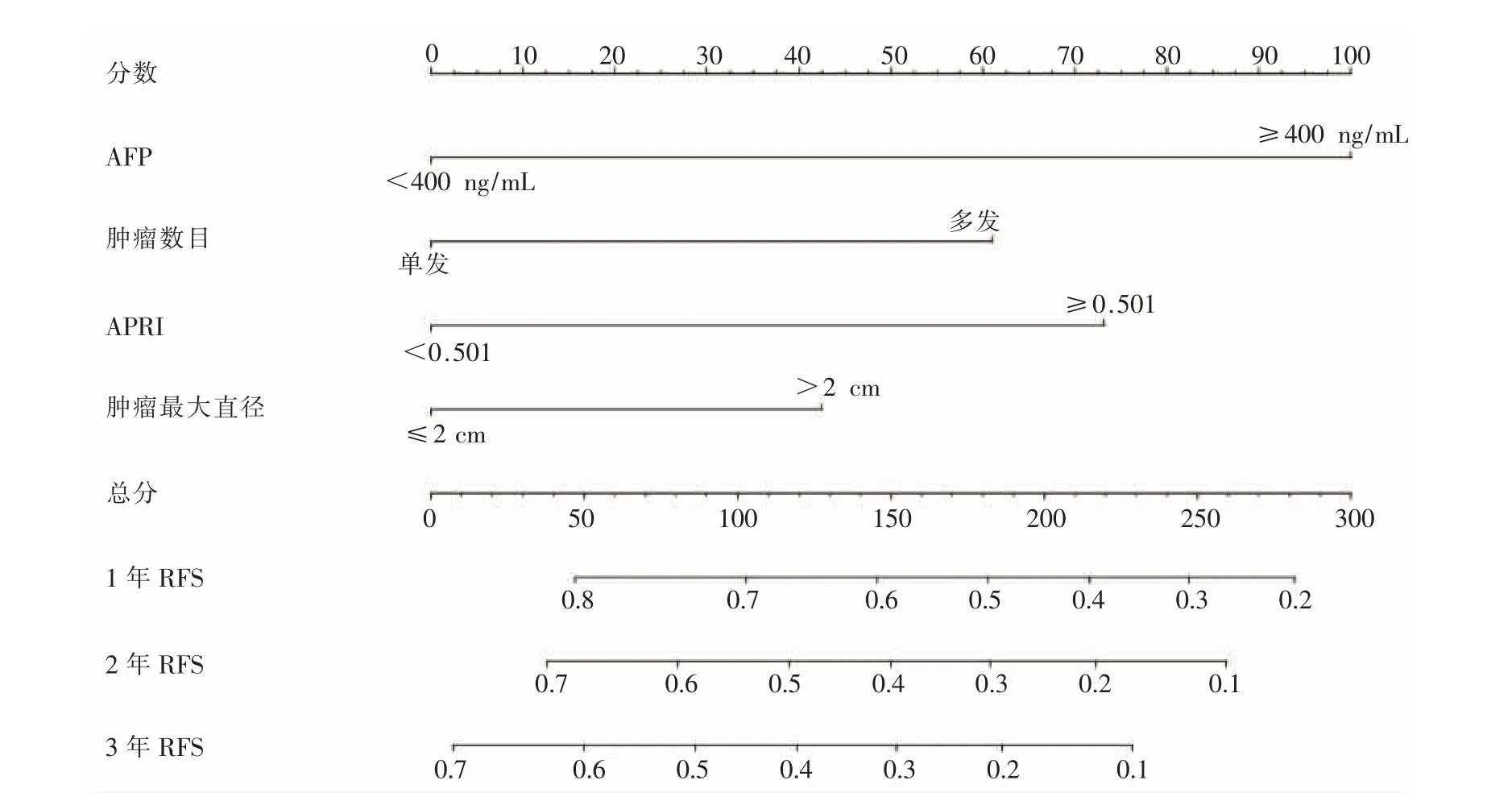
圖2 預測RFA 治療后HCC 復發的列線圖
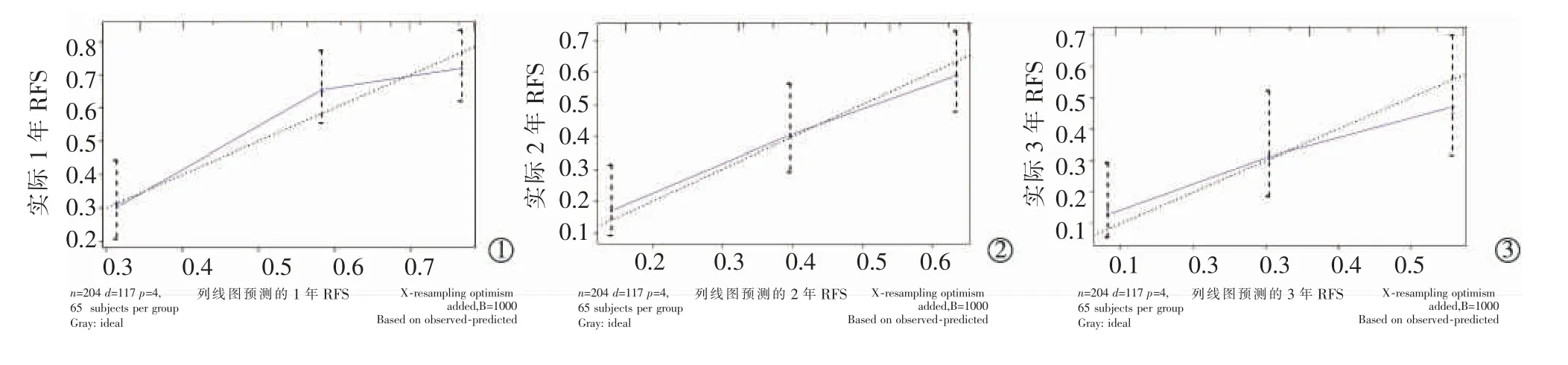
圖3 列線圖預測HCC 患者RFA 治療后1 年、2 年和3 年RFS 的校正曲線
3 討論
本研究中,204 例接受RFA 治療的HCC 患者中有57.4%出現了腫瘤復發,多數患者在2 年內復發。目前,將RFA 治療后2 年內復發定義為早期復發,與原發腫瘤的侵襲性生物學行為密切相關。本研究的結果表明,腫瘤數目、腫瘤最大直徑以及血清AFP 水平是HCC 復發的獨立危險因素,這在之前的研究中已被證實[12-13]。
除了腫瘤的侵襲性,宿主自身炎癥反應與肝臟儲備功能亦與HCC 的發生發展及臨床預后密切相關。APRI 最初主要用于慢性乙型、丙型肝炎患者肝纖維化與肝硬化的診斷[14]。AST 主要存在于肝細胞的線粒體中,當肝細胞受損時AST 可以釋放到血清中,因此AST 常被用作衡量肝細胞損傷程度的指標。此外,AST 還是肝臟炎癥的生物學標志物[15]。PLT 可促進肝細胞再生,其減少與肝硬化嚴重程度相關;另一方面,PLT 在腫瘤微環境中發揮著重要作用,可以促進和調節腫瘤血管生成[16-18]。合并肝硬化者發生HCC 的風險高達80%,越來越多的證據表明,反復的肝細胞壞死與肝細胞再生可能是導致治療后HCC 復發的重要因素[19]。因此,結合AST 和PLT 的APRI 可能從肝功能儲備和炎癥反應兩方面反映HCC 患者的預后。盡管在不同研究中APRI 的最佳截斷值不盡相同,但均表明高APRI 是HCC 患者預后不良的獨立預測因素[20-21]。Lee 等[22]在對HBV 相關HCC 患者術后隨訪過程中發現,HCC 復發者的APRI 值持續高于非復發者。Zhu 等[23]對351 例接受經動脈化療栓塞的HCC 患者進行了回顧性研究,將APRI 的截斷值設定為0.50,結果發現高APRI 患者的DFS 明顯短于低APRI 者。在一項薈萃分析中,發現高APRI 患者的總體生存與無病生存風險比分別為1.77(95%CI:1.53~2.05)和1.59(95%CI:1.47~1.71),表明APRI 升高與HCC 患者不良預后存在顯著相關性[24]。
列線圖可以通過整合不同預后變量實現對各種癌癥患者的復發風險與預后結局的個體化預測[25]。基于多元Cox 回歸分析確定的4 個風險因素(腫瘤數目、腫瘤最大直徑、血清AFP 水平和APRI),建立了預測RFA 治療后HCC 復發的列線圖模型。該模型對HCC 復發展示了良好的預測表現,能夠較好地區分高、低風險個體,有助于臨床醫生制定RFA治療后隨訪策略與個體化治療。
本研究存在以下局限性:為回顧性研究,不能避免選擇性偏倚的可能; 沒有嚴格區分早期復發和晚期復發,亦沒有區分肝內局部復發、肝內轉移和肝外轉移等復發類型,而不同的復發時間與復發類型可能具有不同的風險預測因素和病理生理機制[26-27];由于樣本量有限,未對列線圖模型進行內、外部驗證。因此,有必要進一步開展相關研究,以證實該模型對RFA 治療后HCC 復發的預測價值。
綜上所述,高APRI 是RFA 治療后HCC 復發的獨立預測指標。整合APRI 與腫瘤生物學特征(腫瘤數目、腫瘤最大直徑及血清AFP 水平)的列線圖模型有望實現對HCC 復發風險的個體化分層,幫助臨床醫生跟蹤疾病進展并做出有效的臨床決策。

