離子液體1-乙基-3-甲基咪唑亞磷酸甲酯鹽與1-乙基-3-甲基咪唑亞磷酸乙酯鹽的熱物性
劉澤鵬,曾紀珺,廖袁淏,唐曉博,趙波,韓升,張偉
(西安近代化學研究所,氟氮化工資源高效開發與利用國家重點實驗室,陜西 西安 710065)
離子液體(ionic liquids)是一種熔融溫度在近室溫范圍內(一般小于100℃)的有機鹽,通常由大體積有機陽離子(如咪唑、吡咯、吡啶和季銨)和有機或無機陰離子(如[BF4]-、[PF6]-、[N(SO2CF3)2]-和[N(SO2F)2]-等)組成[1]。符合條件的陰陽離子可以組合成多種離子液體,這些離子液體具有許多特性,如極低的蒸氣壓、高電導率、高熱穩定性、寬電化學穩定電位窗口和寬液態溫度范圍等[2]。相關研究表明,離子液體中陰離子結構對離子液體的性質具有決定性作用[3-5],而改變陽離子結構可以對離子液體相關性質進行一定程度上的調控[6-7]。因此,了解離子液體陰離子結構與其熱物性之間的構效關系是設計開發出新型離子液體的關鍵[8]。目前,大部分關于離子液體熱物性的研究主要集中在含氟陰離子([BF4]-、[PF6]-和[N(SO2CF3)2]-)[9-11]、磺酸/硫酸酯類陰離子([CH3SO3]-、[CF3SO3]-和[EtSO4]-)、羧酸類陰離子([CH3COO]-、[CF3COO]-)和鹵素類陰離子(Cl-、Br-、[AlCl4]-)等,但是對于新型磷酸酯類和亞磷酸酯類離子液體的熱物性研究較少,限制了該類離子液體的應用進程[12-14]。
亞磷酸酯陰離子類([RO(H)PO2]-)離子液體相比于大部分含氟離子液體具有毒性低、合成過程簡單、原料價廉、耐腐蝕等優點,因此在金屬材料潤滑、纖維素溶解、萃取精餾等方面得到較廣泛的應用研究[15-17]。而對亞磷酸酯離子液體開展設計合成和應用研究的前提是了解其熱物性質。通過測試分解溫度、固液相變溫度、密度、黏度、電導率和表面張力等數據,并對數據進行分析處理是準確描述離子液體熱物性質的主要手段。然而,目前關于亞磷酸酯類離子液體熱物性數據的報道較少,僅有少量關于1-乙基-3-甲基咪唑亞磷酸甲酯鹽([Emim][OMP])的熱物性報道。Hiraga 等[18]報道了[Emim][OMP]在293.15~373.15K 范圍內的密度,并以此計算得到了離子液體的熱膨脹系數和壓縮系數;Hasse等[19]報道了[Emim][OMP]在273.15~333.15K 范圍內的黏度;Almeida 等[20]報道了298.2~343.1K 范圍內的表面張力,并通過線性方程擬合計算得到了表面熵、表面焓和臨界溫度。
本文選擇[Emim][OMP]和1-乙基-3-甲基咪唑亞磷酸乙酯鹽([Emim][OEP])為研究對象,合成了這兩種離子液體,并對其結構進行了表征。測定了兩種離子液體的熱穩定性、相行為、293.15~353.15K 范圍內的密度和黏度,以及293.15~343.15K 范圍內的電導率和表面張力,將實驗值與數學模型關聯,根據實驗值和模型方程計算了離子液體的體積性質和表面性質,包括離子液體的熱膨脹系數、分子體積、標準熵、晶格能、表面熵和表面焓,并討論了兩種離子液體的離子性。
1 實驗部分
1.1 實驗試劑與儀器
1-甲基咪唑(≥99%)、1-乙基咪唑(≥98%)、亞磷酸二甲酯(≥98%)、亞磷酸二乙酯(≥99%)和乙醚(≥99.7%),上海麥克林生化科技有限公司。
Advance 500 核磁共振波譜儀,德國Bruker 公司;Vario EL Cube 型元素分析儀,德國Elementar公司;DL31 型卡爾費休水分儀,瑞士METTLER TOLEDO公司;STA 449 F5型同步熱分析儀,德國Netzsch 公司;DSC 214 Polyma 型差示掃描量熱儀測定,德國Netzsch公司;SVM 3000型密度黏度儀,奧地利Anton Paar公司;FE30型電導率儀(配LE703電極),瑞士METTLER TOLEDO 公司;LS800S 型手套箱,成都德力斯公司;標準型DSA25S接觸角測量儀,德國KRUSS公司。
1.2 離子液體[Emim][OMP]與[Emim][OEP]的合成及結構表征
1.2.1 離子液體[Emim][OMP]的合成
將14.42g (0.15mol) 1-乙 基 咪 唑 和16.51g(0.15mol)亞磷酸二甲酯加入干燥的燒瓶中,并將混合物在氮氣氣氛中130℃攪拌24h。冷卻后,將混合物用乙醚洗滌4 次,通過旋轉蒸發除去乙醚。將產物在80℃、1Pa 下干燥24h,得到26.29g 無色液體,產物收率85%,含水量為243mg/kg。
1.2.2 離子液體[Emim][OEP]的合成
將12.32g (0.15mol) 1-甲 基 咪 唑 和20.72g(0.15mol)亞磷酸二乙酯加入干燥的燒瓶中,并將混合物在氮氣氣氛中130℃攪拌24h。冷卻后,將混合物用乙醚洗滌4 次,通過旋轉蒸發除去乙醚。將產物在80℃、1Pa 下干燥24h,得到27.22g 無色液體,產物收率82%,含水量為265mg/kg。
1.2.3 結構表征
離子液體的結構通過核磁共振光譜和元素分析得到證實。使用核磁共振波譜儀進行核磁共振分析,以氘代乙腈為內標溶劑。使用元素分析儀CHN模式測定離子液體中碳、氫和氮三種元素的含量。
1.3 熱物性測定
1.3.1 熱穩定性
采用同步熱分析儀測量離子液體的熱分解溫度。每個樣品取樣5~10mg 置于鉑盤上,將盛有樣品的鉑盤在氮氣(20mL/min)氛圍中從308.15K加熱至973.15K,升溫速率為10K/min。標準不確定度為u(T)=±1K。Tstart是樣品開始失重或發生熱分解的溫度。Tonset是樣品開始發生顯著質量損失或反應的溫度點,標志著樣品在該溫度附近發生熱性質變化,本文取實驗開始時基線與分解時質量分數-溫度曲線切線的交點為Tonset。
1.3.2 相行為
離子液體的固液相變過程使用差示掃描量熱儀測試。使用鋁盤稱量樣品,并在密封條件下,氮氣氣氛中從293.15K 加熱至333.15K,然后冷卻至123.15K 并再次加熱至333.15K。在加熱循環過程中記錄玻璃化轉變溫度(Tg,熱容變化的開始)、結晶溫度(Tc,放熱峰的開始)、固-固轉變溫度(Ts-s,吸熱峰的開始)和熔點(Tm,吸熱峰的開始)。
1.3.3 密度和黏度
使用密度黏度儀同時測量273.15~353.15K范圍內離子液體的密度ρ(g/cm3)和黏度η(Pa·s)。該儀器使用礦物質標準油在273.15~363.15K的溫度范圍進行了校準。測量標準不確定度為u(ρ)=±0.0005g/cm3,u(η)=±0.35%Pa·s,u(T)=±0.02K。所有測量重復三次,取其平均值。
1.3.4 電導率
采用電導率儀測量離子液體的電導率σ(mS/cm),測試前用氯化鉀溶液(0.1mol/L)校準。在手套箱中進行測試,使用外部油浴控制溫度,每個溫度點的平衡穩定時間為1h。測量標準不確定度為u(σ)=±0.5%mS/cm,u(T)=±0.3K。所有測量重復三次,取其平均值。
1.3.5 表面張力
使用標準型接觸角測量儀測定表面張力γ(mN/m),并使用注射器產生液滴。使用Advance軟件評估液滴的形狀。測量記錄在293.15~343.15K的溫度范圍內,并在開放環境條件下進行。標準不確定度為u(T)=±0.1K 和u(γ)=±1mN/m。所有測量重復三次,取其平均值。
2 結果與討論
2.1 結構表征
通過1H 和13C 核磁數據和元素分析結果確定所合成的離子液體為目標結構,見圖1、圖2。

圖1 1-乙基-3-甲基咪唑亞磷酸甲酯鹽的核磁共振氫譜圖和碳譜圖

圖2 1-乙基-3-甲基咪唑亞磷酸乙酯鹽的核磁共振氫譜圖和碳譜圖
(1) 1-乙基-3-甲基咪唑亞磷酸甲酯鹽([Emim][OMP])
淡黃色液體。1H NMR(500MHz,CD3CN)化學位移δ:1.47(t,3H),3.38(d,3H),3.91(s,3H),4.25(q,2H),6.66(d,1H),7.53(q,1H),7.59(q,1H),9.95(s,1H)。13C NMR(125MHz, CD3CN)化學 位 移δ:14.73,35.54,44.51,49.24,49.27,121.87,123.45,137.89。C7H15N2O3P元素分析:計算值,C 40.78%、H 7.33%、N 13.59%;實驗值,C 40.46%、H 7.36%、N 13.49%。
(2) 1-乙基-3-甲基咪唑亞磷酸乙酯鹽([Emim][OEP])
淡黃色液體。1H NMR(500MHz,CD3CN)化學位移δ:1.13(t,3H),1.44(t,3H),3.71(t,2H),3.90(s,3H),4.25(q,2H),6.71(d,1H),7.67 (t,1H),7.75(t,1H),10.15(s,1H)。13C NMR(125MHz,CD3CN)化學位移δ:14.85,16.30,16.36,35.50,44.40, 58.00, 58.03, 122.04, 123.56, 138.10。C8H17N2O3P元素分析:計算值,C 43.63%、H 7.78%、N 12.72%;實驗值,C 43.25%、H 7.82%、N 12.59%。
2.2 熱穩定性和相行為
熱重分析曲線如圖3所示,根據熱重分析曲線得到離子液體的Tstart和Tonset,如表1 所示。[Emim][OMP]與[Emim][OEP]的熱穩定性相近,分解溫度分別為271.0℃和259.2℃。對比常見的含氟陰離子類離子液體,四氟硼酸鹽([Cnmim][BF4])的Tonset在395~420℃范圍內,六氟磷酸鹽([Cnmim][PF6])的Tonset在400~430℃范圍內,三氟甲磺酰亞胺鹽([Cnmim][Tf2N])的Tonset在390~440℃范圍內。因此,[Emim][OMP]與[Emim][OEP]的熱穩定性,相比含氟陰離子類離子液體要更差。但與烷基咪唑鹵鹽(Tonset= 255~280℃) 和烷基咪唑硝酸鹽(Tonset=280~290℃)相當,強于烷基咪唑醋酸鹽(Tonset=220~230℃)[21]。

表1 [Emim][OMP]與[Emim][OEP]的Tstart和Tonset

圖3 [Emim][OMP]與[Emim][OEP]的熱重分析曲線圖
使用差示掃描量熱法對離子液體的固液相變進行了研究(圖4),結果表明[Emim][OMP]與[Emim][OEP]不存在熔點或凝固點,只有玻璃化轉變。[Emim][OMP]和[Emim][OEP]的Tg分別為-84.87℃和 -85.00℃,即[Emim][OMP]與[Emim][OEP]并不存在真正意義上的固液相變,而只有冷卻或加熱過程中產生的無定形玻璃態與液態之間的轉變。

圖4 [Emim][OMP]與[Emim][OEP]的DSC圖
2.3 密度和體積性質
密度是離子液體應用研究中最重要的物理性質之一,并且密度受溫度、純度等因素影響較小,離子 液 體[Emim] [OMP] 與[Emim] [OEP] 在293.15~353.15K范圍內的密度及[Emim][OMP]密度的文獻值見表2,[Emim][OMP]與[Emim][OEP]的密度隨溫度變化曲線如圖5所示。

表2 [Emim][OMP]與[Emim][OEP]在293.15~353.15K范圍內的密度實驗值及[Emim][OMP]密度的文獻值

圖5 [Emim][OMP]與[Emim][OEP]的密度隨溫度變化曲線
對比文獻值可以發現實驗測定的[Emim][OMP]的密度值與文獻值相對誤差不超過0.2%,實驗值與文獻值吻合較好。離子液體的密度主要與分子量和陰陽離子間相互作用力有關。[Emim][OEP]的密度略小于[Emim][OMP]的密度,考慮[Emim][OEP]的分子量大于[Emim][OMP],因而可以推斷,由于陰離子碳鏈的延長,陰陽離子間相互作用力減弱,因而導致[Emim][OEP]的密度減小。
依據測得的密度實驗值,計算了離子液體相關的體積性質,包括熱膨脹系數、分子體積、標準熵和晶格能。
2.3.1 熱膨脹系數
離子液體的恒壓熱膨脹系數αp的定義式為式(1)[22]。
由式(1)可知,通過對lnρ與T作直線擬合,擬合方程為式(2),所得線性擬合方程的斜率負值即為離子液體的熱膨脹系數αp。離子液體[Emim][OMP]和[Emim][OEP]的lnρ對T的線性方程擬合的參數、相關系數及平均相對誤差見表3,其中平均相對誤差Δ采用式(3)計算[23]。擬合的相關系數均大于0.9999,Δ 均小于0.01%,由此可知,密度的自然對數方程預測值與實驗值一致。

表3 [Emim][OMP]與[Emim][OEP]的lnρ對T的線性方程擬合參數
式中,ρ為密度,g/cm3;ρ0為擬合參數,g/cm3;α為熱膨脹系數,K-1;T為熱力學溫度,K;Zexp和Zcal分別為實驗值和計算值;n為數據點數。
由 表3 可 知, 離 子 液 體[Emim] [OMP] 和[Emim][OEP]的熱膨脹系數與[Emim][BF4] (α=5.90×10-4K-1)[24]、[Emim][CH3SO3] (α=5.4458×10-4K-1)[25]等常規離子液體的熱膨脹系數相當。
2.3.2 分子體積
離子液體的分子體積(Vm)定義為陰陽兩個離子的體積加和,由式(4)計算而得。
式中,M是離子液體的相對分子質量,g/mol;NA為阿伏伽德羅常數,取值6.02×1023mol-1;ρ是298.15K 下離子液體的密度,g/cm3;Vm是298.15K下離子液體的分子體積,nm3。
離子液體[Emim][OMP]和[Emim][OEP]的分子體積見表4,[Emim][OMP]分子體積小于[Emim][OEP],這表明隨著陰離子碳鏈的增長,離子液體分子量增大,相應分子體積也增大。

表4 [Emim][OMP]與[Emim][OEP]在298.15K下的分子體積、標準熵及晶格能
2.3.3 標準熵和晶格能
根據Glasser[22]經驗方程,可以得到標準熵S?和晶格能UPOT關于分子體積Vm的表達式如式(5)、式(6)。
由表4可知,離子液體的標準熵隨離子液體分子體積的增大而增大,即較大分子體積的離子液體陰陽離子間的相互作用更弱,更容易形成較高的無序狀態,使得離子液體的標準熵更大。與之相反,離子液體的晶格能隨著分子體積的增大而減小,UPOT([Emim][OMP])=459.54kJ/mol,UPOT([Emim][OEP])=447.97kJ/mol。這兩種離子液體的晶格能比起傳統的熔融鹽要低很多,例如,堿金屬鹵化物中晶格能最低的是CsI,其晶格能為602.5kJ/mol,較低的晶格能是保證該類離子液體在室溫下為液態的一個重要原因。
2.4 黏度
黏度是離子液體的一個關鍵特性參數,相較于常規有機溶劑,在室溫下大多數離子液體的黏度要大得多,一般在0.01~1Pa·s 之間。離子液體[Emim][OMP]和[Emim][OEP]的黏度實驗值如表5 所示,離子液體的黏度隨溫度變化曲線如圖6所示。

表5 [Emim][OMP]與[Emim][OEP]在293.15~353.15K范圍內的黏度

圖6 [Emim][OMP]與[Emim][OEP]的黏度隨溫度變化曲線
離子液體的黏度主要由陰陽離子間的范德華力、氫鍵和庫侖力等作用力共同決定[26],陰陽離子間的作用力越大,離子液體的黏度越大。對于結構相同的[Emim][OMP]和[Emim][OEP]離子液體,陰離子碳鏈增長會使陰離子的體積增大,從而增大離子間的范德華力,降低庫侖力。根據圖4曲線可知在相同溫度下[Emim][OMP]的黏度小于[Emim][OEP],這表明[Emim][OEP]離子液體黏度增大主要來自范德華力變化的貢獻[27-28]。
根據圖6可知,離子液體的黏度隨溫度的升高呈減小趨勢,采用VFT方程[29]擬合黏度與溫度的關系,如式(7)。
式中,η為黏度,Pa·s;η0、Bη、T0,η為擬合參數;T為熱力學溫度,K。式(7)中的擬合參數、擬合相關系數和平均相對誤差見表6,擬合相關系數R2均大于0.99999,平均相對誤差Δ 均小于0.1%,因此黏度的VFT方程預測值與實驗值一致。

表6 [Emim][OMP]與[Emim][OEP]黏度的VFT方程擬合參數、相關系數及平均相對誤差
2.5 電導率
良好的電導率是離子液體能夠用作電極材料的一個非常重要的性質,離子液體的電導率大多明顯高于有機溶劑(最高可達20mS/cm)。[Emim][OMP]和[Emim][OEP]的電導率實驗值見表7和圖7。離子液體的電導率主要與黏度和離子尺寸有關,其中電導率與黏度成反比,而在黏度相當時,離子尺寸越小,電導率越大。由圖7 可知,[Emim][OMP]的電導率明顯大于[Emim][OEP],即[Emim][OMP]具有更低的黏度、更小的離子尺寸,因而具有更高的電導率。

表7 [Emim][OMP]與[Emim][OEP]在293.15~343.15K范圍內的電導率

圖7 [Emim][OMP]與[Emim][OEP]的電導率隨溫度變化曲線
由圖7可知,離子液體的電導率隨著溫度的升高呈顯著增大的趨勢。采用VFT方程[30]擬合電導率與溫度的關系,如式(8)。
式中,σ為電導率,mS/cm;σ0、Bσ、T0,σ為擬合參數;T為熱力學溫度,K。式(8)中的擬合參數、擬合相關系數和平均相對誤差見表8,擬合相關系數R2均大于0.9999,平均相對誤差Δ 均小于1%,因此,電導率的VFT方程預測值與實驗值一致。
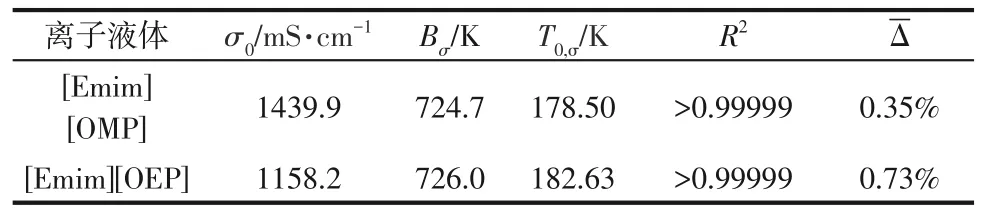
表8 [Emim][OMP]與[Emim][OEP]電導率的VFT方程擬合參數、相關系數及平均相對誤差
2.6 離子性
離子液體的離子化程度通常使用離子性這一性質進行描述。基于密度和電導率實驗值可以計算得到離子液體的摩爾電導率,計算公式如式(9)。根據Walden 規則表達式[(式(10)][31]可知離子液體的摩爾電導率與黏度呈反比例關系,其乘積稱為Walden乘積,以此可以描述離子液體的離子性。
通過Walden 規則可以對離子液體的離子性簡單定性,假定稀的KCl水溶液中的溶質完全離子化,由該溶液測量獲得的摩爾電導率和黏度作的Walden線作為參考線。若離子液體的Walden 線位于參考線上部,則可認為是“super ionic liquid”;若離子液體的Walden線位于參考線下部,并在參考線的10%線的上部,可將該離子液體歸類為“good ionic liquid”;若離子液體的Walden線位于參考線的10%線的下部,則可歸類為“poor ionic liquid”[32-33]。
式中,Λ表示摩爾電導率,S·cm2/mol。
式中,W表示Walden乘積;η表示黏度,Poise,1Poise=0.1Pa·s。
[Emim][OMP]與[Emim][OEP]在溫度為293.15~343.15K范圍內的Walden圖見圖8。由圖8可知,不同溫度的實驗點呈線性關系,這表明[Emim][OMP]與[Emim][OEP]均遵循Walden 規則。[Emim][OMP]與[Emim][OEP]的實驗點均接近理想KCl 溶液線,依此可以將[Emim][OMP]與[Emim][OEP]歸類為“good ionic liquid”。

圖8 [Emim][OMP]與[Emim][OEP]的Walden圖
2.7 表面張力
表面張力是一個對自由表面的物理和化學研究非常重要的性質,大部分離子液體的表面張力在30~60mN/m 之間[34]。[Emim][OMP]和[Emim][OEP]的表面張力實驗值如表9和圖9所示。對于亞磷酸酯離子液體,[Emim][OMP]在某論文中報道的其表面張力數據與本文最大偏差值達到了1.96mN/m。分析原因在于不同的課題組使用不同的測量方法測量表面張力,從而使測量實驗值產生較大的偏差。因此,對于表面張力的測定,要達到準確可靠且具有復現性存在一定難度[35]。

表9 [Emim][OMP]和[Emim][OEP]在293.15~343.15K范圍內的表面張力
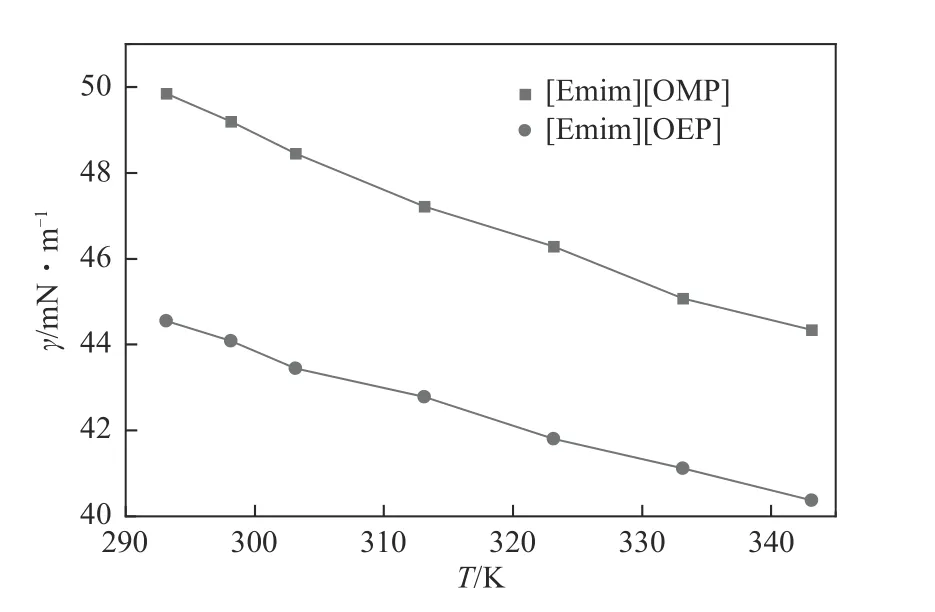
圖9 [Emim][OMP]和[Emim][OEP]表面張力隨溫度變化曲線
[Emim][OMP]的表面張力大于[Emim][OMP],分析認為離子液體的表面張力隨陰離子體積的增大而減小。表面張力與溫度線性相關,根據式(13)可以計算離子液體的表面焓和表面熵[36]。
式中,γ為表面張力,mN/m;Hγ為表面焓,mJ/m2;Sγ為 表 面 熵,mJ/(m2·K);T為 熱 力 學 溫度,K。
表面焓Hγ、表面熵Sγ、擬合相關系數R2和平均相對偏差Δ 如表10 所示,擬合相關系數R2均大于0.99,平均相對誤差Δ 均小于1%,因此,表面張力線性擬合方程預測值與實驗值一致。根據擬合結果可以發現,[Emim][OMP]相比[Emim][OEP]具有更大的表面焓和表面熵,這歸因于離子液體陰離子體積增大使得表面張力減小。

表10 [Emim][OMP]和[Emim][OEP]表面張力的線性擬合結果
3 結論
本文合成了兩種烷基咪唑亞磷酸酯離子液體,即[Emim][OMP]和[Emim][OEP],使用核磁共振氫譜、碳譜和元素分析對產物進行了表征。在一定溫度下測定了產物的熱穩定性、相行為、密度、黏度、電導率和表面張力,通過數學模型關聯了實驗數據,并得到了以下結論。
(1)[Emim][OMP]和[Emim][OEP]只表現出玻璃化轉變而無凝固點和熔點,熱穩定性相比常見的烷基咪唑離子液體要略差。
(2)基于密度實驗值計算了離子液體的體積性質,包括熱膨脹系數、分子體積、標準熵和晶格能;基于表面張力實驗值計算了離子液體自由表面的熱力學性質,包括表面熵和表面焓。離子液體[Emim][OMP]和[Emim][OEP]的體積性質和表面熱力學性質變化與離子液體的分子量變化具有較強關聯性,其中分子量的增大來源于陰離子側鏈烷基的增長,離子液體的陰離子體積也會隨之增大,使得離子液體分子體積增大和表面張力減小,從而導致離子液體標準熵增大以及晶格能、表面熵和表面焓的減小。
(3)分別使用數學模型和經驗方程關聯離子液體的密度、黏度和電導率、表面張力。密度、黏度和電導率擬合相關系數均大于0.9999,表面張力擬合相關系數大于0.99,平均相對誤差均小于1%,結果表明所用的數學模型和經驗方程對離子液體的密度、黏度和電導率、表面張力均有較好的預測。這歸因于實驗儀器的精度較高,使得實驗數據偏差較小,而所選擇的數學模型能更好地擬合相關的實驗數據。
(4)離子液體[Emim][OMP]和[Emim][OEP]均遵循Walden規則,且均屬于“good ionic liquids”。

