芒柄花黃素通過(guò)DRP1-NLRP3信號(hào)通路緩解過(guò)敏性哮喘的作用機(jī)制
陳 牧,白巧云,宋藝蘭,陳 嬌,金永德,延光海
(1.吉林省過(guò)敏性常見(jiàn)疾病免疫與靶向研究重點(diǎn)實(shí)驗(yàn)室,2.延邊大學(xué)附屬醫(yī)院耳鼻咽喉科,3.延邊大學(xué)醫(yī)學(xué)院解剖學(xué)教研室,吉林 延吉 133002)
哮喘是一種以氣道高反應(yīng)性和慢性氣道炎癥為特征的常見(jiàn)慢性疾病,全球有3.58億患者。哮喘的病理特征包括黏液產(chǎn)生過(guò)多、氣道阻塞和炎性細(xì)胞浸潤(rùn)增加[1]。氧化應(yīng)激和炎癥反應(yīng)與哮喘密切相關(guān),線粒體功能障礙和ROS過(guò)量產(chǎn)生導(dǎo)致的氧化應(yīng)激是關(guān)鍵因素。因此,我們認(rèn)為維持線粒體功能和體內(nèi)平衡以及下調(diào)炎癥反應(yīng)是改善哮喘的有效措施。
線粒體功能障礙影響活性氧的釋放,引起炎癥。過(guò)量的ROS會(huì)導(dǎo)致氧化應(yīng)激損害細(xì)胞和組織,導(dǎo)致呼吸道不良。顆粒物(particulate matter, PM)暴露導(dǎo)致哮喘疾病中線粒體抗氧化酶Mn-SOD和OPA-1降低、炎癥標(biāo)志物NLRP3和IL-1β升高,及線粒體裂變蛋白DRP1增加[2]。眾所周知,過(guò)多ROS的產(chǎn)生最終將導(dǎo)致線粒體生物能量失衡[3]。研究表明,LPS刺激增強(qiáng) DRP1 依賴的線粒體 ROS 的產(chǎn)生,促進(jìn)了 mtDNA 滲漏到細(xì)胞質(zhì)中,激活Kupffer 細(xì)胞中STING信號(hào)[4]。在蟑螂變應(yīng)原誘導(dǎo)的哮喘中,芳香烴受體通過(guò)抑制ROS觸發(fā)的NLRP3炎癥小體來(lái)保護(hù)氣道Muc5ac生成[5]。TNF-α誘導(dǎo)的氣道平滑肌(ASM)活性增加后,ROS產(chǎn)生增加,激活多種應(yīng)答途徑,包括pIRE1α/XBP1s信號(hào)通路和相關(guān)的細(xì)胞因子表達(dá)改變,導(dǎo)致線粒體功能失調(diào)[6]。已知卵清蛋白在呼吸系統(tǒng)疾病中可激活NLRP3炎癥小體,誘發(fā)caspase-1激活及促炎因子釋放[7]。因此,ROS的清除與DRP1介導(dǎo)的線粒體裂變的抑制,對(duì)改善哮喘氣道炎癥極為重要。
芒柄花黃素(formononetin, FN)是黃芪中提取的生物活性異黃酮,具有抗炎抗氧化作用[8]。研究表明,FN可以通過(guò)降低 ROS 的水平和抑制細(xì)胞凋亡來(lái)減輕 H2O2誘導(dǎo)的細(xì)胞死亡[8]。FN 抑制肥大細(xì)胞脫顆粒以緩解化合物48/80誘導(dǎo)的假過(guò)敏反應(yīng)[9]。報(bào)告指出,FN可減緩皮層神經(jīng)元炎癥,保護(hù)大鼠腦損傷后的神經(jīng)功能[10]。
然而,FN在哮喘中能否維持線粒體穩(wěn)態(tài)仍然不清楚。在此,本研究旨在闡明FN是否通過(guò)DRP1-NLRP3途徑緩解哮喘氣道炎癥,為臨床靶向用藥提供基礎(chǔ)研究。
1 材料與方法
1.1 動(dòng)物無(wú)特定病原體(SPF)級(jí)雌性BALB/c小鼠50只,20~22 g,8周齡,購(gòu)自延邊大學(xué)健康科學(xué)中心飼養(yǎng)部(中國(guó)延吉?jiǎng)游镌S可證[JI]2020-00093)。所有小鼠均在無(wú)特定病原體、溫度(22±2)℃、相對(duì)濕度50%~60%、提供嚴(yán)格滅菌的水和食物及12 h光照和夜間循環(huán)條件下飼養(yǎng)。實(shí)驗(yàn)中所有操作規(guī)程均符合《實(shí)驗(yàn)動(dòng)物管理?xiàng)l例》,并經(jīng)延邊大學(xué)醫(yī)學(xué)院倫理委員會(huì)批準(zhǔn),批準(zhǔn)文號(hào)(SYXK(JI)2020-0009)。
1.2 哮喘小鼠模型的建立及分組雌性BALB/c小鼠共50只,每組10只共5組:分別為對(duì)照(Control)、OVA(Model)、FN(劑量為20 mg·kg-1、40 mg·kg-1)和地塞米松(Dex,劑量為5 mg·kg-1)組(n=10)。哮喘模型的建立,在第0、7和14天將溶于在300 μL生理鹽水中的25 μg OVA和2 mg氫氧化鋁佐劑通過(guò)腹膜內(nèi)(ip)注射使小鼠致敏。對(duì)照組小鼠注射等劑量的生理鹽水。最后一次OVA致敏一周后(第21天),OVA組小鼠每天接受含100 μg OVA的20 μL PBS溶液霧化激發(fā),FN組和Dex組激發(fā)前30 min分別經(jīng)口灌胃FN溶液或注射Dex。FN(THT011-20 mg),分子量268.26,純度 ≥ 98%,購(gòu)自上海融禾醫(yī)藥科技發(fā)展有限公司。FN溶液的制備,將FN溶于生理鹽水中,并用鹽水稀釋。Control組給予等量生理鹽水。
1.3 樣本采集和處理小鼠最后一次激發(fā)(4周)后,收集眼眶后靜脈叢血液并離心(1 000×g,10 min)獲得血清。然后采集支氣管肺泡灌洗液(BALF),將BALF細(xì)胞在4 ℃下以400×g離心10 min。在-80 ℃儲(chǔ)存上清液以待下一步的細(xì)胞因子測(cè)定。收集左肺組織固定,用于之后病理及組織學(xué)分析,其他右肺組織儲(chǔ)存于-80 ℃,以待進(jìn)一步的蛋白分析。
1.4 組織學(xué)分析肺組織切片(n=6)用蘇木精和伊紅 (HE, # G1120, Solarbio) 染色,用于炎性細(xì)胞分析。進(jìn)行Masson染色(# G1340,Solarbio)以評(píng)價(jià)氣道周?chē)z原沉積。掃描藍(lán)色的膠原纖維所占面積,并統(tǒng)計(jì)膠原沉積所占百分比。分別測(cè)量支氣管平滑肌層厚度(Md)、支氣管基底膜周徑(Pbm)、支氣管管壁厚度(Wd)和平滑肌層面積(WAm)以及管壁總面積(WAt)。其結(jié)果將各標(biāo)本組織基底膜周徑(Pbm)進(jìn)行統(tǒng)一標(biāo)準(zhǔn)化。對(duì)于DRP1的免疫組織化學(xué)分析,首先將石蠟包埋的肺組織脫蠟水化,用檸檬酸鹽抗原修復(fù),然后用3%的H2O2在室溫下孵育10 min,再用5%的山羊血清封閉在室溫下孵育15 min,沖洗后,用兔DRP1 (# DF7037, 1 ∶200, Affinity) 抗體孵育肺切片,然后用山羊抗兔IgG H&L(HRP) (# 6721, 1 ∶2 000; Abcam) 孵育。再使用光學(xué)顯微鏡 (Eclipse Ni-U, Nikon)采集圖像。
1.5 酶聯(lián)免疫吸附試驗(yàn)(ELISA)BALF上清液中細(xì)胞因子,血清IgE采用ELISA(R&D Systems, Minneapolis)法進(jìn)行,IL-4、IL-13、IL-5和IgE的靈敏度為2.0 ng·L-1。SOD、CAT活性和MDA的含量也采用ELISA法,按照使用說(shuō)明書(shū)進(jìn)行檢測(cè)。
1.6 ROS檢測(cè)為了檢測(cè)細(xì)胞中的總ROS,BEAS-2B細(xì)胞與DCFH-DA (10 μm·L-1, # S0033S,碧云天) 在37 ℃孵育30 min。最后,通過(guò) Cytation 5 (BioTek) 觀察熒光,并使用 ImageJ 軟件 (National Institutes of Health, Bethesda, MD, USA) 進(jìn)行分析。
1.7 Western blot檢測(cè)按常規(guī)方法提取蛋白,BCA定量檢測(cè)蛋白濃度,蛋白變性處理,配制SDS-PAGE分離電泳膠,上樣20 μg蛋白,樣品轉(zhuǎn)到PVDF膜,5%脫脂奶粉封閉1 h,與一抗4 ℃過(guò)夜。p-DRP1(# DF2980)、DRP1(# DF7037),MFN1(# DF7543)、MFN2(# DF8106)購(gòu)自Affinity; NLRP3(A126974),Caspase-1(# A0964)購(gòu)自ABclonal;IL-1β(12242s),GAPDH(#2118S)購(gòu)自CST。使用二抗為山羊抗兔抗體(# 5151,CST)并與它在室溫下(25 ℃)孵育2 h。PVDF膜用顯影液顯影。通過(guò)Quantity One (BioRad, Hercules, CA, USA)計(jì)算蛋白水平。
1.8 細(xì)胞培養(yǎng)和處理人支氣管上皮(BEAS-2B)細(xì)胞購(gòu)自中國(guó)科學(xué)院上海生命科學(xué)研究院細(xì)胞資源中心(中國(guó)上海)。細(xì)胞在添加10%胎牛血清(Gibco)、100 kg·L-1鏈霉素和100 kU·L-1青霉素的DMEM(Gibco)中于37 ℃、5% CO2條件下培養(yǎng)。對(duì)于刺激,給予10 μg·L-1IL-13預(yù)處理30 min,然后與FN(1、10 μmol·L-1)或Dex(5 μmol·L-1)處理BEAS-2B細(xì)胞24 h。
1.9 免疫熒光染色對(duì)于DRP1和IL-1β的免疫熒光染色,BEAS-2B細(xì)胞和肺組織切片固定,室溫下在含0.25% Triton X-100的PBS中透化10 min,并用PBS清洗3次。隨后,用1%牛血清白蛋白 (BSA; Sigma-Aldrich) 的PBS中孵育1 h。然后與抗DRP1和IL-1β抗體在4 ℃下孵育過(guò)夜。緩慢沖洗后,與Alexa Fluor 488(綠色)標(biāo)記的驢抗山羊IgG(Invitrogen)在1% BSA中在室溫下避光孵育2 h。清洗后,使用4′-6-二脒基-2-苯基吲哚(DAPI; Invitrogen)對(duì)細(xì)胞核染色。在Cytation 5下進(jìn)行觀察并采集圖像。
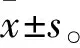
2 結(jié)果
2.1 FN能顯著減輕OVA誘導(dǎo)哮喘小鼠氣道炎癥,上皮下膠原沉積與纖維化為了檢測(cè)FN對(duì)哮喘小鼠氣道周?chē)仔约?xì)胞浸潤(rùn)和上皮下膠原沉積和纖維化的影響,我們通過(guò)肺組織HE染色(Fig 1A,C)和Masson染色(Fig 1B,D)測(cè)定氣道周?chē)仔约?xì)胞與膠原沉積。與Control組相比,OVA組氣道周?chē)装Y細(xì)胞浸潤(rùn)增加。然而,與OVA組相比,FN高劑量治療小鼠氣道周?chē)装Y細(xì)胞與膠原沉積和纖維化減少明顯。結(jié)果表明,FN可能通過(guò)抑制氣道炎癥和上皮下膠原沉積和纖維化來(lái)減輕OVA誘導(dǎo)的哮喘。

Fig 1 Effect of FN on airway inflammation and subepithelial collagen deposition and
2.2 FN減輕OVA誘導(dǎo)哮喘小鼠Th2細(xì)胞因子及血清中IgE水平我們通過(guò)ELISA法檢測(cè)了BALF中的Th2細(xì)胞因子(Fig 2A)。與Control組相比,OVA組IL-4、IL-5和IL-13的表達(dá)水平明顯增加(P<0.05)。與OVA組相比較,FN高劑量治療的Th2細(xì)胞因子水平明顯減少(P<0.05)。此外,ELISA法檢測(cè)了血清總的和特異性IgE水平(Fig 2B)。與Control組相比,OVA組血清IgE水平增加明顯(P<0.05)。與OVA組相比,FN高劑量治療后IgE水平減少明顯(P<0.05)。以上結(jié)果表明,FN可能通過(guò)減少Th2和IgE水平來(lái)減輕OVA誘導(dǎo)的哮喘。

Fig 2 Effect of FN on BALF inflammatory cell infiltration and serum ige in asthmatic
2.3 FN對(duì)氧化應(yīng)激的影響ROS產(chǎn)生過(guò)多可導(dǎo)致線粒體損傷。我們用ELISA法測(cè)定了BALF中SOD、CAT和MDA表達(dá)(Fig 3A-C)。與Control組相比,OVA組SOD和CAT活性明顯降低,但MDA表達(dá)水平明顯增加(P<0.05)。與OVA組相比,FN高劑量治療后則可以逆轉(zhuǎn)該作用(P<0.05)。此外,我們還分析了BEAS-2B中ROS水平(Fig 3D)。與Control組細(xì)胞相比,IL-13誘導(dǎo)的BEAS-2B細(xì)胞ROS表達(dá)明顯增加。與IL-13誘導(dǎo)的BEAS-2B細(xì)胞相比,FN高劑量治療后的ROS生成明顯降低。由此可見(jiàn),FN可能通過(guò)增加SOD、CAT,降低MDA,減少ROS積累來(lái)防止線粒體損傷。
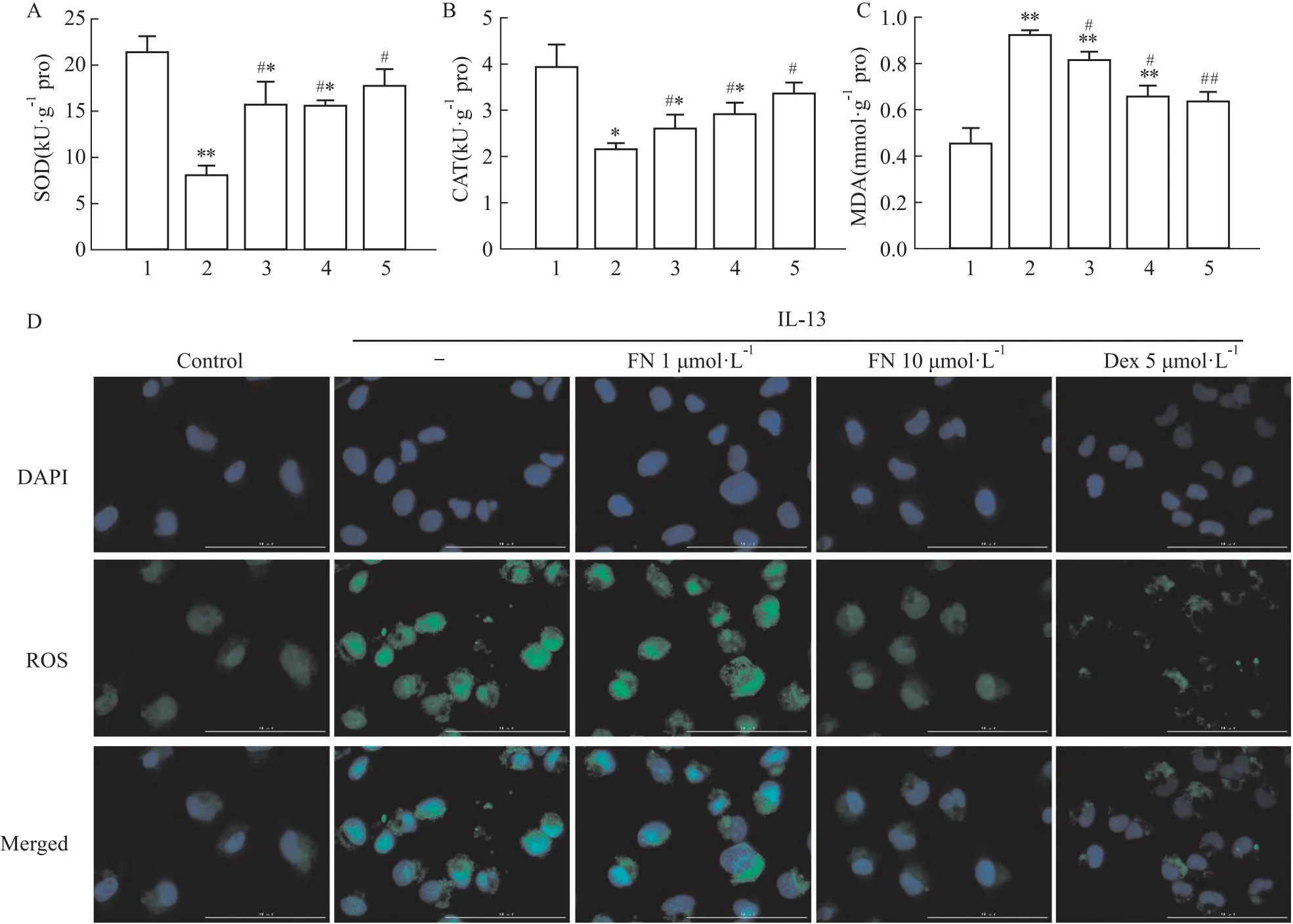
Fig 3 Effect of FN on oxidative stress in asthmatic mice
2.4 FN對(duì) p-DRP1、DRP1、MFN1、MFN2蛋白的影響我們通過(guò)Western blot測(cè)定了p-DRP1、DRP1、MFN1、MFN2(Fig 4A,B)。與Control組相比,OVA組p-DRP1水平增加,MFN1的表達(dá)明顯減少(P<0.05),而總DRP1與MFN2的表達(dá)無(wú)明顯變化。與OVA組相比,FN高劑量治療可明顯增加DRP1的減少,MFN1的表達(dá)增加(P<0.05),而總DRP1與MFN2的表達(dá)無(wú)明顯變化。此外,DRP1的免疫組織化學(xué)結(jié)果也顯示,FN治療后可以減少DRP1蛋白的表達(dá)水平(Fig 4C)。與此同時(shí),免疫熒光檢測(cè)BEAS-2B細(xì)胞中DRP1的表達(dá)水平,與Control組相比,IL-13誘導(dǎo)的BEAS-2B細(xì)胞中DRP1的表達(dá)明顯上升(Fig 4D)。與IL-13誘導(dǎo)的BEAS-2B細(xì)胞相比,FN高劑量治療后可明顯減少DRP1的表達(dá)。上述結(jié)果表明,FN可能通過(guò)DRP1-NLRP3通路的影響,減少線粒體裂變,從而減輕哮喘氣道炎癥。
2.5 FN對(duì)DRP1介導(dǎo)的NLRP3的影響為了解FN對(duì)哮喘小鼠體內(nèi)NLRP3炎癥小體的影響,我們通過(guò)Western blot 分析了NLRP3、Caspase-1、IL-1β蛋白表達(dá)水平(Fig 5A,B),與Control組相比,OVA組NLRP3、Caspase-1、IL-1β蛋白表達(dá)明顯增加(P<0.05),與OVA組相比,FN高劑量治療后可有效抑制NLRP3、Caspase-1、IL-1β表達(dá)(P<0.05)。此外,免疫組織熒光染色I(xiàn)L-1β(Fig 5C),結(jié)果表明OVA組NLRP3表達(dá)明顯增加,而FN高劑量治療后顯著減少該表達(dá)。以上結(jié)果表明FN能有效減少哮喘小鼠體內(nèi)NLRP3炎癥反應(yīng)。

Fig 5 Effect of FN on DRP1-Mediated NLRP3
3 討論
本研究探討FN通過(guò)調(diào)節(jié)ROS抑制DRP1介導(dǎo)的線粒體裂變?cè)谶^(guò)敏性氣道炎癥中的作用及潛在機(jī)制。本研究證明,FN可以抑制OVA誘導(dǎo)的氣道周?chē)人嵝粤<?xì)胞浸潤(rùn)和膠原沉積、BALF中炎癥細(xì)胞以及血清IgE水平。此外,FN可增加哮喘小鼠BALF中SOD和CAT活性,同時(shí)減少M(fèi)DA表達(dá)以及BEAS-2B細(xì)胞中總ROS水平。而且,FN還可以增加OVA誘導(dǎo)哮喘小鼠MFN1的表達(dá),同時(shí)減少DRP1的磷酸化與NLRP3炎癥小體活化。我們的發(fā)現(xiàn)表明FN在減輕 OVA 誘導(dǎo)的哮喘小鼠氣道炎癥方面發(fā)揮了很有前景的藥理作用,可能是通過(guò)抑制DRP1-NLRP3信號(hào)通路實(shí)現(xiàn)。
眾所周知,ROS的產(chǎn)生過(guò)多和氧化應(yīng)激與OVA誘導(dǎo)的支氣管上皮細(xì)胞損傷和哮喘的發(fā)生發(fā)展有關(guān)[11]。FN具有多種藥理作用,如抗癌、抗凋亡、抗炎、抗氧化、抗高血壓和抗糖尿病等。研究證實(shí),FN有效地提高了創(chuàng)傷性腦損傷大鼠腦組織谷胱甘肽過(guò)氧化物酶(GSH-Px)和SOD的活性,同時(shí)降低了MDA、腫瘤壞死因子-α(TNF-α)白細(xì)胞介素-6(IL-6)濃度。同時(shí),核因子E2相關(guān)因子2(Nrf2)的蛋白表達(dá)有效上調(diào)[12]。一致地,我們發(fā)現(xiàn)FN上調(diào)OVA誘導(dǎo)的哮喘中SOD和CAT,且降低MDA。由此可見(jiàn),FN可通過(guò)誘導(dǎo)抗氧化酶抑制哮喘炎癥,從而抑制氧化應(yīng)激和組織損傷。眾所周知,ROS水平的減少是抑制氣道炎癥的有效策略。我們的數(shù)據(jù)表明FN能減弱IL-13誘導(dǎo)BEAS-2B細(xì)胞中總ROS的水平。基于上述發(fā)現(xiàn),我們推測(cè)FN可能通過(guò)抑制氧化應(yīng)激和ROS減輕氣道炎癥。
ROS調(diào)控的線粒體功能障礙可引發(fā)線粒體裂變。據(jù)報(bào)道,百草枯(paraquat, PQ)誘導(dǎo)的凋亡和線粒體裂變中,DRP1與ROS在小鼠肺泡II型(AT-II)細(xì)胞中具有相互作用[13]。由此可見(jiàn),炎癥引起的ROS與線粒體裂變密不可分。研究證實(shí),DRP1(Ser616)磷酸化可使DRP1失活導(dǎo)致線粒體裂變。此外,分泌型卷曲相關(guān)蛋白5(Sfrp5)可以通過(guò)增加p-AMPK和線粒體融合蛋白的同時(shí)降低p-DRP1(Ser616)改善心肌梗死后重塑[14]。此外,在鏈脲佐菌素(streptozotocin, STZ)誘導(dǎo)的糖尿病大鼠中,FN減弱腎小管細(xì)胞凋亡、線粒體斷裂并恢復(fù)線粒體動(dòng)力學(xué)相關(guān)蛋白,如DRP1、Fis1和MFN2,以及凋亡相關(guān)蛋白,如Bax、Bcl-2和 cleaved caspase-3的表達(dá)。我們的研究結(jié)果也揭示了OVA與IL-13誘導(dǎo)的氣道炎癥中ROS大量產(chǎn)生、DRP1被募集到線粒體膜并促進(jìn)線粒體分裂,從而導(dǎo)致線粒體功能障礙。同時(shí),我們的研究結(jié)果也證實(shí)FN通過(guò)減少DRP1的磷酸化和線粒體融合蛋白的增加,維持正常的線粒體形態(tài)。說(shuō)明,FN是通過(guò)減少DRP1介導(dǎo)的線粒體裂變,改善線粒體功能,抑制氣道炎癥。
氧化應(yīng)激和線粒體功能障礙已被證明能觸發(fā)炎癥的激活,如NLRP3炎癥小體[15]。當(dāng)ROS產(chǎn)生增加時(shí),細(xì)胞接收相關(guān)信號(hào)來(lái)刺激NLRP3炎癥小體[15]。激活的NLRP3刺激Caspase-1并介導(dǎo)IL-1β成熟,從而擴(kuò)大炎癥反應(yīng)。表明NLRP3的激活與線粒體損傷具有廣泛而緊密的聯(lián)系[16]。研究發(fā)現(xiàn), DRP1介導(dǎo)的線粒體裂變可誘導(dǎo)視網(wǎng)膜細(xì)胞產(chǎn)生ROS和NLRP3炎癥小體的形成[15],從而引發(fā)一系列炎癥級(jí)聯(lián)反應(yīng)。NLRP3驅(qū)動(dòng)的炎癥反應(yīng)是哮喘發(fā)病的關(guān)鍵驅(qū)動(dòng)因素[17]。研究證實(shí),FN有抗炎,抗氧化作用。在動(dòng)物模型中,FN通過(guò)阻斷NF-κB和 AP-1 活化途徑顯著抑制炎癥相關(guān)基因表達(dá)[18]。有報(bào)道稱(chēng),FN治療顯著改善了小鼠肺功能,減輕了肺部炎癥,包括炎癥細(xì)胞浸潤(rùn)、白細(xì)胞介素IL-4、IL-5和IL-13、免疫球蛋白IgE、C-C基序趨化因子配體5(CCL5,也稱(chēng)為趨化因子)、CCL11(也稱(chēng)為嗜酸細(xì)胞活化趨化因子-1)和 IL-17A 水平升高。此外,FN處理顯著減弱了杯狀細(xì)胞增生和膠原沉積,并顯著降低氧化應(yīng)激。進(jìn)一步的,我們的結(jié)果也證實(shí)了線粒體功能障礙與哮喘小鼠中NLRP3炎癥小體的相關(guān)性。由此可見(jiàn),ROS的抑制與線粒體功能的維持有助于抑制NLRP3,caspase-1和IL-β蛋白的表達(dá)。這些結(jié)果揭示了FN可能通過(guò)抑制DRP1-NLRP3信號(hào)通路緩解哮喘氣道炎癥。
總之,基于體內(nèi)外實(shí)驗(yàn),我們推測(cè)FN可能通過(guò)DRP1-NLRP3信號(hào)通路部分發(fā)揮其生物學(xué)效應(yīng)。綜上所述,本研究結(jié)果表明FN可能通過(guò)抑制ROS相關(guān)的線粒體裂變減輕過(guò)敏性氣道炎癥。但其潛在機(jī)制仍需進(jìn)一步驗(yàn)證。我們的發(fā)現(xiàn)可能有助于了解FN在支氣管哮喘中的作用并且為闡明哮喘發(fā)病機(jī)制提供研究基礎(chǔ)。
- 中國(guó)藥理學(xué)通報(bào)的其它文章
- 桃紅四物湯對(duì)大腦中動(dòng)脈閉塞大鼠lncRNA表達(dá)的影響
- 基于網(wǎng)絡(luò)藥理學(xué)方法與分子對(duì)接技術(shù)探究左西孟旦治療低氧肺動(dòng)脈高壓的作用機(jī)制
- 基于TGF-β1/Smads信號(hào)通路探討2-十二烷基-6-甲氧基-2,5-二烯-1,4-環(huán)己二酮抗肝纖維化的作用機(jī)制
- miR-141-5p/ZNF705A對(duì)慢性粒細(xì)胞白血病細(xì)胞源外泌體調(diào)控骨髓間充質(zhì)干細(xì)胞黏附作用的機(jī)制
- 眼鏡蛇毒細(xì)胞毒素-1的分離純化及其對(duì)HSC-LX2細(xì)胞PI3K/AKT 信號(hào)通路的影響
- 香葉醇通過(guò)調(diào)控Nrf2/HO-1途徑調(diào)節(jié)氧化應(yīng)激減輕大鼠腦缺血/再灌注損傷

