新輔助放療聯合免疫治療在局部進展期直腸癌中的研究進展
王明非,商亮,種微,田鋒,李樂平,靖昌慶
1 山東大學,山東濟南 250012;2 山東省立醫院胃腸外科,山東濟南 250021;3 山東第一醫科大學附屬省立醫院胃腸外科,山東濟南 250021
直腸癌是常見的消化道腫瘤之一,其發病率和病死率在所有惡性腫瘤中分別排名第3 位和第2位[1]。在我國,70%的直腸癌患者確診時已發展成為局部進展期直腸癌(LARC),即腫瘤侵出腸壁肌層及侵入周圍組織或存在區域淋巴結轉移且無遠處轉移的中低位直腸癌[2]。隨著多學科綜合治療的不斷成熟,全程新輔助治療(TNT)或新輔助放化療(nCRT)后進行全直腸系膜切除術或等待觀察策略被推薦為LARC 的標準治療模式[3-4]。隨著免疫治療在實體腫瘤中應用的研究和臨床試驗不斷展開,免疫檢查點抑制劑(ICIs)在LARC 中,尤其是在微衛星高度不穩定(MSI-H)或錯配修復缺陷(dMMR)的患者中取得了較好的療效[5];但由于MSI-H/dMMR 患者比例較小,大部分微衛星穩定(MSS)或錯配修復正常(pMMR)LARC 患者如何在免疫治療中獲益是目前的研究重點[6]。近年來,通過新輔助放療來增敏ICIs 的療效,讓“冷腫瘤”向“熱腫瘤”轉變進而改善患者預后的臨床研究取得了突破性的進展,但就ICIs 的選擇、放療的劑量分割和放療及ICIs 序貫治療的先后順序等問題未能達成一致[7]。本文將對新輔助放療聯合免疫治療在LARC 中的臨床研究進行綜述,同時探討放療增敏免疫治療的具體機制及放療聯合免疫治療療效預測的生物標志物。
1 新輔助放療聯合免疫治療在LARC中的臨床應用
目前,LARC 相關放療聯合免疫治療的臨床研究大多涉及新輔助化療,關于放療劑量與分割的選擇,免疫治療與放療的先后順序及ICIs 與化療方案的配伍問題,是目前研究中存在爭議的熱點。表1歸納了2023 年在美國臨床試驗注冊庫(clinicaltrials. gov)登記的目前仍在活躍進行中的LARC 相關新輔助放療聯合免疫治療的臨床試驗。
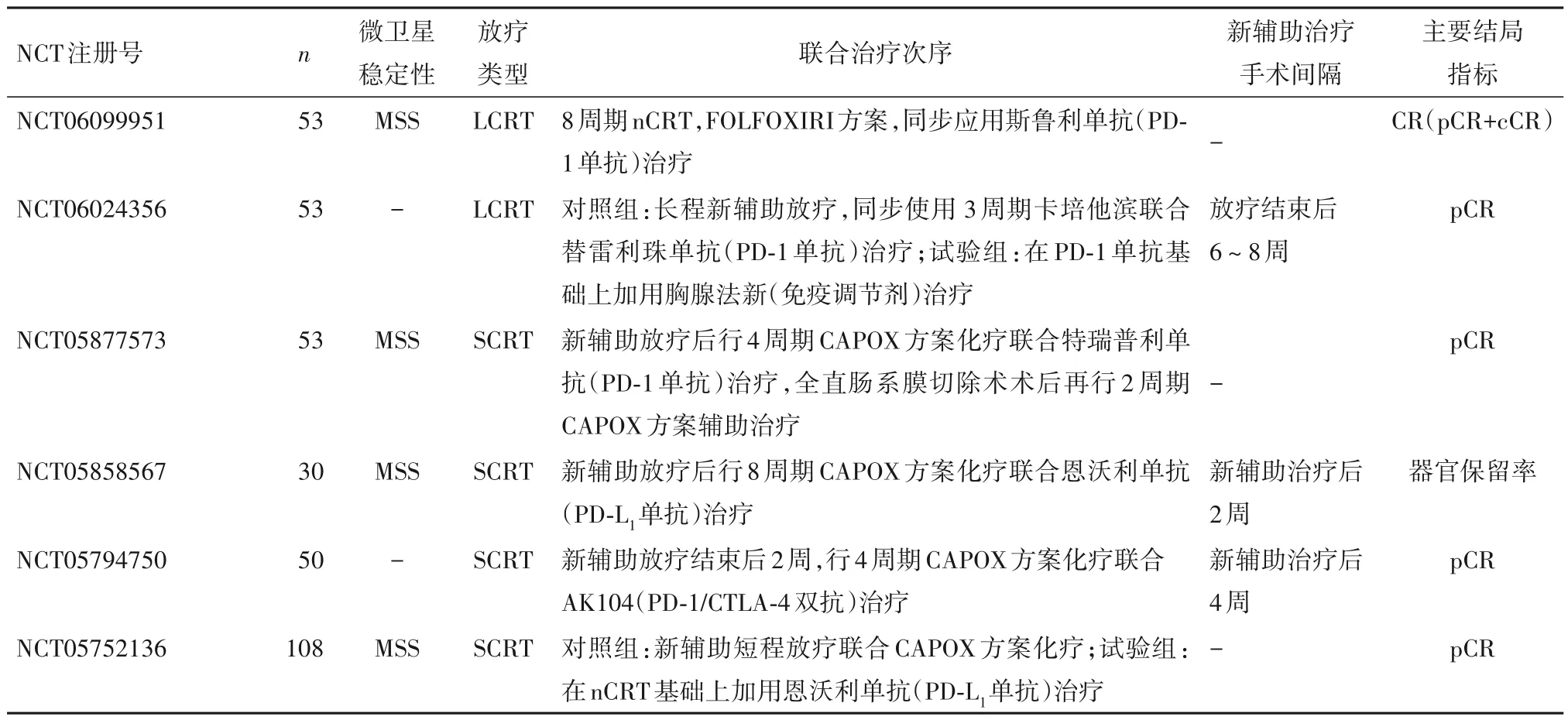
表1 2023年注冊LARC新輔助放療聯合免疫治療臨床研究
1.1 放療劑量與分割 與常規分割、長程放療(LCRT,50.4 Gy,28 次)相比,大分割、短程放療(SCRT,25 Gy,5次)在腫瘤降期、減少遠處轉移和提高患者依從性方面存在顯著優勢,但在局部復發率方面存在一定風險[4,8]。2021年,一項來自意大利的二期臨床研究AVANA,研究探索了卡培他濱+常規分割LCRT(50.4 Gy,28 次)聯合阿維魯單抗(PD-L1單抗)在LARC 患者中的治療效果,結果提示在96例可進行病理評估的LARC 患者中,常規分割長程nCRT 聯合免疫治療可達到23.0%的病理完全緩解(pCR)率[9]。另一項由華中科技大學同濟醫學院附屬協和醫院發起的二期、單臂臨床試驗研究了先行SCRT(5×5 Gy),再行2周期CAPOX 化療方案聯合卡瑞利珠單抗(PD-1單抗)治療在LARC患者中的安全性及療效,試驗結果表明,在接受手術的27 例患者中,pCR 率達48.1%[10]。而來自英國在研的二期、開放標簽、隨機對照臨床試驗PRIME-RT 研究中,對照組為先行SCRT(5×5 Gy)+度伐魯單抗(PD-L1單抗),再行6 周期FOLFOX+度伐魯單抗治療;實驗組則為先行卡培他濱聯合LCRT(2×25 Gy)+度伐魯單抗,再行4 周期FOLFOX+度伐魯單抗治療。研究的主要結局指標為pCR 率或臨床完全緩解(cCR)率[11]。期待該在研的臨床試驗完成時,其結果的公布能回答關于LARC 患者新輔助聯合治療方案中放療的分割與周期選擇的爭議。
1.2 免疫治療聯合放療的時機 免疫治療聯合新輔助放療應用的時機對治療效果至關重要,當前主要分為三種模式:免疫治療誘導后進行放(化)療、放療增敏后ICIs鞏固治療、新輔助放療同步免疫治療。2023 年復旦大學附屬腫瘤醫院的一項TORCH 研究納入了62 例腫瘤距肛緣10 cm 的LARC 患者,鞏固組(34 例)先行SCRT,再進行6 個療程CAPOX 化療方案聯合特瑞普利單抗(PD-1 單抗)治療,誘導組(28 例)先行2 個療程上述化療+免疫治療,再行SCRT,最后行后續4 個療程化療+免疫治療。結果發現鞏固組cCR 率為55.9%,顯著高于誘導組的35.7%;而在接受全直腸系膜切除術手術的32 例患者中,誘導組pCR 率為69.2%,高于鞏固組的47.4%[12]。這提示放療增敏序貫免疫治療可提高臨床緩解率和器官保留(保肛)機會,同時也存在一定的局部復發風險。來自瑞士的二期、單臂臨床試驗PEMREC 研究招募了25 例局灶性直腸癌患者,進行SCRT 的同時同步使用了帕博利珠單抗(PD-1 單抗),主要研究終點為腫瘤退縮分級[13]。在另一項多中心、單臂臨床試驗REGINA 研究中則對LARC 患者首先進行了2周期納武利尤單抗(PD-1單抗)聯合瑞戈非尼誘導治療后,行SCRT,后續再行3 周期免疫聯合靶向治療,主要結局指標為pCR 率[14]。上述研究的完成將進一步闡明新輔助放療和免疫治療的組合次序對LARC患者治療效果的影響。
1.3 手術時間及輔助治療選擇 對接受新輔助放療聯合免疫治療的LARC 患者,新輔助治療與全直腸系膜切除術手術間隔尚未有定論。目前標準治療方案推薦在完成nCRT后5~12周后進行手術治療以期獲得最大獲益(最高的pCR 率)[3]。但同時最新研究提示,并非所有LARC 患者都適合延遲手術[15]。大部分新輔助放療聯合免疫治療的臨床研究在新輔助治療后2~4 周進行全直腸系膜切除術,部分應用LCRT 的臨床研究在新輔助治療后8~10周后進行手術治療[9]。在比利時開展的一項二期臨床試驗RIMMUNE 研究,對照組使用常規nCRT,新輔助治療10周后進行手術治療;實驗組則在nCRT后接受3周期阿替利珠單抗(PD-L1單抗)治療,全部新輔助治療結束3 周后(以放化療結束為基準,同樣約為10 周)進行手術治療[16]。
依據RAPIDO研究公布的結果[4],TNT治療模式因其治療依從性的提高、器官保留的優勢,受到越來越多的重視,但TNT 聯合免疫治療模式在術后局部復發控制方面仍存在爭議。復旦大學在研的兩項分別基于MSS(NCT04411537)和MSI-H(NCT04411524)LARC 患者的二期臨床試驗,2 周期PD-1 單抗治療后,行LCRT(50 Gy),再行3 周期PD-1 單抗治療后1~2 周行全直腸系膜切除術,且術后進行6 周期XELOX 方案輔助化療。期待該研究能進一步明確術后進行輔助治療在新輔助放療聯合免疫治療方案中的必要性和安全性。
目前,依照RAPIDO 研究設計,大部分在LARC中開展的新輔助放療聯合免疫治療的臨床研究多采用SCRT 模式,術前給予大分割,SCRT 擁有等待手術時間短、患者依從性高及遠處轉移率低等優勢,但在腫瘤退縮及器官保留方面仍有缺陷。仍有臨床試驗給予LCRT 模式,給予傳統的長程nCRT 設計方案,部分研究還在全直腸系膜切除術術后補充了輔助化療進行鞏固,以期獲得更有效的腫瘤退縮及術后復發控制。LARC 中新輔助治療聯合免疫治療的療效優于單純nCRT 及單純ICIs 治療已得到初步證實,目前在研的臨床試驗已逐漸在設計階段注重新輔助放療與ICIs的配伍方式及免疫治療具體的使用周期等問題,也希望更合理的聯合治療模式能夠為LARC患者帶來更好的療效及預后。
2 新輔助放療聯合免疫治療LARC的機制
2.1 免疫浸潤 腫瘤微環境可通過影響腫瘤細胞增殖、代謝、侵襲遷移和遠處轉移,進而在直腸癌的發生與進展中發揮重要作用。腫瘤微環境中T 細胞、B 細胞、腫瘤相關巨噬細胞及樹突狀細胞等免疫細胞的存在和分布情況稱為免疫浸潤,對nCRT 及免疫治療的療效存在深遠影響[17-18]。研究發現,一方面,放療可通過增加腫瘤微環境中腫瘤相關抗原、損傷相關的分子模式等的釋放,促進抗原呈遞細胞,尤其是樹突狀細胞的活化,引發炎癥級聯反應,進而改善免疫治療療效[18];同時,直腸癌及癌旁組織中的CD8+T 細胞浸潤會受放射影響增加,從而易化ICIs的抗腫瘤作用[19]。另一方面,SCRT可能增加腫瘤微環境中免疫抑制細胞群,如免疫調節T 細胞、M2 巨噬細胞和髓源抑制性細胞的浸潤[17,20]。放療作為一把雙刃劍,如果應用得當,可發揮原位腫瘤疫苗的作用,促進免疫治療療效,反之則將進一步惡化腫瘤微環境中的免疫抵抗與免疫逃逸環境。
2.2 遠隔效應 對原發腫瘤放療的同時,對放射野外的腫瘤細胞產生殺傷的效果稱為遠隔效應。放療聯合免疫治療可增強遠隔效應強度,引起全身抗腫瘤反應,對晚期腫瘤及轉移瘤的治療意義重大[21]。研究發現,單純放療極難引發遠隔效應,且存在劑量依賴,而在免疫激活、免疫抑制、免疫缺陷三種環境中,放療引發遠隔效應的難度逐漸增大[22]。這提示抗腫瘤免疫環境在放療發揮腫瘤殺傷作用的過程中發揮著關鍵作用。電離輻射可通過促進遠端腫瘤微環境中腫瘤相關巨噬細胞由免疫抑制的M2 型向免疫促進的M1 型轉變,清空腫瘤引流淋巴結中免疫抑制及促腫瘤的細胞因子,誘導p53信號通路活化,進而介導遠端腫瘤病灶發生衰老、自噬;還可經由腫瘤相關外泌體將腫瘤相關抗原傳遞給抗原呈遞細胞,激活自身免疫系統造成腫瘤殺傷,促進遠隔效應的發生[23]。越來越多的基礎和臨床研究報道了結直腸癌中的遠隔效應及其誘導條件[24-25],相信進一步的機制研究將為擴大新輔助放療聯合免疫治療在進展期直腸癌中的應用范圍提供理論支撐。
2.3 腸道菌群 腸道菌群被稱為人類第二基因組,不僅與腸功能障礙、營養與代謝相關,同時能夠影響消化道腫瘤,尤其是結直腸癌的發生與發展[26]。此外,腸道菌群及其代謝產物在二級淋巴器官和三級淋巴結構中也發揮重要作用,可直接或間接影響T細胞成熟及分化過程[26]。因結直腸癌與腸道菌群的空間關系密切,對原發腫瘤的放療可重塑腸道微生態,進而影響免疫治療效果[27]。有研究表明,腸道菌群及其代謝產物在放療后的改變,可促進腫瘤相關抗原的釋放并增加干擾素γ,以增強免疫微環境抗腫瘤作用[28]。現階段探討腸道菌群在放療或免疫治療中作用的相關研究多集中于某一具體菌屬或特定代謝產物,且對其調節多通過抗菌藥物完成。進一步探索腸道菌群及其代謝產物參與LARC 發生發展過程中的具體機制,為LARC 新輔助治療提供新的靶點或免疫調節劑。
對LARC 的腫瘤免疫微環境的研究一直是領域內的熱點,放療帶來的包括免疫增敏和免疫抵抗在內的雙面效應,也為進一步探索改善免疫治療在LARC 中療效打開了大門。隨著單細胞測序、空間轉錄組學及多組學聯合分析等技術的不斷突破,對新輔助放療增強LARC 免疫治療療效內在機制的理解也在不斷豐富和刷新。如何將最新的機制研究進展轉化為指導臨床診療實踐及預測患者預后的成果,將是未來LARC 中應用放療聯合免疫治療相關研究的重點。
3 新輔助放療聯合免疫治療LARC 的療效預測生物標志物
2017 年,MSI-H/dMMR 首次被美國食品藥品監督管理局(FDA)認定為單一基因標志物,從而批準帕博利珠單抗用于晚期實體瘤的治療,自此拉開了結直腸癌免疫治療的序幕[5]。隨著越來越多新輔助放療聯合免疫治療臨床試驗的結果公布,數據顯示部分病理類型為MSS/pMMR 的LARC 患者在新輔助放療聯合免疫治療中獲益[9-10,24,29]。除MSI-H/dMMR、PD-1/PD-L1等成熟的標志物之外,明確新的生物標志物以預測新輔助治療療效,尋找新的治療靶點逐漸成為研究熱點。
3.1 遺傳學特征
3.1.1 腫瘤突變負荷(TMB) 指的是特定基因組區域內體細胞非同義突變的個數(mut/Mb),當TMB≥10 mut/Mb 時被定義為TMB-H。作為相對獨立的預測標志物,TMB-H 與腫瘤細胞表面新抗原表達增加相關,可易化抗原識別與呈遞,加速免疫系統腫瘤殺傷作用[30]。經臨床試驗KEYNOTE-158 研究證實,在部分種類的實體瘤患者中,相較非TMB-H 組,TMB-H 組患者具有更高的客觀緩解率,這也使得TMB成為繼MSI-H/dMMR后第二個泛實體瘤免疫治療預后預測生物標志物[31]。但TMB在LARC中的檢測不在常規考慮范圍內,TMB 對LARC 的免疫治療效果預測仍有待進一步考證。
3.1.2 共識分子分型(CMS) 于2015 年首次提出,旨在區分結直腸癌患者在基因表達水平的異質性,用于指導臨床診治[32]。隨著免疫治療在結直腸癌領域的不斷開展,CMS 分型對接受免疫治療的LARC 患者預后的預測價值不斷凸顯。其中CMS1亞型占患者人群的14%,以MSI-H 及TMB-H 為特征,免疫反應處激活狀態;CMS2 亞型占患者人群的37%,以WNT 及MYC 信號通路激活為特征,上皮細胞特性降低,腫瘤微環境以免疫逃逸為主;CMS3 亞型占患者人群的13%,以代謝失調為特征;CMS4 亞型占患者人群的23%,以轉化生長因子-β 活化、細胞間質纖維化及血管生成為特點,免疫反應同樣處于抑制狀態[33]。如何通過新輔助放療或免疫增敏劑實現免疫抑制的CMS 亞型向免疫激活的亞型轉變將是未來研究的重點。
3.1.3 基因突變 隨著基因組學的飛速發展及大規模癌癥基因組測序的展開,可精準預測LARC 免疫治療療效的基因組標志物正不斷涌現。編碼DNA 聚合酶ε(POLE)及DNA 聚合酶δ1(POLD1)的基因突變與TMB-H 相關,且臨床研究表明POLE/POLD1 突變指示直腸癌患者可從免疫治療中獲益[34]。此外,還有研究表明,ARID1A 突變可作為MSS/pMMR 結直腸癌患者免疫活躍及可從免疫治療中獲益的基因組標志物[35]。
3.2 循環血生物標志物 ①循環腫瘤細胞從原發腫瘤表面脫落進入血液、淋巴循環,進而被用于預測結直腸癌患者預后及術后復發風險,作為現行血清學腫瘤標志物的補充,液體活檢的特點是便捷且依從性高,但在準確性方面有待進一步提高[36]。②循環腫瘤DNA 作為進入外周循環血的腫瘤DNA 片段,是液體活檢中最成熟的生物標志物,其主要作用包括鑒別ICIs 作用模式,預測nCRT 及免疫治療療效、預后,評估腫瘤耐藥性及腫瘤負荷,早期診斷直腸癌及預防術后局部復發[37]。③中性粒細胞淋巴細胞比值(NLR)和血小板淋巴細胞比值(PLR)可用于預測接受nCRT 的LARC 患者預后,新輔助治療前的高PLR與更差的預后密切相關[38]。
3.3 腸道菌群及代謝物 在結直腸癌中,已證明與抗腫瘤效應相關,可提高ICIs 療效的腸道菌群菌屬包括另枝菌屬、瘤胃球菌屬、乳狀乳球菌屬、真桿菌屬、梭桿菌屬、考拉桿菌屬、擬桿菌屬、副普雷沃氏菌屬和副擬桿菌屬等[39]。此外,腸道菌群代謝物丁酸和部分其他短鏈脂肪酸的衍生,或提示腫瘤增殖、微生物穩態增強和免疫治療抗腫瘤效率下降[28,39]。
雖然隨著nCRT的不斷成熟,TNT概念的逐漸普及和免疫治療的引入,使得LARC 患者的生存和生活質量都有了顯著改善,但仍有部分患者無法從現存的治療方案中顯著獲益。對新的療效預測生物標志物的探索,一方面可為患者選擇最適治療方案,另一方面也可為進一步的基礎、亞臨床及臨床研究指示方向。
綜上所述,LARC 免疫治療方興未艾,越來越多的研究數據提示聯合新輔助放療能夠讓LARC 患者,尤其是MSS/pMMR 患者獲益。但關于新輔助放療的劑量、分割,聯合使用ICIs的周期、應用配伍,新輔助治療與全直腸系膜切除術手術的間隔,是否行全程新輔助治療等問題,仍有待后續多中心、大樣本的隨機對照研究進一步證實。同時,隨著放療聯合ICIs 改善LARC 患者預后的機制探索不斷深入,以及除MSI-H/dMMR之外更多新的生物學標志物的涌現,相信新輔助放療聯合免疫治療應用于LARC 的前景可期。
利益沖突聲明所有作者聲明不存在利益沖突
作者貢獻聲明王明非:論文撰寫;種微:論文修訂;田鋒:論文最終版本修訂;商亮:論文審核;李樂平:提出研究方向;靖昌慶:設計論文框架、研究指導監督

