高產γ-氨基丁酸植物乳桿菌的篩選、鑒定及益生特性
吳劍,南博,李俠,曹勇,王玉華,4,5*,王秀娟*
(1.吉林國際旅行衛生保健中心(長春海關口岸門診部),吉林 長春 130062;2.吉林農業大學 食品科學與工程學院,吉林 長春 130118;3.吉林農業大學 食品生物制造創新中心,吉林 長春 130118;4.吉林農業大學 大豆工業與技術國家加工實驗室,吉林 長春 130118;5.吉林農業大學 國家小麥和玉米深加工工程研究中心,吉林 長春 130118)
γ-氨基丁酸(γ-aminobutyric acid,GABA)是一種天然的、自身不能合成蛋白的氨基酸,由于其獨特的生理功能,如改善睡眠、抗抑郁癥[1]、醫治癲癇、降血壓[2-4]、降血糖、激活和增強記憶力、緩解和治療孕婦自主神經障礙等[5],還可作為治療尿毒癥的輔助藥物[6],并具有間接促進受孕等功能[7],近年來GABA 的發展和使用受到越來越多的關注[8-9]。
獲取GABA 的傳統生產途徑一般分為化學法和生物合成法,化學法由于對環境的污染較大,生產的GABA 難以完全提純,副產物對人體的危害大不能應用于食品醫藥行業中。生物合成法更常用[10],主要包括植物富集法和微生物發酵法。植物富集法比化學法的反應條件溫和且基本不會對環境造成危害。植物富集法的主要原理是高等植物組織中的內源酶催化谷氨酸鈉的脫羧和多胺的降解[11],這兩條合成和轉化途徑生成GABA,具有反應慢、不穩定及產率低等缺點,因此不常用于GABA 的生產。微生物發酵法具有反應迅速、產率較高的優點,大量微生物都能通過發酵生產GABA[12]。GABA 在生物體中一般以谷氨酸通過谷氨酸脫羧酶脫羧反應產生,選擇合適的產GABA 的生物載體是大量獲得GABA 的前提條件[13]。在早期的研究中,微生物以大腸桿菌為主,通過谷氨酸鈉的脫羧反應生產GABA,雖然大腸桿菌有很強的谷氨酸脫羧酶的能力,但是將所得產物應用于食品中存在許多局限性。乳酸菌是一種國際公認的食品級食用細菌,可以提高食品的品質和營養,并賦予食品特殊的風味[14],具有重要生物學功能(如提高免疫力、調節腸道菌群及降低膽固醇等[15])。目前由乳酸菌發酵的GABA,發酵條件簡單,可以直接用作食品添加劑[16]或開發乳酸菌發酵酸奶。有研究[17]從傳統的發酵泡菜中分離出67 種乳酸菌,通過高效液相色譜分析有27 株菌株產GABA,在37 ℃培養48 h 后,其中一株GABA 產量達到3.92 g/L。利用乳酸菌發酵產GABA 安全快捷且產量相對較高,可以直接應用到食品中。由此可見利用乳酸菌生產GABA 技術日漸成熟。篩選出合適的乳酸菌菌株和發酵條件以大量獲取GABA 是利用生物法獲取GABA領域的研究熱點之一。
植物乳桿菌作為乳酸菌系統的一個分支,具有益生特性,適應環境能力較強,能夠定植于人體腸道中,發揮作用。本研究從東北酸菜和韓國泡菜中篩選獲得高產GABA 的植物乳桿菌菌株,通過16S rDNA 對其進行測序鑒定乳酸菌種類,并對該菌株的益生特性進行深入研究,旨在為其后續功能性食品的研究開發提供參考。
1 材料與方法
1.1 材料
自然發酵東北酸菜、韓國泡菜:市售;人工胃腸液、GABA 標準品:北京奧博星生物技術有限公司;冰醋酸:江蘇奧福生物科技有限公司;DNA 提取試劑盒、蛋白胨、酵母提取物、葡萄糖:北京鼎國生物技術有限責任公司。所用試劑均為分析純。
1.2 儀器與設備
PCR 儀(7500fast):美國Applied Biosystems 公司;酶標儀(TECAN-F50):瑞士TECAN 公司;電泳儀(DYY-6C):北京六一儀器廠;高速冷凍離心機(JXN-30/26):上海BBI 公司;-80 ℃冰箱(MDF-U3386S):日本SANYO 電器集團。
1.3 方法
1.3.1 試劑的配制
紙層析展開劑:正丁醇∶冰醋酸∶水(體積比)=2∶1∶1,加入0.8% 顯色劑茚三酮。層析洗脫劑:75% 乙醇∶0.1% 硫酸銅(體積比)=38∶2。硼酸緩沖溶液:稱取1.236 8 g 硼酸和0.292 5 g NaCl,溶解定容至100 mL制成A 液,溶解1.907 0 g 硼酸鈉并定容至100 mL 制成B 液;將A 液與B 液混合(體積比1∶9)配制成pH9.0 的硼酸緩沖液,4 ℃避光保存,現用現配。5 mg/mL GABA標準濃儲液溶液:適量去離子水溶解500 mg GABA 粉末并定容至100 mL,4 ℃保存。
MRS 培養基:蛋白胨10 g,牛肉膏10 g,酵母提取物5 g,磷酸氫二鉀2 g,檸檬酸二銨2 g,乙酸鈉5 g,葡萄糖20 g,吐溫80 1 mL,硫酸鎂(7H2O)0.58 g,硫酸錳(4H2O)0.25 g,蒸餾水1 000 mL,pH6.2,121 ℃滅菌15 min。固體培養基加入瓊脂粉15 g。
胰蛋白胨酵母膏葡萄糖培養基(tryptone yeast extract and glucose medium,TYG):胰蛋白胨10 g,酵母提取物5 g,葡萄糖20 g,丁二酸鈉5 g,1 000 mL 蒸餾水,加入L-谷氨酸(1 mg/mL)20 mL,pH6.5,115 ℃滅菌25 min。
溶菌肉湯培養基(lysogeny broth medium,LB):胰蛋白胨10 g,酵母粉5 g,NaCl 10 g,瓊脂粉15 g,蒸餾水1 000 mL,pH6.5,121 ℃滅菌20 min。
1.3.2 產GABA 乳酸菌菌株的篩選
菌株初篩:取自然發酵的東北酸菜及韓國泡菜汁水稀釋10 倍,將稀釋液涂布于固體MRS 培養基上,37 ℃恒溫培養24 h,選取成型單菌落于固體平板上劃線分離,反復進行純化培養,最終選取革蘭氏陽性菌株接種于MRS 液體培養基中培養24 h(2%,體積分數),3 代連續培養,得到有活力的菌株備用。
菌株復篩:將初篩得到的菌株接種于TYG 選擇培養基中(2%,體積分數),37 ℃恒溫培養24 h,連續培養2 代,備用。
1.3.3 發酵液中GABA 的定性分析
發酵液中GABA 的定性分析參照熊京京等[18]方法稍作改動,取1μL 發酵上清液,在薄層層析硅膠板底部1 cm 處間隔0.7 cm 點樣,GABA 標準液作為對照。層析缸中放入0.8 cm 的展開劑,將硅膠板平穩放入,密封,直至展開劑擴展至距離硅膠板上沿1 cm 處時,取出晾干,放入烘箱85 ℃顯色20 min,初篩產GABA的菌株。
1.3.4 發酵液中GABA 的定量分析
將GABA 標準濃儲液依次稀釋配制成0.25、0.50、0.75、1.00、1.25、1.50 mg/mL 的GABA 標準溶液。具塞試管中分別加入0.2 mL 不同濃度的標準液和處理后的發酵上清液,加入重蒸苯酚1.0 mL(60%)和硼酸鹽緩沖液0.4 mL(pH9.0),混勻后再加入NaClO 溶液1.0 mL(10%),充分振蕩混勻。靜置5 min 后,沸水中加熱10 min,冰浴10 min,溶液變為藍綠色后,加入2.0 mL 60% 乙醇溶液,于645 nm 波長處測定吸光值。以GABA 濃度為橫坐標,吸光值為縱坐標,繪制標準曲線,計算發酵液中GABA 的含量。
1.3.5 產GABA 菌株的鑒定及形態觀察
菌株的鑒定:GABA 菌株DNA 的提取參照DNA提取試劑盒說明進行,利用基因通用引物27f 和1492r擴增,通過聚合酶鏈式反應(polymerase chain reaction,PCR)體系標準化操作后,產物經0.75%瓊脂糖凝膠電泳并通過凝膠成像裝置觀察,進行16S rRNA 基因序列測序。使用美國國家生物技術信息中心(National Center for Biotechnology Information,NCBI)的Gen-Bank 數據庫對各菌株序列分析比對,對同源性較高的模式菌株的16S rDNA 基因序列采用MEGA7.0 構建系統發育樹。
菌株的形態觀察:取分離純化后的菌液1 mL 涂于MRS 培養基上,37 ℃培養48 h 后記錄菌落形態,取菌液革蘭氏染色,在顯微鏡下觀察并拍照。
1.3.6 菌株的生長曲線及產酸曲線繪制
在MRS 液體培養基中接種2% 活化好的菌株,37 ℃培養,每2 h 測定OD600nm值和pH 值,繪制生長曲線及產酸曲線。
1.3.7 菌株發酵上清液對常見病原菌的抑菌試驗
將實驗室保藏的金黃色葡萄球菌、沙門氏菌和大腸桿菌分別活化,再稀釋至105CFU/mL,取0.1 mL 涂布于LB 培養基上,將無菌的濾紙片放于平板中,做3個平行組。分別吸取0.3 mL 活化好的菌株發酵上清液放入濾紙片上,于37 ℃培養24 h,觀察并測量抑菌圈直徑大小,進行3 次平行試驗。
1.3.8 菌株對膽鹽的耐受性
向MRS 培養基中加入牛膽鹽,配制成0.2%、0.3%及0.5%的膽鹽培養基,取2%活化后的菌株接種于上述膽鹽養基中,于37 ℃培養24 h 后,進行稀釋涂布,做3 組平行試驗,計算活菌數。
1.3.9 菌株對酸度的耐受性
菌株對酸度的耐受性參照Wang 等[17]的方法稍作修改,于MRS 液體培養基中分別加入鹽酸,配制成酸性培養基(pH2.0、3.0、4.0),取2% 活化后的菌株接種于酸性培養基中,于37 ℃培養24 h 后,進行稀釋涂布,做3 組平行試驗,計算活菌數。
1.3.10 菌株對人工胃液和人工腸液的耐受性
參照趙芳等[19]的方法稍作修改,于MRS 液體培養基中接種2% 菌株,37 ℃培養24 h 后取10 mL 菌液,5 000 r/min 離心10 min,沉淀用無菌磷酸鹽緩沖溶液(phosphate buffer saline,PBS)洗滌2 次,收集菌體沉淀加入10 mL PBS 混勻。取1 mL 菌液加入9 mL 模擬人工胃液,37 ℃培養4 h 后,再從模擬人工胃液中取1 mL 菌液加入9 mL 模擬人工腸液,37 ℃培養4 h。每2 h 分別取樣進行平板涂布計數,做3 組平行試驗。
1.3.11 菌株對常用抗生素的敏感性
在MRS 固體培養基上均勻涂布2%菌株,用無菌鑷子放置不同的藥敏片,于37 ℃培養24 h,觀察藥敏片周圍是否形成抑菌圈,并測量直徑,進行3 組平行試驗。藥敏片為紅霉素30 μg、卡那霉素30 μg、氯霉素30μg、鏈霉素30μg、四環素30μg。用游標卡尺測量抑菌圈大小。
1.4 統計分析
通過Excel、GraphPad Prism 6.0 和Design-Expert 12 對數據進行統計分析。試驗數據以平均值±標準差表示。
2 結果與分析
2.1 高產GABA 乳酸菌菌株的篩選
薄層層析定性分析結果如圖1 所示。
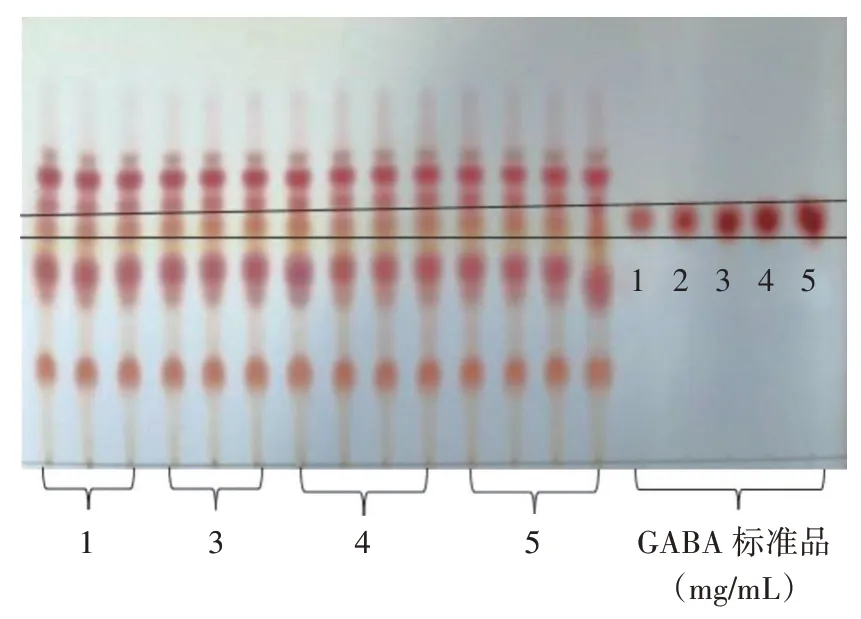
圖1 菌株發酵液GABA 薄層層析色譜Fig.1 Thin-layer chromatogram of gamma-aminobutyric acid(GABA)in the strain fermentation broth
由圖1 可以看出,除了菌株2,菌株1、菌株3、菌株4、菌株5 均有與GABA 標準品相同的比移值(化合物在薄層層析板上移動的距離與溶劑前端移動的距離之比),初步認為4 株菌株均產生GABA。
比色法定量分析結果如圖2 所示。
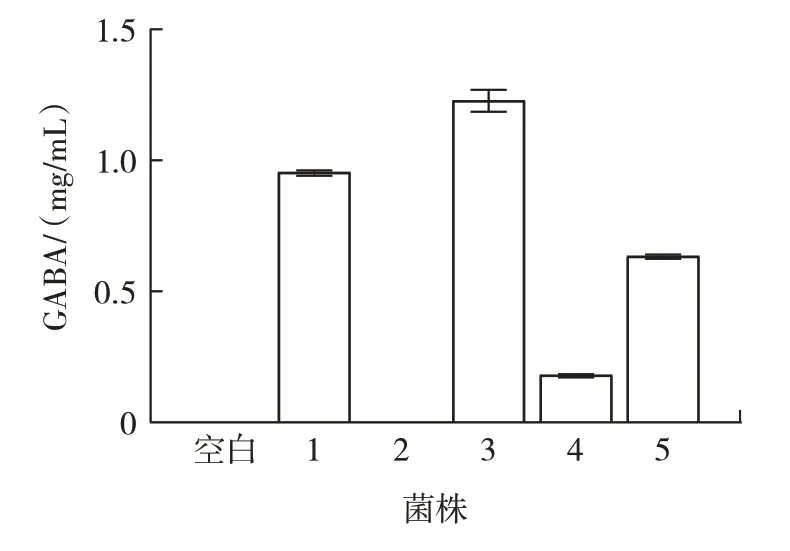
圖2 5 株菌株GABA 產量對比Fig.2 Comparison of GABA production among 5 strains
由圖2 可以看出,菌株2 沒有產生GABA,菌株1、3、4、5 均有GABA 產生,且菌株3 的GABA 產量最高。Cataldo 等[20]從藜麥和莧菜中分離出17 株乳酸菌,30 ℃培養72 h 后,GABA 產量為16~258 mmol/L,從同一來源中篩選出來的乳酸菌的GABA 產量不同。綜上,選用產GABA 能力較強的菌株3 作為后續試驗的主要研究菌株。
2.2 篩選菌株16S rRNA 序列分析鑒定及形態學觀察
高產GABA 的菌株3 的瓊脂糖凝膠電泳如圖3所示。
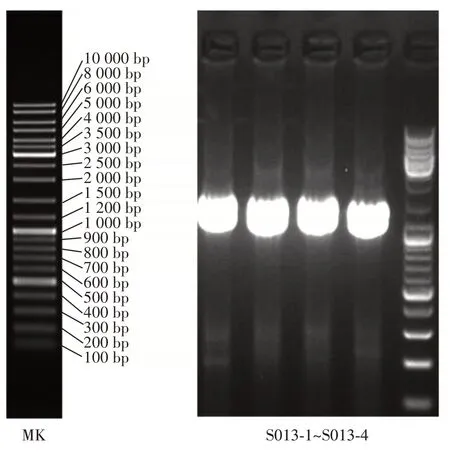
圖3 篩選菌株的DNA 電泳圖Fig.3 DNA electropherogram of the screened strains
由圖3 可以看出,在1 400 bp 左右有明顯的條帶出現。進行16S rRNA 測序構建系統發育樹如圖4所示。

圖4 植物乳桿菌Lp3 的系統發育樹Fig.4 Phylogenetic tree of Lactobacillus plantarum Lp3
由圖4 可以看出,該菌株的16S rRNA 與L.plantarumstrain UFLA WFC331 的同源性達到99.6%,命名為植物乳桿菌Lp3,拉丁文學名L.plantarumLp3。其菌落形態及鏡檢結果如圖5 所示。
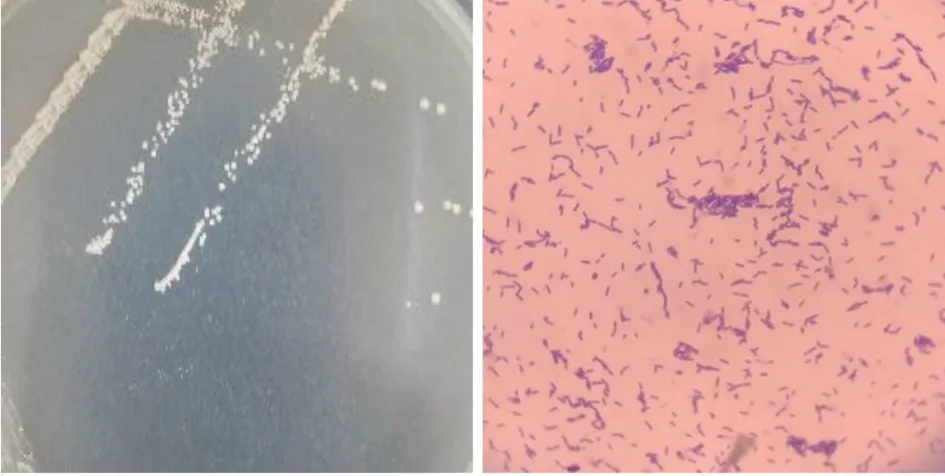
圖5 植物乳桿菌Lp3 的菌落及菌體形態Fig.5 Colony and cell morphology of L.plantarum Lp3
由圖5 可以看出,該菌株的菌落凸起,呈乳白色,圓形光滑,半透明,邊緣整齊;菌體呈桿狀,革蘭氏陽性。
2.3 L.plantarum Lp3 菌株的生長曲線和產酸曲線
L.plantarumLp3 菌株的生長曲線和產酸曲線如圖6 所示。
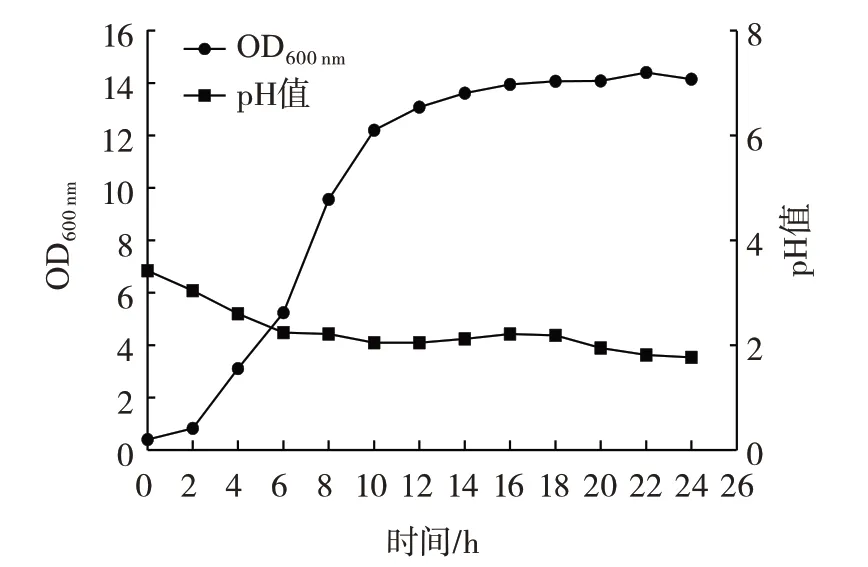
圖6 植物乳桿菌Lp3 生長曲線和產酸曲線Fig.6 Growth and acid production curves of L.plantarum Lp3
由圖6 可以看出,該菌株在0~2 h 生長緩慢,2~12 h 生長速率快速上升,進入對數期,因該菌株是從活化二代后的菌液中分離出來的,所以菌種活力較強,代謝快;12 h 后生長逐漸放緩進入平穩期,在22 h 時,菌株活力最高。由產酸曲線可知L.plantarumLp3 菌株在接種0~6 h 發酵液pH 值下降迅速,快速產酸,6 h 后pH 值緩慢降低。說明該菌株有良好的生長和產酸能力。馬莉等[21]研究結果與本研究L.plantarumLp3 菌株的生長曲線和產酸曲線的趨勢一致。
2.4 L.plantarum Lp3 菌株對常見病原菌的抑制
分別取L.plantarumLp3 菌株發酵上清液及pH 值調至7.0 的上清液進行抑菌試驗,對3 種常見病原菌的抑制作用如表1 所示。
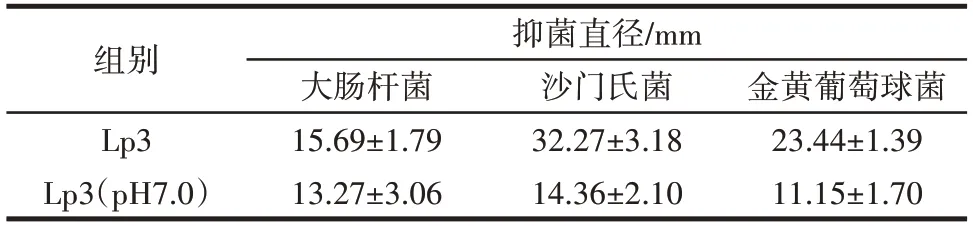
表1 植物乳桿菌Lp3 的抑菌效果Table 1 Antibacterial effects of L.plantarum Lp3
由表1 可知,該菌株對3 種致病菌均有比較好的抑制效果,對大腸桿菌、沙門氏菌和金黃色葡萄球菌的抑菌圈直徑分別為15.69、32.27、23.44 mm,對沙門氏菌的抑制作用最強。當發酵上清液的pH 值調至7.0時,L.plantarumLp3 抑菌能力均降低,尤其是沙門氏菌和金黃色葡萄球菌。Halimi 等[22]研究發現,發酵乳桿菌的低pH 值培養上清液對金葡菌及銅綠假單胞菌均有較強的抑菌能力。綜上,L.plantarumLp3 菌株具有較強的抑菌能力。
2.5 L.plantarum Lp3 菌株的耐受性
益生菌的重要特性之一是耐受能力,腸道環境膽鹽濃度較高,因此L.plantarum菌株的耐膽鹽能力顯得尤為重要。植物乳桿菌Lp3 體外耐膽鹽能力如圖7所示。
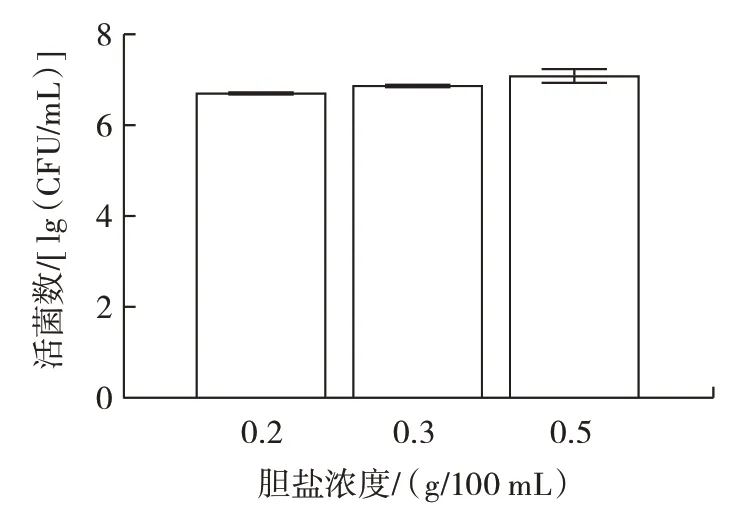
圖7 植物乳桿菌Lp3 體外耐膽鹽能力Fig.7 Bile salt tolerance of L.plantarum Lp3 in vitro
由圖7 可以看出,當膽鹽濃度為0.2、0.3 g/100 mL和0.5 g/100 mL 時,培養24 h 后L.plantarumLp3 菌株的活菌數可達6.84、6.96、7.12 lg(CFU/mL),且活菌數符合乳酸菌發揮作用的最低值,表明L.plantarumLp3菌株耐膽鹽能力較強。作為革蘭氏陽性菌,植物乳桿菌具有較厚的細胞壁,可能是該菌株對膽鹽環境耐受的原因之一。王祎然等[23]從酸湯中篩選出的6 株乳酸菌在相同膽鹽濃度下培養3 h 后存活率均超過88%。腸道由于胃酸的存在酸性較高,因此L.plantarum菌株的耐酸能力也很重要。L.plantarumLp3 菌株的耐酸能力如圖8 所示。
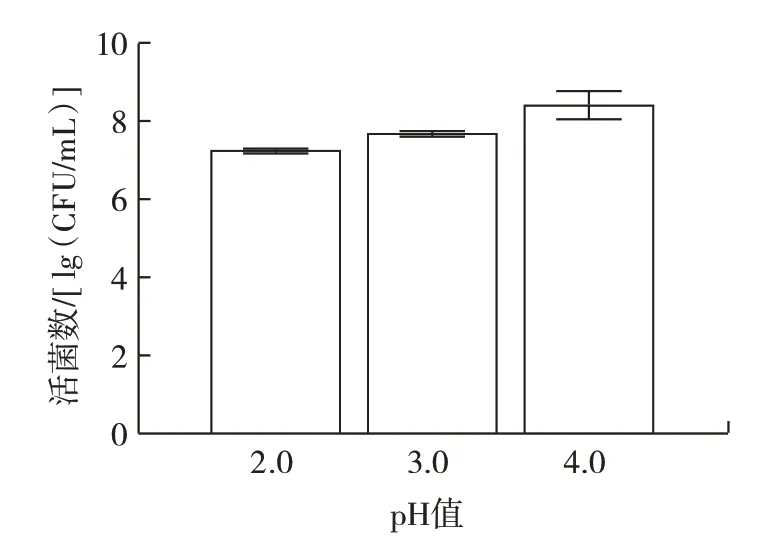
圖8 植物乳桿菌Lp3 體外耐酸能力Fig.8 Acid tolerance of L.plantarum Lp3 in vitro
由圖8 可以看出,在pH 值2.0、3.0 和4.0 的條件下,L.plantarumLp3 菌株在24 h 后的活菌數分別為7.29、7.72、8.28 lg(CFU/mL),存活率仍能達到90% 以上,表明L.plantarumLp3 菌株具有良好的耐酸能力。王帥靜等[24]對7 株菌株在pH2.0 和pH3.0 時培養幾乎不生長。
2.6 L.plantarum Lp3 菌株對模擬人工胃腸液的耐受性
益生菌菌株的重要標準是在人體胃腸道中存活的能力[25]。L.plantarumLp3 菌株先后暴露在模擬人工胃腸液的環境中,活菌數如圖9 所示。
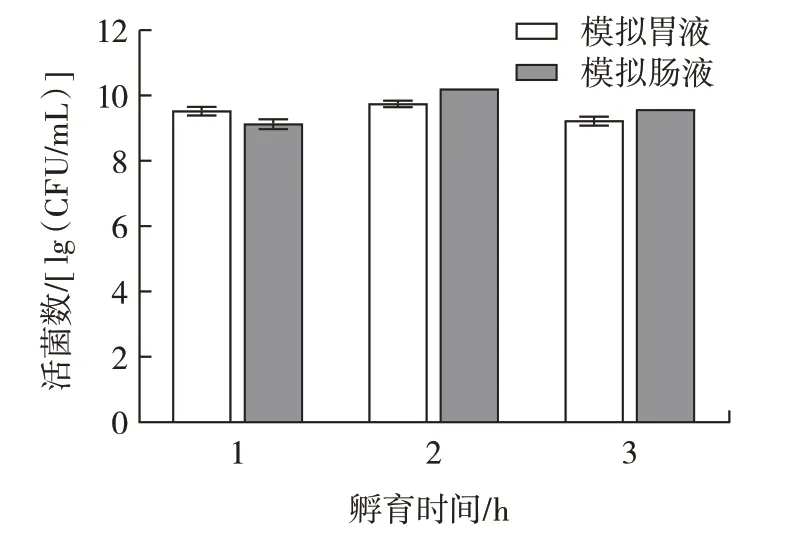
圖9 植物乳桿菌Lp3 在模擬胃腸液中的存活情況Fig.9 Survival of L.plantarum Lp3 in simulated gastrointestinal fluid
如圖9 所示,隨著在人工胃腸液中處理時間的延長,L.plantarumLp3 菌株的活菌數降低。這說明L.plantarumLp3 菌株對人工胃腸液具有較好的耐受性,能顯著抵抗胃腸道環境,具備一定的益生特性。Wang等[17]將L.plantarumHU-C2W 先暴露于模擬胃液環境培養3 h,然后接種到模擬腸液環境培養12 h,乳桿菌的存活率從67.75%降至43.82%。
2.7 L.plantarum Lp3 菌株對常用抗生素的敏感性
細菌會產生臨床耐藥性,耐藥基因可以遺傳,從而威脅宿主,因此有必要對乳酸菌進行抗生素敏感性試驗[26]。L.plantarumLp3 菌株對常用抗生素的敏感性如表2 所示。

表2 植物乳桿菌Lp3 的抗藥性比較Table 2 Antibiotic resistance of L.plantarum Lp3
如表2 所示,L.plantarumLp3 菌株對卡那霉素和鏈霉素不敏感,對紅霉素、氯霉素和四環素較為敏感,但仍在安全濃度的范圍內。結果表明L.plantarumLp3 菌株對胃腸中常用的抗生素具有一定的敏感性。
3 結論
GABA 是一種自然界含量較少的氨基酸,提取困難,微生物發酵法作為一種安全且高產GABA 的方式,越來越受到人們的重視。本研究從東北酸菜和韓國泡菜中篩選出高產GABA 的菌株3,通過16Sr DNA序列分析鑒定其為植物乳桿菌,命名為L.plantarumLp3。該菌株生長性能良好,對大腸桿菌、沙門氏菌、金黃色葡萄球菌均有比較好的抑制效果,具有良好的耐膽鹽及耐酸能力。L.plantarumLp3 菌株在體外模擬胃腸液環境中表現出良好的生存能力,對常用的紅霉素、氯霉素和四環素等抗生素具有一定的敏感性。L.plantarumLp3 益生性能適合作為食用菌種應用于食品開發。

