小麥肽通過抑制炎癥和PI3K/mTOR通路改善乙醇誘導胃黏膜損傷
馮志遠,張卓然,任杰,吳晗碩,秦慧民,劉文穎*
1(天津科技大學 生物工程學院,天津,300457)
2(中國食品發酵工業研究院,北京市蛋白功能肽工程技術研究中心,北京,100015)
胃潰瘍消化性潰瘍是最普遍的胃腸道疾病之一,影響著社會上4%~5%的人[1]。消化道潰瘍會導致包括腹痛、腹脹、食欲不振、惡心嘔吐等多種癥狀產生。幽門螺桿菌感染、飲酒、吸煙、過度使用非甾體抗炎藥、心理和生理壓力等多種因素都會導致胃潰瘍[2]。急性和慢性過量飲酒均會增加消化道出血和胃潰瘍發生的風險[3]。乙醇誘導胃損傷機制涉及胃氧化應激、炎癥和細胞凋亡[4]。據報道,乙醇代謝產生過量活性氧引起氧化應激,促進胃酸與胃蛋白酶分泌,損害黏液屏障,擾亂黏膜微循環導致胃黏膜中炎癥細胞浸潤[5-6]。
自噬是細胞在自噬相關基因的調控下利用溶酶體降解自身不必要或受損細胞成分的過程,對于控制細胞穩態和提供能量具有重要意義。CHANG等[7]研究發現乙醇可以通過下調mTOR信號通路激活自噬,并適應性地改善乙醇誘導的人胃黏膜上皮細胞 (human gastric mucosal epithelial cell,GES-1)的凋亡和氧化損傷[7]。因此,細胞自噬與凋亡在改善胃黏膜損傷中起重要作用。
小麥肽是小麥蛋白的酶解產物,比小麥蛋白具有更高的工業應用性和生物活性。研究表明,服用小麥肽可以通過抗氧化、抗炎和促進GES-1的存活等機制抑制乙醇引起的胃黏膜損傷[8]。但是在乙醇誘導的小鼠胃黏膜損傷的模型中,小麥肽對胃黏膜細胞自噬相關的機制還沒有詳細研究。因此本研究的目的是評估小麥肽對乙醇誘導胃部病變的潛在作用,此外,研究了小麥肽對乙醇誘導的小鼠胃黏膜細胞自噬相關通路PI3K/AKT/mTOR信號通路調節的影響。
1 材料與方法
1.1 材料與試劑
小麥肽,中國食品發酵工業研究院;還原型谷胱甘肽(glutathione,reduced,GSH)測定試劑盒,南京建成生物工程研究所產品;超氧化物歧化酶(superoxide dismutase,SOD)、BCA蛋白檢測試劑盒、青霉素-鏈霉素溶液(100×)、CCK-8試劑盒、一氧化氮檢測試劑盒,上海碧云天生物技術有限公司;丙二醛(malondialdehyde,MDA)測定試劑盒,北京索萊寶科技有限公司產品;4%多聚甲醛組織固定液,武漢塞維爾科技;Dulbecco′s modified eagle medium (DMEM)高糖培養基,Hyclone;胎牛血清(fetal bovine serum,FBS),GIBCO;PVDF膜,默克公司;細胞培養皿、96孔板、6孔板,康寧公司;蛋白抗體PI3K、mTOR、p-mTOR、AKT、p-AKT、IL-1β、髓過氧化物酶 (myeloperoxidase,MPO)、LC3、β-actin,Proteintech 中國公司;蛋白抗體p-PI3K,Cell Signaling Technology;其他試劑均為國產分析純。
1.2 動物實驗
選取60只6周齡雄性KM小鼠,體重(28±1) g,北京斯貝福生物技術有限公司[SCXK(京)2019-0010]。適應性喂養5 d,飼養條件:動物房溫度(20±2) ℃,濕度(45±5)%,12 h日光燈明暗交替循環,自由進食和飲水。正式實驗開始前將小鼠隨機分配為5組,空白組(Control),乙醇模型組(Ethanol),小麥肽低劑量組(L-WP),小麥肽中劑量組(M-WP),小麥肽高劑量組(H-WP),每組12只。根據人體動物劑量換算公式換算,低、中、高劑量實驗組每天分別灌喂小麥肽(0.3、0.6、0.9 g/kg體重),空白組和模型組每天灌喂等量去離子水。在小麥肽干預3 d后,在每天小麥肽灌胃后1 h開始慢性乙醇(40%)的攝入(7 mL/kg體重),共18 d,空白組除外,空白組給予等劑量的生理鹽水。試驗方法根據之前的文獻確定,并做出了部分調整[9-10]。實驗第21天灌喂結束后將小鼠禁食過夜,第22天使用異氟烷麻醉劑麻醉小鼠,眼球采血收集全血后脫臼斷頸處死,沿大曲度打開小鼠胃組織后置于液氮速凍或于4%多聚甲醛組織固定液中。所有動物實驗嚴格遵守實驗倫理原則和要求。
1.2.1 胃黏膜損傷指數測定
胃黏膜損傷的嚴重程度根據先前描述的方法計算胃潰瘍指數[11]:0:無損傷;1:黏膜紅斑;2:小潰瘍(<1 mm);3:中度潰瘍(1~2 mm);4:大面積潰瘍(2~3 mm);5:超大面積潰瘍(≥3 mm)。隨后,收集胃組織并提交用于組織學檢查和生化分析。
1.2.2 生化指標檢測
取出儲存在-80 ℃的胃組織。將組織浸泡在試劑盒中提供的提取物中,用動物組織勻漿器在低溫下制備成10%濃度的組織勻漿,用于后續測試。使用商業試劑盒分析組織中的MDA、GSH、NO水平和SOD酶活性,并按蛋白質濃度進行歸一化處理。
1.2.3 胃組織病理學觀察
將固定在4%多聚甲醛中的組織標本取出,在乙醇和二甲苯中脫水,并嵌入石蠟中。將石蠟切成5 μm厚的切片,放在涂有10%聚賴氨酸的載玻片上。帶有切片的載玻片在50 ℃下培養45 min,以提高組織切片對玻璃的附著力,然后用蘇木精和伊紅染色,然后用光鏡進行常規形態學分析。
1.3 細胞實驗
1.3.1 細胞培養
GES-1細胞購自國家實驗細胞資源共享平臺(北京,中國)。細胞在恒溫培養箱中培養,溫度為37 ℃,含有5%的二氧化碳。生長培養基為DMEM/HIGH GLUCOSE,輔以10%(體積分數)胎牛血清和1%(體積分數)青霉素-鏈霉素溶液。
1.3.2 細胞存活率
小麥肽對GES-1細胞活力的影響是通過CCK-8方法測定的。將細胞接種在96孔板中,密度為每孔1×104,培養24 h。用不同質量濃度的小麥肽(0、50、100、200、400、600、1 200、1 800 μg/mL)處理細胞24 h和乙醇(0、1%、2%、3%、4%、5%、6%,體積分數)處理細胞12 h,每個濃度設5次重復。在每個孔中加入10 μL CCK-8,繼續孵化1.5 h。使用用多功能酶標儀在450 nm處測量吸光度,以反映細胞活力。細胞活力的計算如公式(1)所示:

(1)
1.3.3 細胞氧化應激狀態檢測
將細胞接種在6孔板中,密度為每孔1×106,待細胞完全貼壁后。用不同濃度的小麥肽預培養24 h后,每孔加入5%的乙醇,培養12 h,將GES-1細胞破碎。根據制造商的說明,使用檢測試劑盒測量細胞MDA、GSH水平和SOD酶活性。
1.3.4 蛋白質免疫印跡檢測
胃組織蛋白的收集。小鼠胃組織溶于RIPA裂解液并徹底均質,然后在14 000×g(5 min,4 ℃)下離心,以獲得總蛋白。使用BCA方法測量蛋白質濃度。GES-1細胞蛋白收集:GES-1細胞在冰上用裂解緩沖液裂解,用BCA方法測量蛋白質濃度。然后用10%的聚丙烯酰胺十二烷基硫酸鈉聚丙烯酰胺凝膠電泳裝載樣品,并轉移到聚偏二氟乙烯膜上,然后用30 mL 5%的脫脂奶粉將膜封閉2 h。之后,用TBST清洗聚偏二氟乙烯膜,在4 ℃下與第一抗體搖晃孵育過夜。用TBST清洗聚偏二氟乙烯膜,用第二抗體孵育2 h后,用強化化學發光檢測系統對蛋白條帶進行可視化,使用圖像分析軟件進行分析。
1.4 數據處理與分析
所有實驗數據均以平均值±SE表示。結果通過單程方差分析(ANOVA)進行分析。使用Origin 2021(OriginLab公司,Northampton,MA,USA)進行Tukey檢驗。P<0.05被作為統計學意義的標準。
2 結果與分析
2.1 體重和飼料攝入量變化
圖1-a顯示小鼠灌胃乙醇后體重變化。酒精干預顯著抑制了小鼠體重增加(P<0.05)。在小麥肽干預結束后,H-WP組的小鼠體重顯著高于乙醇模型組(P<0.05)。由圖1-b中小鼠飼料攝入量變化發現,乙醇處理后各組小鼠飼料攝入量不存在顯著差異。由圖1-c損傷指數評分可以看出,用0.3、0.6、0.9 g/kg小麥肽處理的小鼠胃損傷指數為15.01、14.30、11.67,小麥肽能夠以劑量依賴的方式顯著降低胃黏膜損傷(P<0.05)。這些結果表明小麥肽可有效降低乙醇給藥引起的胃損傷的嚴重程度。

a-21 d小鼠體重變化;b-小鼠飼料攝入量變化;c-小鼠胃組織損傷指數
2.2 小麥肽對乙醇處理小鼠胃組織MDA、SOD、GSH和NO水平的影響
小麥肽預處理對氧化應激標志物的影響如圖2所示,數據表明,乙醇攝入導致氧化應激加重,脂質過氧化反應增加。與對照組相比,乙醇模型組,MDA水平顯著升高108%(P<0.05),SOD活性和GSH含量顯著降低37.82%和46.29%(P<0.05)。小麥肽預處理逆轉了乙醇處理導致的胃組織抗氧化能力抑制作用,與模型組相比,小麥肽預處理顯著提高了H-WP組內SOD活性(42.29%)和GSH含量(67.59%),以及M-WP組內GSH含量(73.32%)(P<0.05)。小麥肽預處理顯著降低了H-WP與M-WP組內MDA水平(P<0.05),H-WP組MDA含量降低至空白組水平。NO含量在乙醇處理后顯著升高(P<0.05),中、高劑量中小鼠胃組織內NO含量顯著降低(P<0.05)。這些結果表明乙醇誘導了胃內氧化應激發生,小麥肽組胃組織內MDA和NO含量顯著降低,SOD活性與GSH含量顯著提高,說明小麥肽具有良好的抗氧化活性,減輕由氧化應激誘導的胃潰瘍。
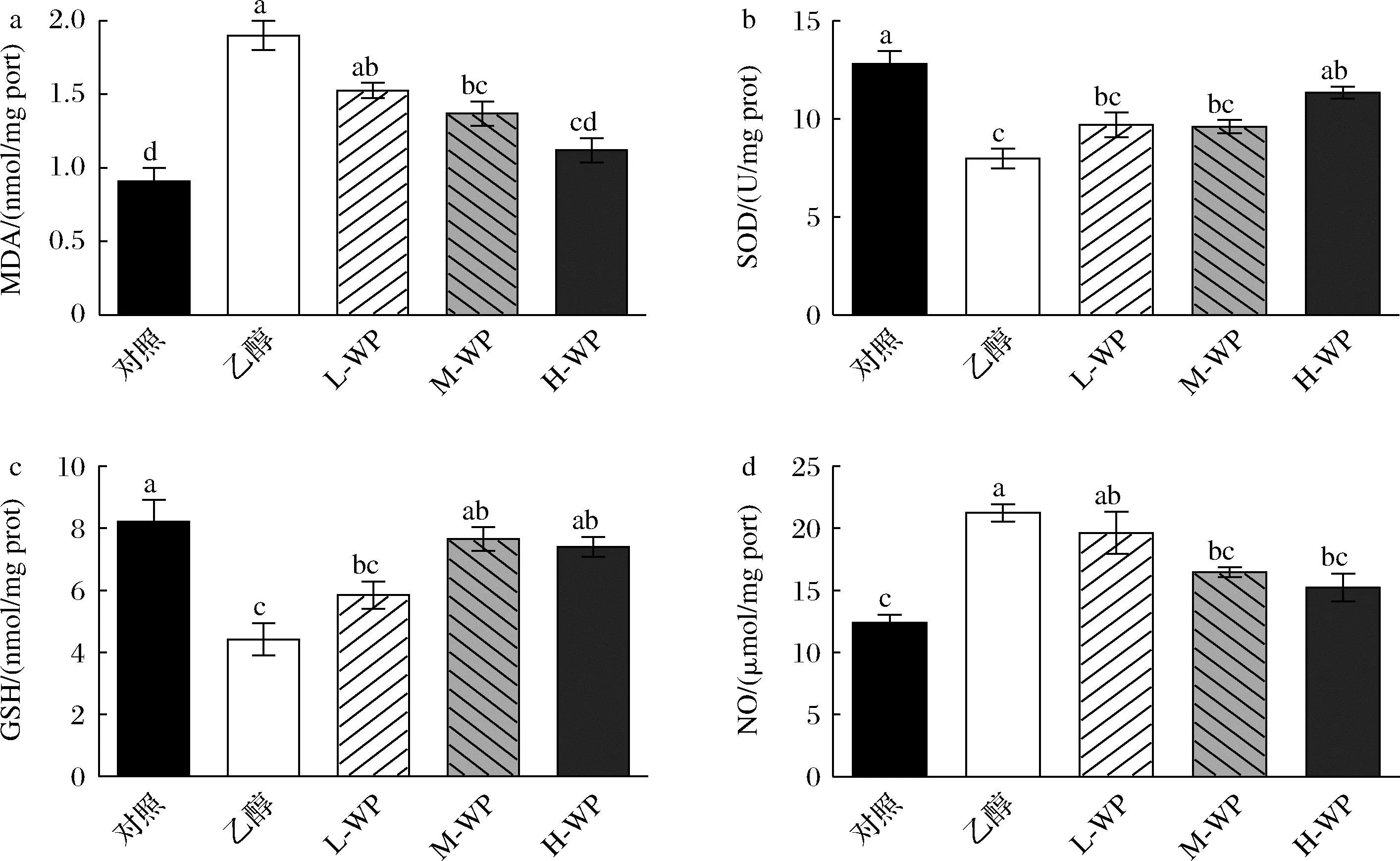
a-MDA;b-SOD;c-GSH;d-NO
2.3 組織學檢查
空白對照組胃組織形態結構較為完整,胃腺組織清晰可見,細胞排列緊密,沒有明顯組織損傷(圖3-a)。模型組胃組織出現明顯胃黏膜上皮黏膜損傷嚴重,固有層糜爛嚴重,腺體排列紊亂,上皮組織受到嚴重破壞(圖3-b)。小麥肽預處理對胃黏膜具有保護作用,其中0.3 g/kg小麥肽處理后,小鼠胃組織上皮細胞脫落減少,胃黏膜固有層糜爛減輕,胃組織損傷較為嚴重(圖3-c)。0.6 g/kg組小鼠胃組織上皮細胞脫落減少,部分位置存在輕微糜爛,腺體排列整齊,胃組織黏膜損傷減輕。0.9 g/kg的小麥肽預處理對胃組織潰瘍具有顯著改善作用,腺體結構完整,細胞排列完整,局部存在細胞脫落(圖3-d和圖3-e)。
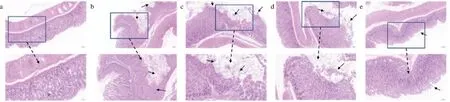
a-對照;b-乙醇;c-L-WP;d-M-WP;e-H-WP
2.4 小麥肽對乙醇誘導胃組織炎癥的影響
炎癥是乙醇誘導胃黏膜損傷的重要因素,我們檢測了乙醇誘導小鼠胃黏膜損傷后,胃組織中炎癥相關蛋白IL-1β、IL-6、TNF-α和MPO的相對表達變化(圖4)。乙醇處理后,模型組中促炎因子(IL-1β、IL-6、TNF-α)與MPO蛋白表達量顯著提高(P<0.05)。小麥肽預處理抑制了乙醇誘導胃組織炎癥,3個小麥肽組中IL-1β、TNF-α與MPO表達水平顯著降低(P<0.05)。炎癥因子IL-6在中、高劑量小麥肽處理后顯著降低。因此,小麥肽可能通過降低乙醇誘導的炎癥反應改善胃黏膜損傷。
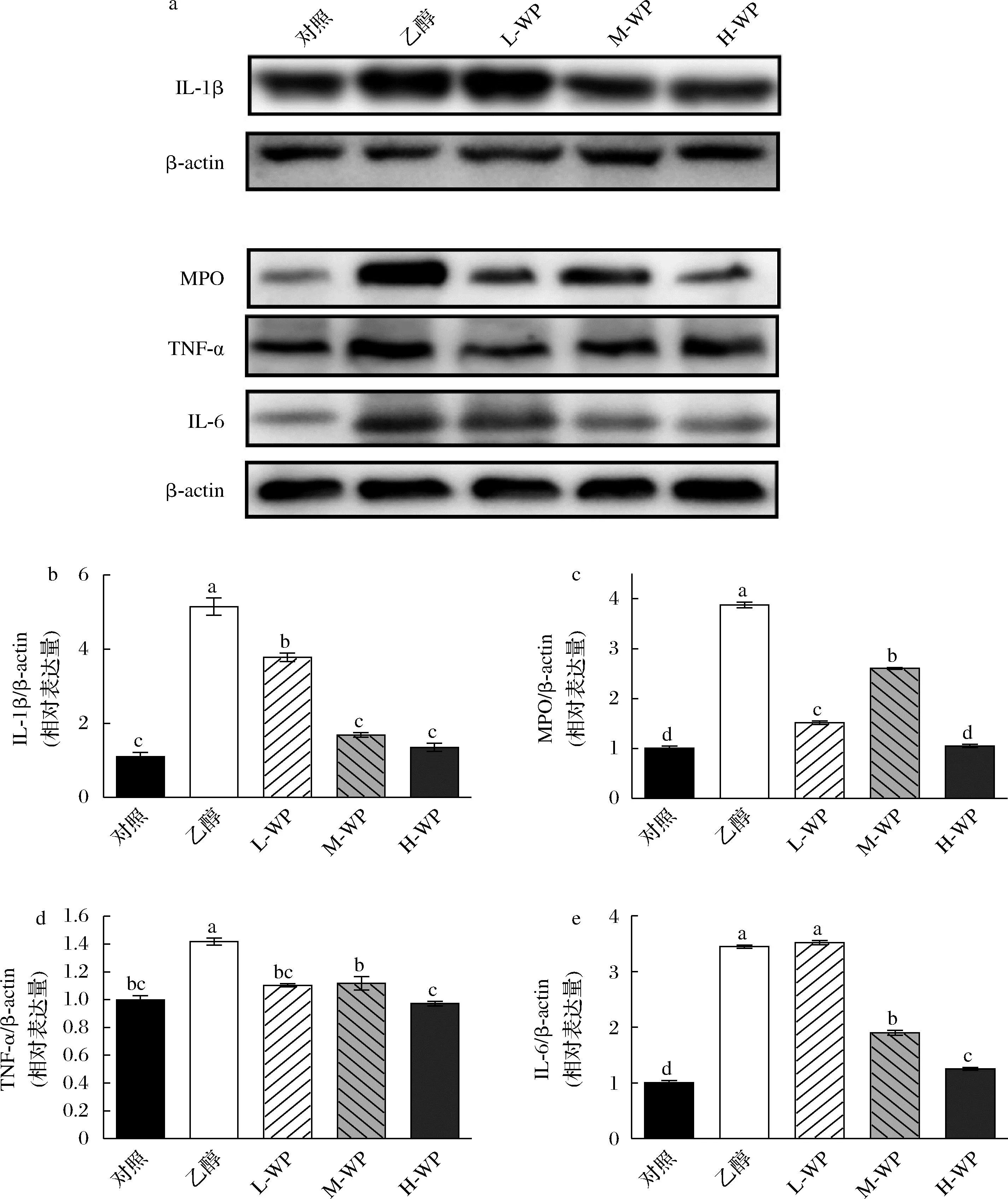
a-組織中炎癥因子相對表達量;b-IL-1β;c-MPO;d-TNF-α;e-IL-6
2.5 小麥肽對GES-1存活率的影響
實驗使用CCK-8法評估小麥肽與乙醇對GES-1細胞的毒性作用。如圖5所示,通過添加不同濃度的乙醇,選擇適合的乙醇濃度建立細胞損傷模型。實驗結果顯示,當乙醇體積分數達到5%時,GES-1細胞活力顯著下降(圖5-a),因此,實驗添加5%濃度乙醇以建立細胞損傷模型。用依次增加濃度的小麥肽處理細胞24 h,CCK-8結果顯示,孵育24 h后,200 μg/mL及以上的小麥肽處理顯著增加了GES-1細胞存活率,質量濃度為50、100 μg/mL的小麥肽對GES-1細胞活力無顯著影響(P>0.05)。在細胞部分實驗中,我們確定3個濃度小麥肽(50、100、200 μg/mL)進行后續實驗(圖5-b)。
為驗證小麥肽對乙醇誘導GES-1細胞損傷的保護作用。實驗檢測了使用小麥肽預處理后,乙醇對GES-1細胞存活率影響,結果如圖5-c所示,小麥肽處理顯著改善了乙醇誘導的細胞活性降低(P<0.05)。這表明小麥肽添加對乙醇導致的GES-1細胞損傷具有保護作用。
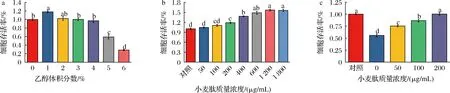
a-乙醇對GES-1細胞存活率的影響;b-小麥肽對GES-1細胞存活率的影響;c-小麥肽預處理后5%乙醇對GES-1細胞存活率的影響
2.6 小麥肽對乙醇誘導GES-1抗氧化能力的影響
與動物實驗一致,細胞實驗檢測了GES-1細胞內SOD酶活力與GSH、MDA 含量。如圖6所示,與空白對照組相比,乙醇模型組MDA含量顯著升高(P<0.05),SOD酶活力與GSH含量顯著降低(P<0.05)。不同濃度的小麥肽處理顯著抑制了細胞中MDA含量升高,SOD酶活力和GSH含量顯著升高。因此,小麥肽能夠有效改善乙醇誘導的GES-1細胞內脂質過氧化反應。
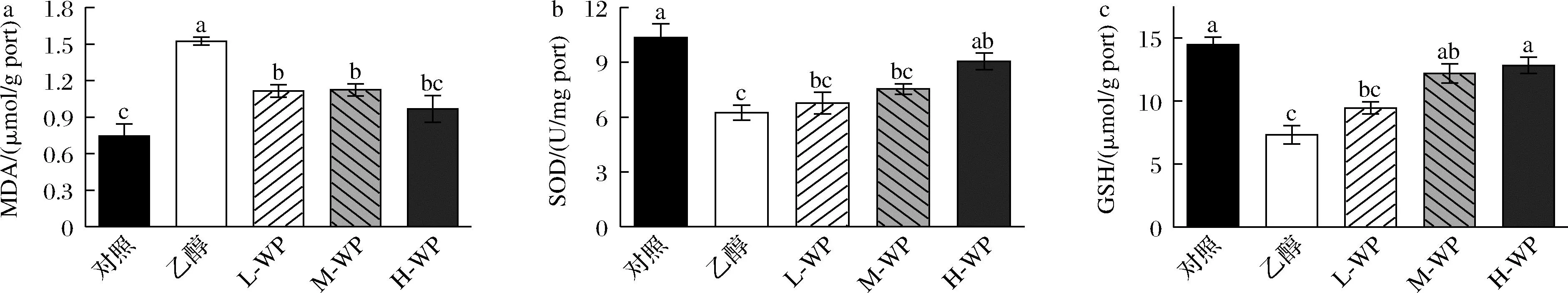
a-MDA;b-SOD;c-GSH
2.7 小麥肽通過PI3K/AKT/Mtor通過激活減輕乙醇誘導胃黏膜上皮損傷
PI3K/AKT/mTOR級聯參與自噬過程的調節已通過多種胃病理學模型的不斷發展的研究得到證實。為探究小麥肽對乙醇誘導胃損傷模型中的自噬相關過程調節作用,實驗檢測了PI3K/AKT/mTOR通路蛋白表達相對變化。實驗發現,與空白對照組相比,乙醇添加激活了PI3K/AKT/mTOR通路相關蛋白表達,p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR 顯著提高(圖7-a)。小麥肽逆轉了乙醇對PI3K/AKT/mTOR通路激活的激活作用,相對于乙醇模型組,小麥肽p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR顯著降低。LC3-Ⅱ水平對應自噬水平,因此,我們通過Western Blot檢測LC3-Ⅱ表達量來分析細胞自噬發生水平。結果如圖7-b所示,中、高劑量的小麥肽預處理組中自噬調控核心蛋白LC3-Ⅱ表達量顯著增加(P<0.05)。
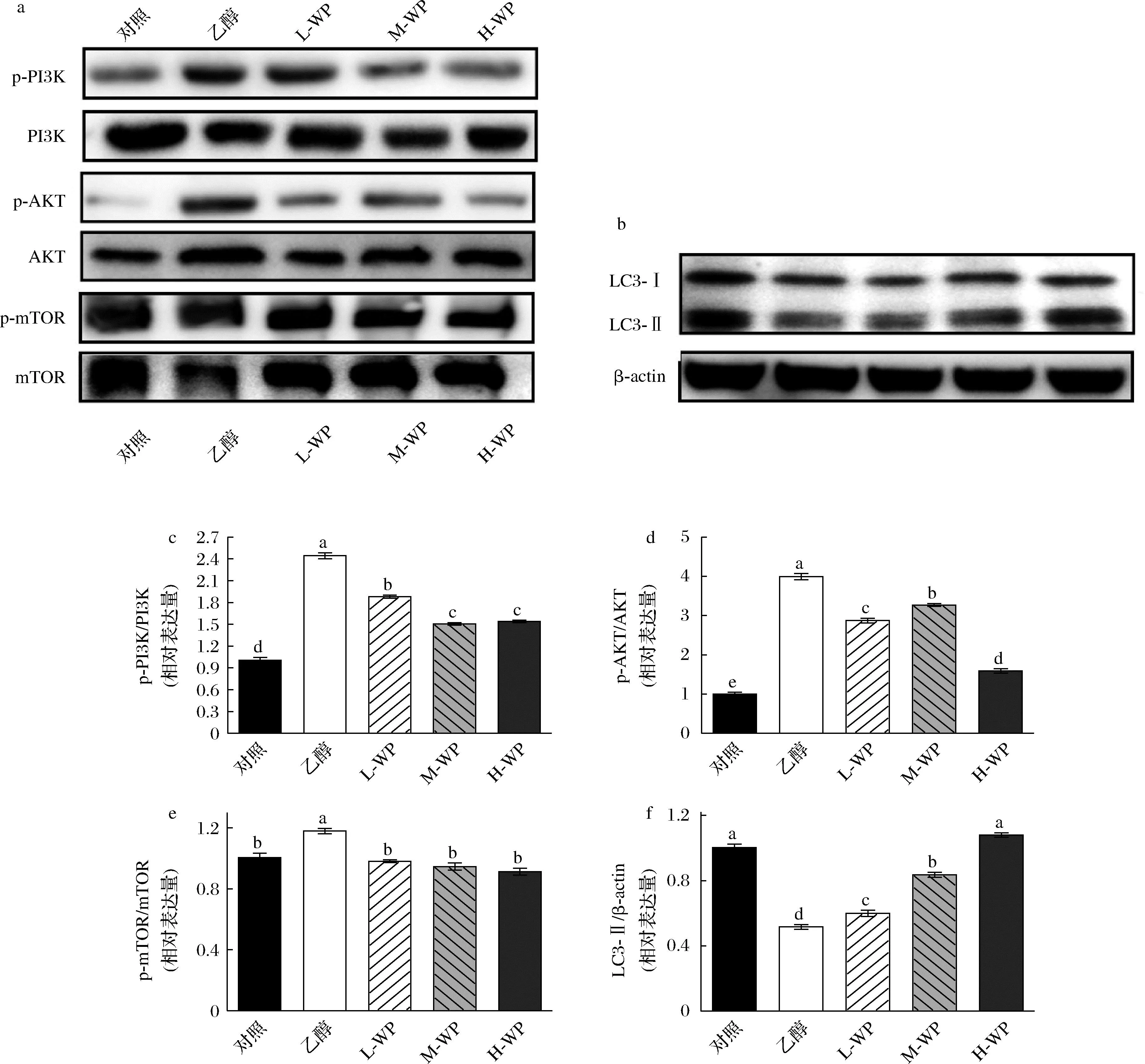
a-PI3K/AKT/mTOR蛋白相對表達量;b-LC3-Ⅱ蛋白相對表達量;c-PI3K;d-AKT;e-mTOR;f-LC3-Ⅱ
3 結論
酒精是導致胃黏膜上皮損傷甚至胃潰瘍的主要外源因素之一,在之前的研究中,酒精可以通過抑制胃細胞自噬反應加劇胃黏膜上皮損傷[7]。小麥肽已被證明具有抗炎、抗氧化特性[12]。本研究的主要發現是小麥肽可以通過減輕乙醇抑制胃組織細胞自噬反應改善胃黏膜損傷。目前研究中,小麥肽在體內研究中改善了乙醇誘導的胃組織損傷,降低了組織內脂質過氧化反應和促炎因子的表達。在體外模型中,小麥肽同樣具有較好的抗氧化能力,同時可以抑制PI3K/AKT/mTOR 通路,提高LC3-Ⅱ蛋白表達,研究結果表明,細胞自噬反應可能是小麥肽改善胃黏膜屏障損傷的潛在機制。
乙醇在胃中被吸收時,胃中存在的酒精脫氫酶會催化乙醇產生乙醛,而胃中存在的黃嘌呤氧化酶會催化乙醛的代謝,產生自由基[13],這在酒精誘導胃黏膜損傷中發揮重要作用。當活性氧代謝物過量產生超過內源性保護因素(如SOD和GSH)時,會導致脂質過氧化發生,從而導致蛋白質的功能喪失和改變,破壞膜組織。小麥肽是一種抗氧化肽,可以通過增強抗氧化酶活力,清除氧化自由基,抑制脂質過氧化發生;此外,小麥肽還具有亞鐵離子螯合能力,調節NF-κB和NRF2相關通路改善細胞氧化損傷。在本實驗中,小麥肽預處理顯著提高了體內體外實驗中細胞內SOD活力和GSH水平,抑制了乙醇誘導的NO含量增加。上述結果表明,小麥肽可以通過增強抗氧化能力和降低NO含量保護乙醇造成的胃黏膜損傷。
氧化應激與炎癥存在于多種消化道疾病中,氧化應激會引起細胞蛋白和DNA損傷、脂質過氧化發生,破壞胃黏膜屏障功能,通透性增加,導致有害物質轉移,誘發炎癥產生[10,14-15],此外,活性氧還會誘導NF-κB與MAPK通路激活,誘導破壞性炎癥的產生[16]。因此,本實驗檢測了小麥肽對炎癥因子和中性粒浸潤標志MPO的表達的影響[17-18]。中性粒細胞浸潤在損傷和炎癥過程中起著至關重要的作用,它在各種組織中聚集和釋放組織破壞物質,包括胃黏膜病變[19]。在本研究中,觀察到乙醇處理小鼠胃內MPO表達量顯著升高,小麥肽降低了胃內MPO蛋白相對表達水平。抑制中性粒細胞滲入是一種重要的抗炎機制,小麥肽可以通過減少中性粒細胞浸潤,改善胃黏膜損傷。此外,小麥肽預處理可以明顯抑制IL-1β等促炎因子的產生,減輕胃部炎癥的發生。這些結果與之前的研究一致[20]。
自噬是一個動態的、進化上保守的過程,在不利條件被激活,以維持蛋白質的新陳代謝和分解代謝之間的平衡,以及細胞的穩態。LC3-Ⅱ被認為是哺乳動物的自噬體標記,并且LC3-Ⅱ的含量總是與自噬體的數量成正比[21-22]。阿司匹林和乙醇處理都被發現通過下調mTOR信號減少自噬誘發的GES-1的凋亡和組織損傷[7]。在本實驗中,乙醇誘導的GES-1細胞中LC3-II蛋白水平下降證明了細胞自噬受損。通過進一步研究發現,乙醇對自噬的抑制作用是由PI3K/AKT/mTOR途徑激活介導的,在乙醇處理后,GES-1細胞中PI3K/AKT/mTOR通路磷酸化增加,通路被激活,自噬受到抑制。小麥肽處理改善了乙醇對自噬抑制作用,抑制PI3K/AKT/mTOR通路激活,并顯著增加了LC3-II蛋白表達量。這些結果表明,小麥肽可能通過調節細胞自噬作用,減輕乙醇對胃黏膜的損傷,但目前的研究還不夠完善,小麥肽調節自噬的作用和機制還需要進一步研究。
本實驗研究了小麥肽對乙醇誘導胃黏膜損傷的影響。實驗結果表明,小麥肽有效改善乙醇誘導的小鼠體重減輕,減少胃黏膜組織損傷,通過體內和體外實驗發現小麥肽可以通過提高抗氧化能力,降低乙醇引起的組織內氧化應激和脂質過氧化水平升高。此外,小麥肽預處理抑制了乙醇導致的組織內中性粒細胞聚集和促炎因子表達。通過體外實驗發現,小麥肽通過抑制PI3K/AKT/mTOR通路,驅動自噬過程。目前,本實驗對小麥肽通過激活自噬調節乙醇性胃損傷研究還不夠全面,需要進一步研究小麥肽對PI3K/AKT/mTOR信號通路調節作用對自噬的影響,全面了解小麥肽對自噬調控機制和胃組織保護作用,這對開發小麥肽作為一種天然膳食補充劑輔助治療酒精性胃炎具有重要意義。

