阪崎克羅諾桿菌雙抗夾心酶聯免疫吸附檢測方法的建立
張欣,王福成,韓先干,祁克宗,宋祥軍,董雨豪,蔣蔚*
(1. 中國農業科學院上海獸醫研究所,上海 200241;2. 南京農業大學動物醫學院,江蘇 南京 210095;3. 安徽農業大學獸醫病理生物學與疫病防控安徽省重點實驗室,安徽 合肥 230036)
阪崎克羅諾桿菌(Cronobactersakazakii)是一種隸屬于腸桿菌科的革蘭陰性菌[1],曾被稱為黃色陰溝桿菌,后更名為阪崎克羅諾桿菌,并設立新屬克羅諾桿菌屬,該屬包括阪崎克羅諾桿菌(C.sakazakii)、丙二酸克羅諾桿菌(C.malonaticus)、蘇黎世克羅諾桿菌(C.turicensis)、廣泛克羅諾桿菌(C.universalis)、莫氏克羅諾桿菌(C.muytjensii)、康帝蒙提克羅諾桿菌(C.condimenti)和都柏林克羅諾桿菌(C.dublinensis)這7個種[2]。阪崎克羅諾桿菌作為一種重要的食源性致病菌,廣泛存在于植物、食品加工原料及環境中,被列為嬰幼兒配方奶粉A類致病菌[3]。2002年,阪崎克羅諾桿菌被列為“某種嚴重危及某些人群生命并遺留終身嚴重后遺癥的病原體”[4]。由于該菌對高溫和滲透壓具有較強的抵抗能力,因此在奶粉的加工、放置、沖調等過程中可大量存活,容易感染嬰幼兒,特別是免疫力低下的人群,引起腦膜腦炎、梗死性結腸炎[5],甚至引起成人的骨髓炎菌血癥和惡性腫瘤,幸存者留有神經系統后遺癥,嚴重者有致死可能[6]。正是由于阪崎克羅諾桿菌具有較強致病性,使得該菌成為全世界范圍的研究熱點。
目前阪崎克羅諾桿菌的檢測方法主要是傳統細菌培養法,但存在檢測周期長、試驗步驟繁瑣等缺點,因此,建立便捷、準確且靈敏度高的檢測方法尤為重要。目前常用的分子生物學檢測手段以PCR[7]和環介導等溫擴增技術[8]等為主,雖靈敏度高,但存在引物設計復雜,對試驗操作技能要求較高,且需要昂貴的設備等問題。雙抗體夾心酶聯免疫吸附(double antibody sandwich enzyme-linked immunosorbent assay,DAS-ELISA)是基于免疫學分析技術建立的快速檢測方法[9],將已知抗體包被于固相載體,待測抗原結合后,再加入檢測抗體,形成單抗原同時結合雙抗體的“夾心”結構,從而特異性檢測抗原。該法無需昂貴復雜的設備,且具有快速便捷、特異性強等優點,因此被廣泛應用在病毒和細菌大批量快速檢測中[10]。
本研究首先制備阪崎克羅諾桿菌效價高、特異性強的單克隆抗體,在此基礎上建立雙抗夾心ELISA的檢測方法,以期滿足阪崎克羅諾桿菌免疫學檢測的不同需求。
1 材料與方法
1.1 菌株和試劑
阪崎克羅諾桿菌CICC21552、CICC21561、CICC21550,廣泛克羅諾桿菌CICC21570,莫氏克羅諾桿CICC23943,蘇黎士克羅諾桿菌CICC24178,丙二酸克羅諾桿菌CICC21551,都柏林克羅諾桿菌CICC21564,單核細胞增生李斯特菌(Listeriamonocytogenes)CICC21662購買自中國工業微生物菌種保藏管理中心。銅綠假單胞菌(Pseudomonasaeruginosa)ATCC9027和金黃色葡萄球菌ATCC6538購買自美國模式培養物集存庫(ATCC)。阪崎克羅諾桿菌CMCC1.6765購買自中國醫學細菌保藏管理中心。大腸桿菌(Escherichiacoli)O157:H7,副溶血弧菌(Vibrioparahaemolyticus)SH112和鼠傷寒沙門氏菌(Salmonellatyphimurium)SL14028由本實驗室保存。
SP2/0缺陷型骨髓瘤細胞由本實驗室保存;4~6周齡昆明小鼠和BALB/c小鼠購自上海杰思捷生物有限公司;辣根過氧化物酶(HRP)標記二抗購買自Abcam公司;抗體亞型鑒定試劑盒購買自Southern Biotech公司。
1.2 阪崎克羅諾桿菌抗體的制備
1.2.1 免疫及血清效價的測定
阪崎克羅諾桿菌標準株在37 ℃震蕩培養至對數生長期,PBS梯度稀釋,平板計數法進行活菌計數。等量混合4株阪崎克羅諾桿菌標準株,用終濃度為0.3%的甲醛滅活,用無菌生理鹽水調整濃度為1.0×1010CFU/mL。首次免疫選用等量弗氏完全佐劑進行完全乳化,足墊注射BALB/c小鼠。間隔2周后進行再次免疫,此時細菌用等量不完全佐劑進行乳化,皮下多點注射。四免后間隔1周,將小鼠斷尾采血檢測效價。選擇血清效價在1∶32 000以上的小鼠,取脾細胞準備進行細胞融合,融合前3 d,用無菌生理鹽水調整菌液濃度為5×109CFU/mL,對小鼠進行腹腔加強免疫。將該阪崎克羅諾桿菌標準菌株按照上述同樣的免疫程序免疫新西蘭白兔,第4次免疫后,耳源靜脈采血并收集血清,利用間接ELISA檢測方法測定效價,同時設置陰性對照(健康家兔血清)。測定免疫兔血清OD450值(P)和陰性對照OD450值(N),P/N≥2.1判定為陽性。
1.2.2 細胞融合及單克隆抗體腹水的制備、效價和單抗亞型測定
無菌分離小鼠脾臟并收集脾淋巴細胞,與骨髓瘤SP2/0細胞進行融合及陽性雜交瘤細胞篩選,并經亞克隆純化細胞株,擴大培養后經小鼠體內誘生單抗腹水獲得抗阪崎克羅諾桿菌單克隆抗體。
阪崎克羅諾桿菌CICC21552滅活后PBS洗3次,經碳酸鹽緩沖液重懸,調整菌液濃度至1.0×1010CFU/mL作為抗原包被96孔酶標板,通過間接ELISA方法測定腹水效價,P/N≥2.1判定為陽性。根據抗體亞型鑒定試劑盒說明書要求,測定單抗的亞型。
1.3 雙抗夾心ELISA檢測方法的建立
抗阪崎克羅諾桿菌兔多抗作為包被抗體(100 μL/孔包被酶標板),4 ℃過夜包被,PBST清洗;每孔加入1%明膠200 μL,37 ℃封閉2 h,PBST清洗;加入檢測抗原(阪崎克羅諾桿菌菌液),同時設置陰性對照(非阪崎克羅諾桿菌菌液),37 ℃溫育2 h,PBST清洗;加入稀釋后的阪崎克羅諾桿菌單克隆抗體,每孔100 μL,37 ℃溫育2 h,PBST清洗;加入HRP標記山羊抗鼠二抗,37 ℃溫育1 h,PBST清洗;加入TMB底物顯色液進行顯色,2 mol/L濃硫酸終止反應后使用酶標儀測OD450吸光值,P/N≥2.1可判定為陽性。
1.4 雙抗夾心ELISA反應條件的優化
棋盤稀釋法確定阪崎克羅諾桿菌抗體最佳包被的稀釋度,阪琦克羅諾桿菌兔多抗作為捕獲抗體,包被濃度按照1∶1 000、1∶2 000、1∶4 000、1∶8 000的梯度進行稀釋。按照上述試驗方法進行清洗及封閉,后續加入檢測抗原(阪崎克羅諾桿菌菌液濃度為1×107CFU/mL),阪琦克羅諾桿菌單克隆抗體5B9株作為檢測抗體,檢測濃度按照1∶1 000、1∶2 000、1∶4 000、1∶8 000的梯度進行稀釋,同時設置陰性對照,其他步驟參照1.3。選擇測定的P/N值最大時,對應的捕獲抗體和檢測抗體的稀釋度為最佳使用濃度。
1.5 陽性判定標準的確定
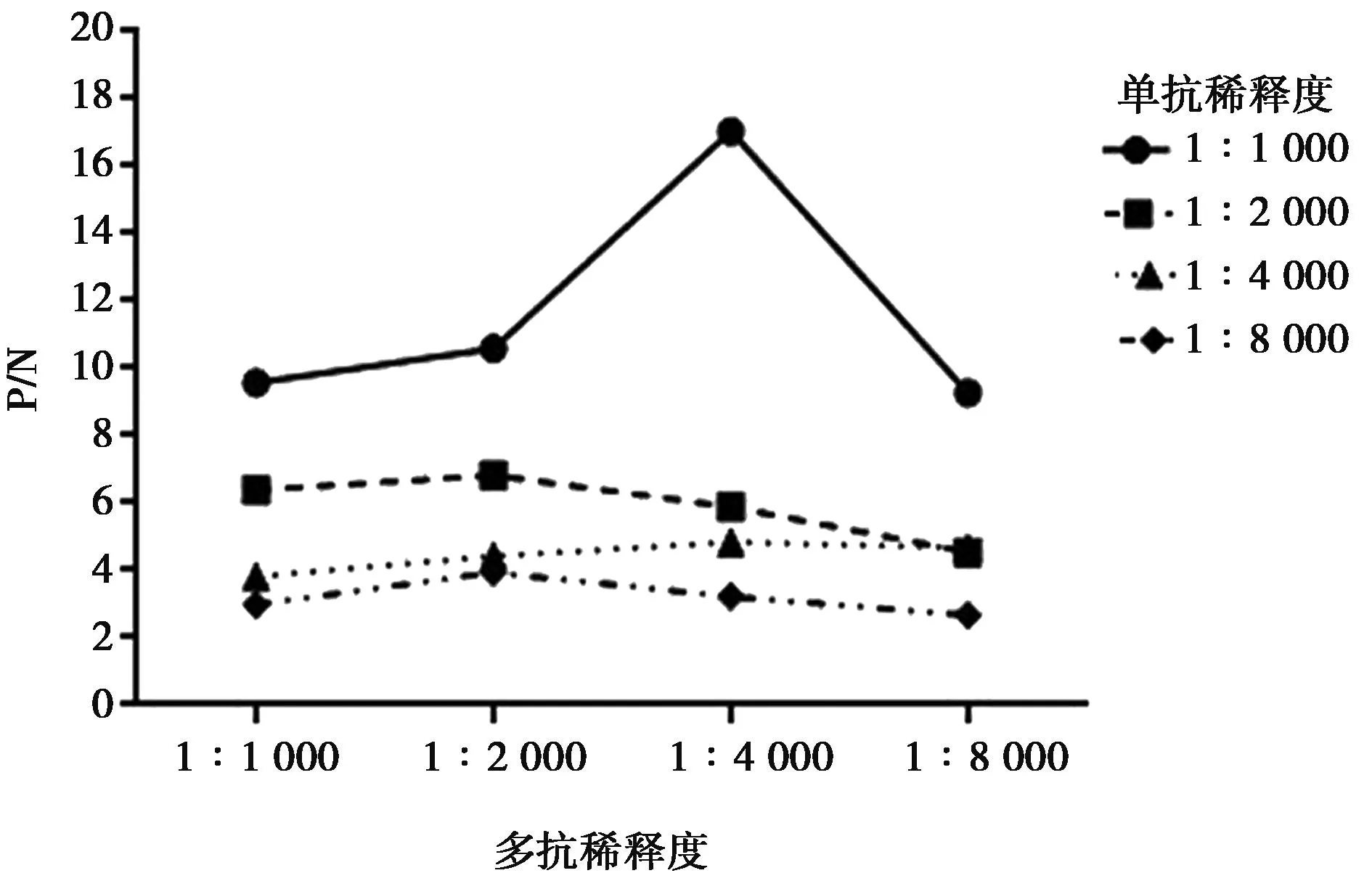
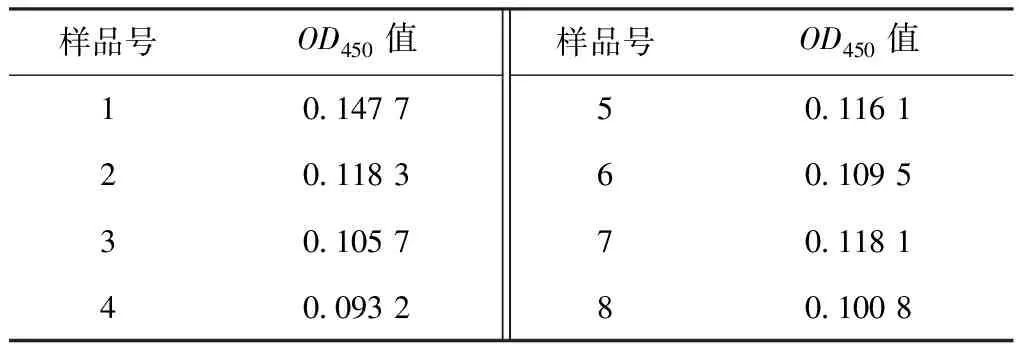
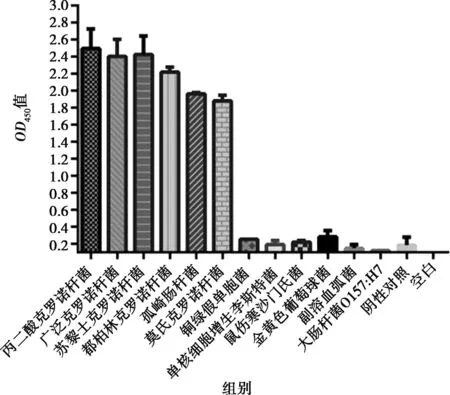
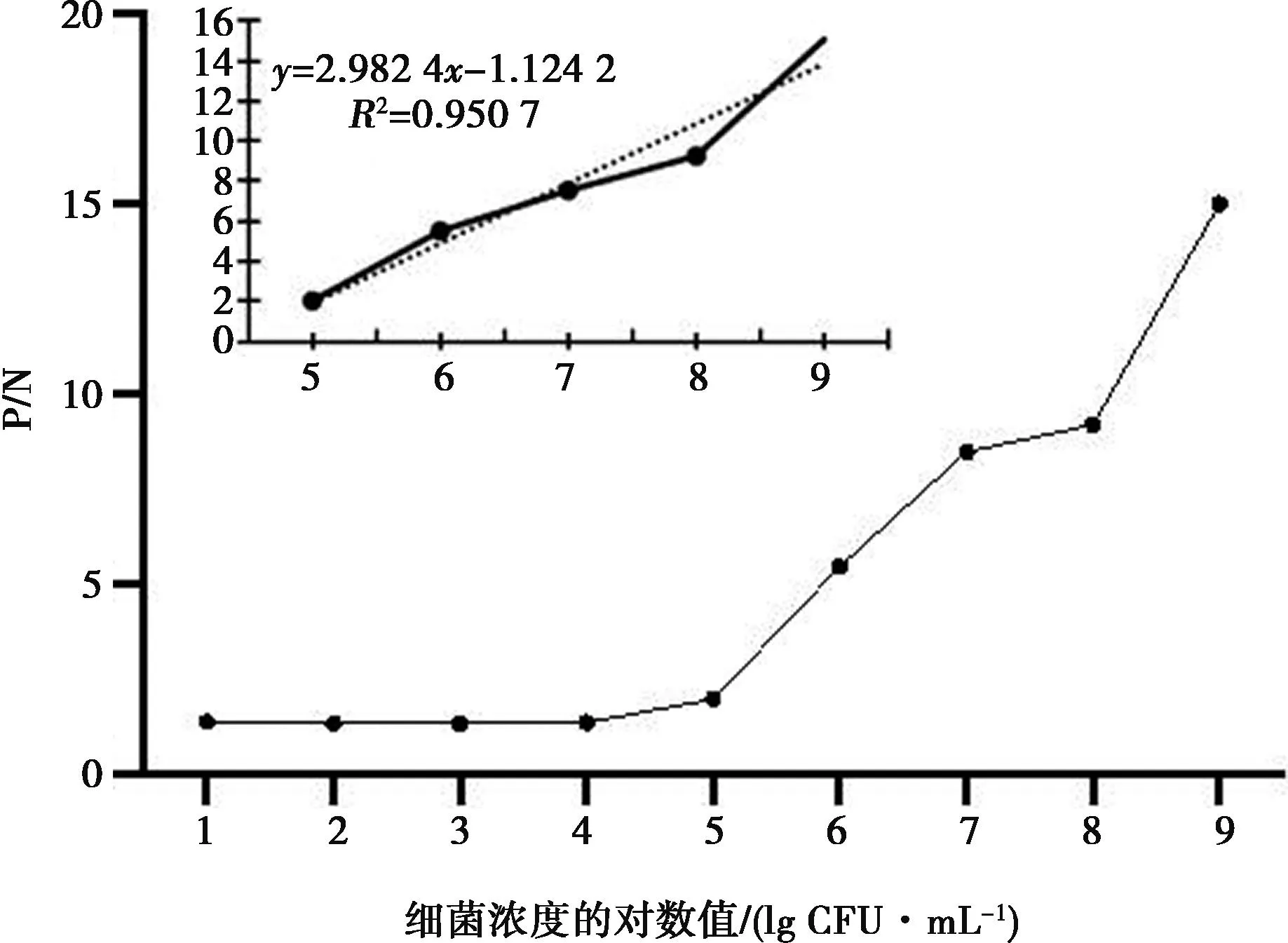
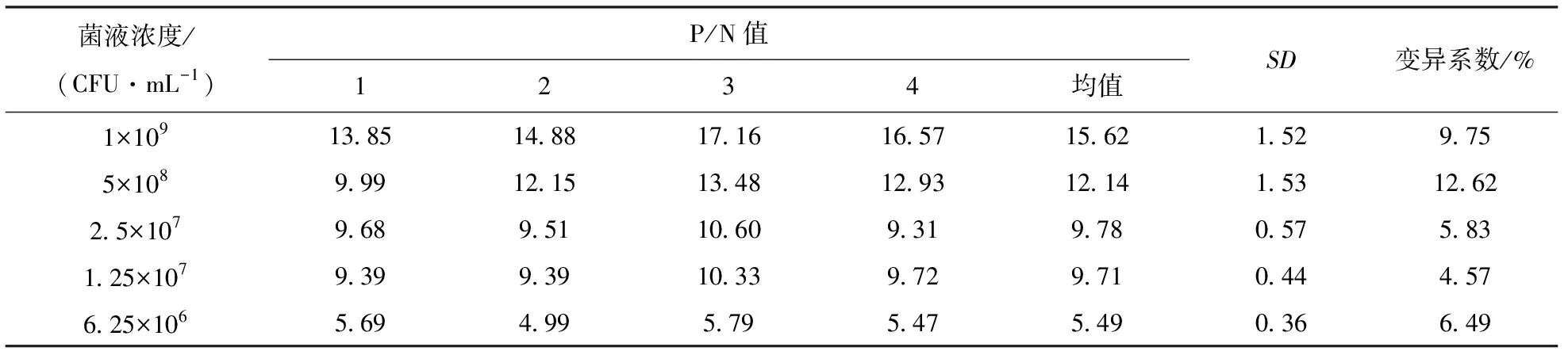
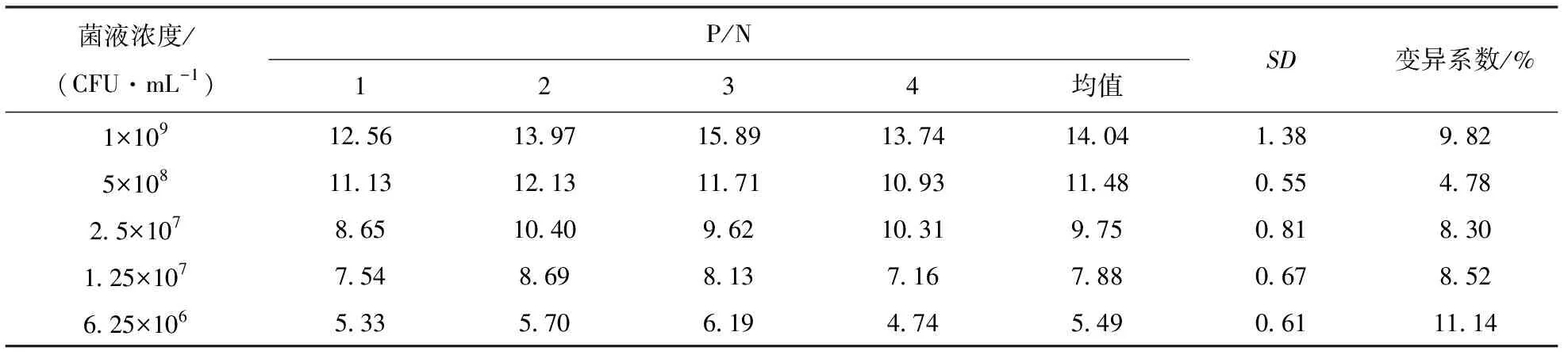
使用以上建立的雙抗夾心ELISA 的檢測方法,取8份陰性樣品用PBS稀釋后,經酶標儀檢測OD450吸光值,并計算OD450的平均值(X)以及標準方差(SD),最終得到的陰陽性臨界值(X+3SD)。當樣本OD450值≥X+3SD時,判定為陽性;當樣本OD450值 分別用金黃色葡萄球菌、鼠傷寒沙門菌、副溶血弧菌、銅綠假單胞菌、單核細胞增生李斯特菌和大腸桿菌O157:H7作為檢測抗原,調整各菌液的濃度為1×107CFU/mL。測定建立的雙抗夾心ELISA方法的特異性,并設置陰性和空白對照(無菌水)。每組設置3個重復,按1.3中的步驟進行檢測。 用阪崎克羅諾桿菌標準菌CICC21552作為檢測抗原進行梯度稀釋(1×108、1×107、1×106、1×105、1×104、1×103、1×102和1×101CFU/mL),測定雙抗夾心ELISA檢測方法的敏感性。顯色結束用酶標儀讀取OD450值。當P/N≥2.1時,可認為是該方法的最低檢測限。 使用批內差異和批間差異對建立的阪崎克羅諾桿菌雙抗夾心ELISA檢測方法進行重復性評價。板內變異:取不同濃度的阪崎克羅諾桿菌CICC21552進行測定,每個濃度在同一塊酶標板上作4個重復,通過對OD450值進行分析,計算板內變異系數。分別在不用時間段包被酶標板,每板做4個重復,共包被5次,對得到的OD450值進行分析,計算板間變異系數。 2.1.1 雜交瘤細胞株的融合篩選及克隆 分別收集多次免疫后7 d的小鼠血清,測其效價。4免后選擇血清效價達到1∶32 000以上的小鼠,收集脾細胞與SP2/0細胞進行融合,在HAT的篩選作用下,融合成功的雜交瘤細胞能夠正常生長,當細胞團生長至一定數量時,抽取細胞上清液進行間接ELISA檢測,篩選測得OD450值在2.0左右的克隆為陽性克隆株,并連續進行4次亞克隆篩選,最終篩選出4株能穩定分泌高滴度抗體的陽性克隆株,命名為3A6、5B9、AC9和EF12。 2.1.2 單克隆抗體 ELISA效價測定 采用間接 ELISA方法依次檢測 4 株單克隆抗體效價。4株細胞株的效價分別為1∶128 000、1∶256 000、1∶32 000和1∶256 000,參照上述血清效價測定方法測定兔血清效價,結果顯示抗體效價隨著免疫次數的增加明顯升高,效價達到1∶128 000(表1)。 表1 雜交瘤細胞株培養上清液抗體效價(OD450值) 2.1.3 單克隆抗體的亞型測定 結果顯示,4種抗體的輕鏈類型皆為Kappa型,單抗細胞株3A6、5B9和2B6重鏈均為IgG1,細胞株EF12重鏈為IgG2a(表2)。 表2 單克隆抗體的亞型鑒定(OD450值) 通過棋盤法對捕獲抗體和檢測抗體稀釋比例進行確定,選擇阪崎克羅諾桿菌兔多抗作為捕獲抗體,阪崎克羅諾桿菌單克隆抗體5B9株作為檢測抗體,HRP標記羊抗鼠作為酶標二抗。結果顯示(圖1),當阪崎克羅諾桿菌兔多抗的稀釋倍數為1∶4 000倍,且阪崎克羅諾桿菌單克隆抗體5B9株稀釋倍數為1∶1 000倍時的P/N值最大,且陰性值為0.091 8,符合陰性值較小的條件。因此,選擇捕獲抗體最佳的稀釋比例為1∶4 000,檢測抗體的最佳稀釋比例為1∶1 000。 圖1 捕獲抗體和檢測抗體最佳工作濃度的優化 由表3可見,采用優化以后的阪崎克羅諾桿菌雙抗夾心ELISA方法,檢測得到的8份陰性抗原的OD450平均值(X)為0.113 7,求得SD為0.015 3,按照公式最終求得的臨界值為0.159 6,當樣本OD450值≥0.159 6,同時滿足P/N≥2.1時,判定為陽性;否則,判定為陰性。 表3 雙抗夾心ELISA檢測方法陰性樣品的OD450值 用上述建立的雙抗夾心ELISA方法檢測細胞株上清液抗體和腹水抗體,結果表明,抗阪崎克羅諾桿菌單克隆抗體僅能與試驗中克羅諾桿菌屬的細菌(蘇黎士克羅諾桿菌CICC24178、丙二酸克羅諾桿菌CICC21551、莫氏克羅諾桿菌CICC23943、廣泛克羅諾桿菌CICC21570、都柏林克羅諾桿菌CICC21564)發生反應,而不能和其他6種常見的食源性細菌(金黃色葡萄球菌、鼠傷寒沙門菌、副溶血弧菌、銅綠假單胞菌、單核細胞增生李斯特菌和大腸桿菌 O157:H7)發生交叉反應(圖2)。 圖2 雙抗體夾心ELISA的特異性 雙抗夾心ELISA檢測方法的敏感性試驗結果表明(表4),該方法最低檢測限可以達到1×106CFU/mL(P/N值大于2.1),建立的雙抗夾心ELISA標準曲線在1×106~1×108CFU/mL 檢測范圍內具有線性關系(R2=0.950 7)(圖3)。 圖3 雙抗體夾心ELISA檢測方法的最低檢測限 表4 雙抗夾心ELISA檢測方法敏感性確定 2.6.1 板內變異系數 板內變異系數結果顯示,板內變異系數最小為4.57%,最大為12.62%,最大值不超過15%,因此具有良好的重復性,結果見表5。 表5 板內變異系數的確定 2.6.2 板間變異系數 板間變異系數結果顯示,板間變異系數最小為4.78%,最大為11.14%,最大值不超過15%,因此具有良好的板間重復性,見表6。 表6 板間變異系數的確定 阪崎克羅諾桿菌免疫學檢測方法主要有膠體金試紙條[11]、酶聯免疫吸附試驗、免疫磁珠[12]等,這些檢測方法的適用性與所制備抗體的性能密切相關。因此,獲得高親和性和特異性的單克隆抗體對免疫檢測方法的建立尤為重要。 國家食品安全標準及進出口乳品檢驗檢疫條例中明確規定,嬰兒乳制產品中不得檢出阪崎克羅諾桿菌[13]。克羅諾桿菌屬包含阪崎克羅諾桿菌等7個種,且均具有致病性。本研究最終篩選出的單克隆抗體對克羅諾桿菌屬6個菌種均具有陽性反應,且對其他的食源性致病菌均沒有交叉反應,特異性良好,為建立針對阪崎克羅諾桿菌的免疫學檢測方法打下良好基礎。 基于單抗的免疫檢測方法,如免疫膠體金層析法、ELISA、間接免疫熒光檢測方法等,已經廣泛應用于細胞生物學、微生物學、免疫學等相關臨床診斷[14-16]。該免疫學檢測方法可以進行定性或定量檢測,具有高效,專一性強等優點,已成功用于很多重要致病菌的快速檢測,如肺炎克雷伯菌(Klebsiellapneumoniae)[17],沙門菌(Salmonella)[18]和嗜肺軍團菌(Legionellapneumophila)[19]等。與Song等[20]和丁銘[21]建立的阪崎克羅諾桿菌免疫檢測試紙條法相比,本研究建立的雙抗夾心ELISA方法的檢測限可達1.0×106CFU/mL,提高了近10倍,具有更高的靈敏性。此外,本研究建立的雙抗夾心ELISA檢測方法具有良好的特異性,能快速檢測阪崎克羅諾桿菌屬6個重要的致病性菌種,且不和其他常見的食源性病原菌發生交叉反應,為阪崎克羅諾桿菌的快速檢測奠定基礎。 綜上,本研究建立的阪崎克羅諾桿菌雙抗夾心ELISA方法,具有特異性強、檢測結果直觀、試驗操作便捷等優點,且檢測成本較低,可在基層檢測中使用。該方法的建立為阪崎克羅諾桿菌的免疫學檢測提供有力工具,具有極大的應用前景。1.6 雙抗夾心ELISA的特異性和靈敏度測定
1.7 雙抗夾心ELISA的重復性試驗
2 結果
2.1 阪崎克羅諾桿菌單克隆抗體制備


2.2 雙抗夾心ELISA方法的建立
2.3 雙抗夾心ELISA檢測方法陰陽臨界值的確定
2.4 雙抗夾心ELISA檢測方法的特異性
2.5 雙抗夾心ELISA檢測方法的靈敏度

2.6 重復性試驗
3 討論

