蒸汽爆破對瓦尼桑黃子實體多糖提取及降血糖功效影響
范祺,張博華,王麗,王崇隊,張明,馬超
(中華全國供銷合作總社 濟南果品研究所,山東 濟南 250220)
桑黃(Sanghuangporussanghuang)又名桑耳,是一種珍貴的多年生大型藥用真菌[1]。桑黃始載于《藥性論》,具有活血、止血、化飲、止瀉的功效[2]。據統計,桑黃在國外主要分布于東亞、東南亞、澳洲、美洲等地,國內分布于東北、西北、西南等地[3-4]。桑黃含有多糖類、黃酮類、三萜類、多酚類、甾類、吡喃酮類及生物堿等活性成分,其中多糖、黃酮類、三萜類為桑黃的主要功能活性成分[5]。桑黃因具有顯著的抗氧化、免疫調節、抗炎及降血糖等功能而引起了廣泛關注。
蒸汽爆破技術是一種能在毫秒級實現蒸汽爆破的彈射式技術,其原理是原料在高溫、高壓的密閉環境下,物料被通入的水蒸氣濕潤后膨脹,當瞬間釋放壓力時,原料體積迅速膨脹,細胞“爆破”,瞬間打破原料微觀結構,使細胞變成多孔結構,從而促進天然活性成分的溶出[6-7]。蒸汽爆破可以使多糖內部結構發生變化,促進分子間的相互交聯、解聚和新官能團的形成,從而達到改變食品組分加工特性和功能特性的目的[8-9]。有關蒸汽爆破對多糖活性成分的研究已有很多,徐一凡等[10]利用蒸汽爆破處理桑黃子實體多糖,多糖溶出率提高了2 倍以上。張博華等[11]利用蒸汽爆破提取靈芝子實體多糖,經過蒸汽爆破處理后的樣品多糖溶出率是未處理樣品的1.86 倍,表明蒸汽爆破在促進多糖溶出方面具有較強優勢。
瓦尼桑黃(Sanghuangporusvaninii)是一種廣泛栽培的桑黃品種,也是中藥飲片炮制常用的原料[12]。目前,對桑黃子實體的功效研究主要集中在抗腫瘤、抗炎、抗氧化、抗菌和保肝作用方面的研究,而對于降血糖的研究相對較少[13-15]。本研究以瓦尼桑黃子實體為研究對象,通過改變蒸汽爆破參數,提高瓦尼桑黃多糖溶出率,并比較蒸汽爆破處理前后桑黃單糖組成差異,通過α-葡萄糖苷酶體外降血糖試驗和斑馬魚體內降血糖試驗,來驗證蒸汽爆破處理對瓦尼桑黃多糖降血糖功效的提升作用,以期為將來以桑黃多糖為原料開發相關降血糖藥品提供參考。
1 材料與方法
1.1 材料與試劑
三年生瓦尼桑黃子實體:臨清市黃河故道古桑黃研發中心;16 種單糖標準品(巖藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、葡糖醛酸、氨基半乳糖鹽酸鹽、鹽酸氨基葡萄糖、N-乙酰-D 氨基葡萄糖、古洛糖醛酸、甘露糖醛酸)(均為分析純):江蘇博睿糖生物有限公司;苯酚、濃硫酸、過氧乙酸鈉、碳酸鈉、亞硝酸鈉、氫氧化鈉、乙醇、磷酸鹽、水楊酸、溴化鉀(均為分析級):上海源葉生物科技有限公司;4-硝基苯基-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside,pNPG)、大黃素、α-葡萄糖苷酶(20 U/mg)、三卡因:美國Sigma 公司;野生型斑馬魚AB 品系:山東省科學院生物研究所;2-NBDG:美國賽默飛世爾科技公司。
1.2 儀器與設備
ME-104 電子天平:梅特勒-托利多儀器有限公司;SHA-B 雙功能水浴恒溫振蕩器:江蘇杰瑞爾電器有限公司;UV1000 紫外分光光度計:上海天美科學儀器有限公司;RE-501 旋轉蒸發儀:上海越眾儀器設備有限公司;TGL-10B 高速臺式離心機:上海安亭科學儀器有限公司;QBS-80 型蒸汽爆破設備:鶴壁政道啟寶實業有限公司;RH-600A 高速粉碎機:浙江榮浩工貿有限公司;ICS5000 離子色譜儀:美國賽默飛世爾科技公司;FT-IR650 傅里葉變換紅外光譜儀:天津港東科技發展股份有限公司;Phenom Pro 型掃描電子顯微鏡:荷蘭復納科學儀器有限公司;SZX16 型熒光顯微鏡及DP2-BSW 圖像采集系統:日本Olympus 公司;Forma 3111型水套式CO2培養箱:美國Forma 公司;斑馬魚養殖飼養設備、恒溫培養箱:北京愛生科技發展有限公司。
1.3 方法
1.3.1 樣品前處理
瓦尼桑黃子實體在80 ℃條件下烘干至恒重,用高速粉碎機粉碎后過80 目篩,即得瓦尼桑黃子實體粉末。
1.3.2 瓦尼桑黃多糖提取及含量測定
參照史玉寶等[16]的方法并稍作修改,精密稱取樣品粉末1.0 g,加50 mL 蒸餾水回流提取2 h,趁熱抽濾,蒸餾水洗滌濾器和濾渣,將提取液水浴濃縮至20 mL,加乙醇100 mL,搖勻。在4 ℃條件下靜置6 h 后,常溫下3 000 r/min 離心30 min,用蒸餾水溶解沉淀并定容至50 mL,采用苯酚濃硫酸法在490 nm 處測定吸光度,并計算多糖含量。
1.3.3 單因素試驗
取瓦尼桑黃子實體粉末100 g,隔夜復水調整含水率至30%,分別研究蒸汽爆破壓力(0.2、0.4、0.6、0.8、1.0、1.2 MPa)和蒸汽爆破維壓時間(60、120、180、240、300、360 s)對物料瓦尼桑黃多糖溶出率的影響,將蒸汽爆破后的樣品收集,80 ℃烘干打粉,多糖提取及含量測定參照1.3.2。
1.3.4 單糖組成測定
1.3.4.1 色譜方法
色譜柱為Dionex CarbopacTMPA20(3 mm×150 mm);流動相A:H2O;流動相B:250 mmol/L NaOH;流動相C:50 mmol/L NaOH 和500 mmol/L NaOAc;流速:0.3 mL/min;進樣量:5 μL;柱溫:30 ℃;檢測器:電化學檢測器。
1.3.4.2 單糖標準溶液配制
取16 種單糖標準品(巖藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖、半乳糖醛酸、葡糖醛酸、氨基半乳糖鹽酸鹽、鹽酸氨基葡萄糖、N-乙酰-D 氨基葡萄糖、古洛糖醛酸、甘露糖醛酸)配制成10 mg/mL 標準溶液。取各單糖標準溶液精密配制0.1、0.5、1.0、5.0、10.0、20.0 mg/L 梯度濃度標準品制作標準曲線。根據絕對定量方法,測定不同單糖質量,根據單糖摩爾質量計算出摩爾比。
1.3.5 掃描電鏡分析
將處理后的瓦尼桑黃子實體粉末樣品于80 ℃烘箱中干燥至恒重,采用濺射鍍膜法進行表面鍍金,在10 kV 加速電壓下掃描,觀察樣品的微觀結構,放大倍數為1 000 倍和5 000 倍。
1.3.6 傅里葉變換紅外光譜儀分析
稱取2 mg 凍干后的瓦尼桑黃多糖和100 mg 干燥KBr 粉末于研缽中研磨均勻,放入壓模器制成透明片后進行掃描,掃描波數4 000~500 cm-1、掃描32 次、分辨率4 cm-1,重復測定3 次。
1.3.7 瓦尼桑黃多糖體外降血糖試驗
瓦尼桑黃多糖抑制α-葡萄糖苷酶的測定參照胡瑩瑩等[17]的方法并稍作修改,于試管中依次加入0.5 mL濃度為0.1 mmol/L 磷酸鹽緩沖溶液、0.5 mL 樣品溶液和0.1 mL α-葡萄糖苷酶酶液,37 ℃水浴15 min,加入0.5 mL 濃度為2.5 mmol/L pNPG 溶液,37 ℃水浴15 min,最后加入1 mL 0.2 mol/L Na2CO3終止反應,于405 nm 處測定吸光度,并以阿卡波糖作為陽性參照。α-葡萄糖苷酶活性抑制率(Y,%)的計算公式如下。
式中:A1為不加待測樣品反應后的吸光度;A2為加入待測樣品反應后的吸光度;A3為只加待測樣品反應后的吸光度。
1.3.8 斑馬魚試驗
1.3.8.1 安全劑量試驗
選用受精后3 d(3 days post fertilization,3 dpf)的健康野生斑馬魚AB 品系,加入到24 孔板中培養,每孔10 條魚、2 mL 培養液。設置空白組和樣品組,空白組為正常魚水飼養,樣品組為含有不同濃度的瓦尼桑黃多糖。孔板置于28.5 ℃的恒溫培養箱中培養,每天光照和黑暗時間分別為14 h 和10 h,每天更換新鮮魚水。在顯微鏡下觀察,并對其死亡數目進行統計學分析。
1.3.8.2 促葡萄糖轉運功能測定
選用3 dpf 的AB 品系斑馬魚,加入到24 孔板中培養,每孔10 條魚、2 mL 培養液。隨機分配為空白組(Ctl)、2-NBDG 組、樣品組、陽性藥組(大黃素)。空白組和2-NBDG 組斑馬魚給予正常養魚水飼養。樣品組加入不同濃度多糖樣品,處理1 h,更換新鮮魚水。陽性藥組加入濃度為10 μmol/L 大黃素,處理1 h,更換新鮮魚水。空白組繼續在新鮮魚水中正常飼養,2-NBDG、樣品組和陽性藥組加入濃度為0.6 mmol/L 的2-NBDG,處理3 h,吸出原來的魚水,用新鮮魚水洗滌3 次,用三卡因麻醉,將含有甲基纖維素的載玻片固定斑馬魚拍照,用Image-J 軟件計算斑馬魚體內和眼部的平均熒光強度。
1.4 數據處理
數據采用Origin 9.0 作圖,并用SPSS 20.0 進行顯著性分析。光譜數據使用OMNIC 8.2 軟件進行處理。
2 結果與分析
2.1 蒸汽爆破壓力對瓦尼桑黃多糖溶出率的影響
蒸汽爆破壓力對多糖溶出率的影響見圖1。
由圖1 可知,當蒸汽爆破壓力為0.2~1.2 MPa 時,隨著汽爆壓力的增加,瓦尼桑黃多糖溶出率呈先升高后降低的趨勢。當蒸汽爆破壓力為0.8 MPa 時,瓦尼桑黃多糖溶出率最高,為1.45%。因此,選擇0.8 MPa為最適蒸汽爆破壓力。蒸汽爆破的主要作用機理分為兩方面,一方面是高溫高壓水蒸氣滲入到植物組織內部,在瞬時降壓時導致細胞壁表面產生裂縫和微孔,在提取時,提取溶劑更容易滲入,促進可溶性多糖溶出;另一方面是由于蒸汽爆破過程的高溫高壓條件會引發纖維素和木質素等大分子物質部分降解成糖類,一定程度提高了可溶性多糖含量[6]。
2.2 蒸汽爆破維壓時間對瓦尼桑黃多糖溶出率的影響
蒸汽爆破維壓時間對瓦尼桑黃多糖溶出率的影響見圖2。
由圖2 可知,當蒸汽爆破壓力為0.8 MPa、蒸汽爆破維壓時間為60~360 s 時,隨著蒸汽爆破維壓時間的延長,瓦尼桑黃多糖溶出率呈先升高后降低的趨勢。蒸汽爆破維壓時間為240 s 時,多糖溶出率最高,為1.68%,繼續延長維壓時間,多糖溶出率下降,因此選擇240 s 為最適維壓時間。
2.3 蒸汽爆破對子實體單糖組成的影響
表1 為瓦尼桑黃多糖中單糖種類及相對含量的差異。
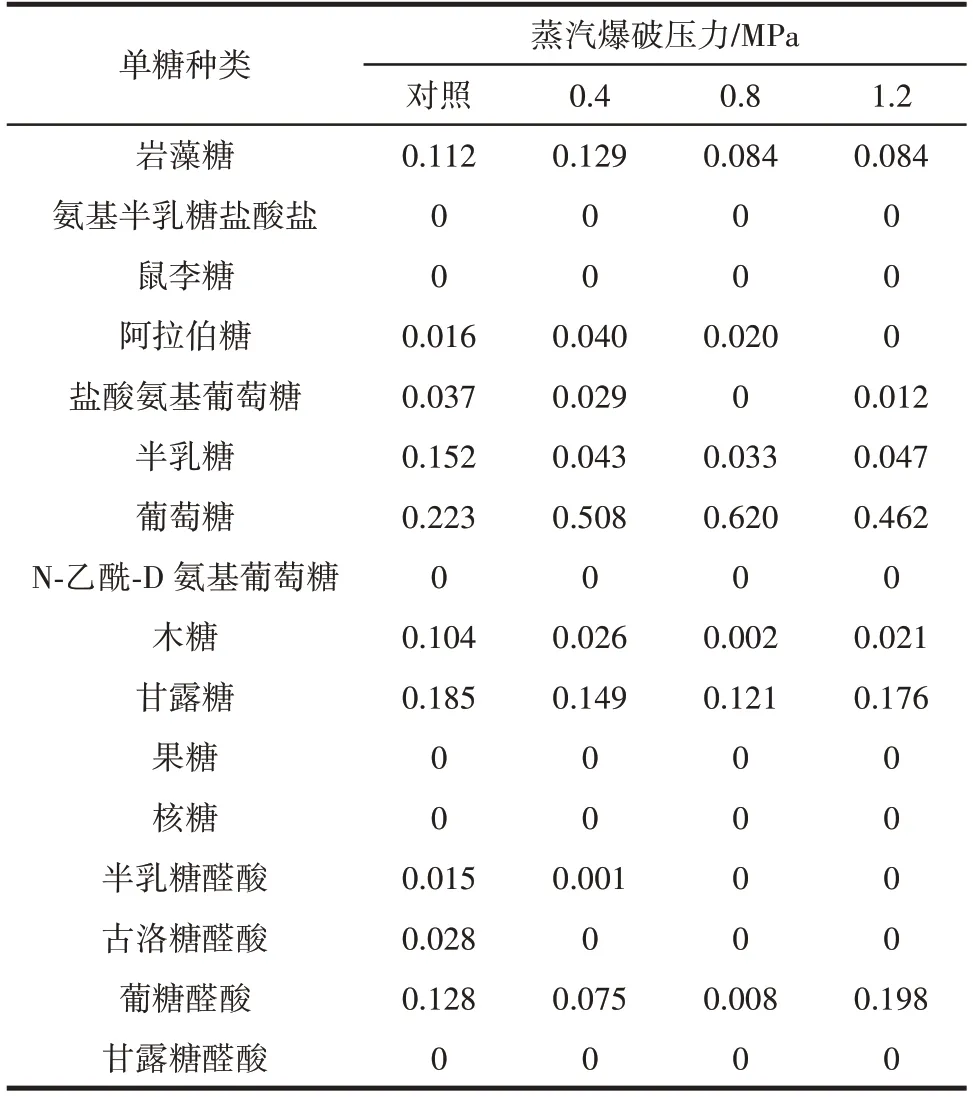
表1 不同蒸汽爆破壓力條件下瓦尼桑黃單糖組成差異Table 1 The difference of monosaccharide composition of Sanghuangporus vaninii under different steam explosion pressures
由表1 可知,瓦尼桑黃中含量相對較高的單糖分別為巖藻糖、半乳糖、葡萄糖、木糖、甘露糖和葡糖醛酸,且葡萄糖占比最高。瓦尼桑黃中均未檢測出氨基半乳糖鹽酸鹽、鼠李糖、N-乙酰-D 氨基葡萄糖、果糖、核糖和甘露糖醛酸。隨著蒸汽爆破壓力的增大,單糖的組成比例也在不斷變化,葡萄糖占比逐漸上升,當蒸汽爆破壓力為0.8 MPa 時,葡萄糖占比達到0.620,而其他單糖(木糖和半乳糖)占比下降,這可能是因為汽爆引發一部分纖維素和半纖維素水解,導致單糖比例產生差異,也可能是高溫高壓環境影響了單糖結構。葛青等[18]發現桑黃子實體中主要的單糖為巖藻糖、阿拉伯糖、半乳糖、葡萄糖、木糖和甘露糖。陳體強等[19]研究發現桑黃子實體多糖主要由甘露糖、半乳糖、葡萄糖組成,摩爾比為0.260∶0.112∶1.000。Kim 等[20]測定的桑黃子實體多糖部分由甘露糖、半乳糖、葡萄糖、阿拉伯糖和木糖組成,與本研究結果相似,同時本研究發現蒸汽爆破后的子實體單糖的組成組分中,葡萄糖的占比提高,而木糖和半乳糖占比下降。蒸汽爆破可以促進水溶性多糖和小分子多糖的溶出,改變功能性多糖的結構。蒸汽爆破通過破壞功能性多糖的結構和氫鍵,改變了多糖中葡萄糖、木糖與半乳糖的相對含量[21]。
2.4 瓦尼桑黃多糖傅里葉變換紅外試驗
瓦尼桑黃多糖組分的紅外光譜結果見圖3。
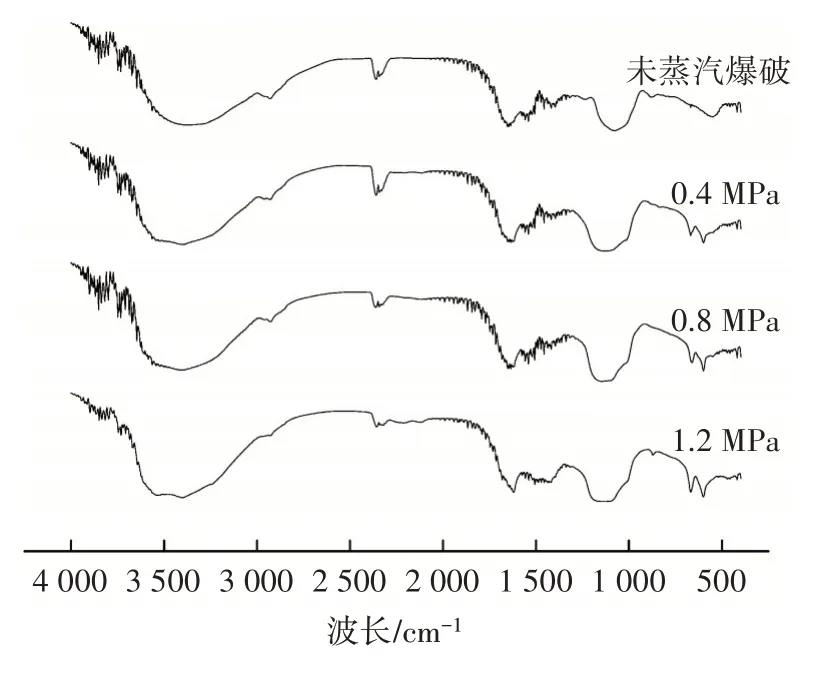
圖3 瓦尼桑黃多糖傅里葉變換紅外光譜圖Fig.3 Fourier transform infrared spectrum of polysaccharide from Sanghuangporus vaninii
由圖3 可知,吸收帶在3 600~3 200 cm-1是—OH的伸縮振動吸收峰,這個區域的吸收峰是糖類的特征峰。蒸汽爆破處理后瓦尼桑黃多糖吸收峰峰形變窄,吸收強度提高,說明蒸汽爆破處理可能破壞了纖維素之間的氫鍵,使更多的羥基基團暴露。3 399 cm-1處是O—H 的伸縮振動吸收峰,是糖類的特征峰。在2 962、2 927 cm-1處有吸收峰,可能歸屬于C—H 伸縮振動。在1 635 cm-1處有一個吸收峰,可能歸屬于結晶水。在1 558 cm-1處有吸收峰,可能歸屬于C O 非對稱伸縮振動。在1 417、1 139、1 072 cm-1處有吸收峰,可能歸屬于C—O 伸縮振動。在1 016 cm-1處有吸收峰,可能歸屬于O—H 變角振動。在875 cm-1處有吸收峰,可能歸屬于吡喃環的端基差向異構C—H 以外的赤道鍵的C—H 變角振動。蒸汽爆破處理后的樣品,吸收峰發生一定程度的紅移,說明蒸汽爆破處理對瓦尼桑黃多糖的微觀結構產生了影響。
2.5 蒸汽爆破對瓦尼桑黃微觀結構的影響
蒸汽爆破處理前后的瓦尼桑黃原料電子掃描顯微鏡結果見圖4。

圖4 瓦尼桑黃子實體電鏡圖Fig.4 Electron microscopic images of Sanghuangporus vaninii
由圖4 可知,未蒸汽爆破時瓦尼桑黃微觀結構完整,呈現樹枝狀,連接緊密。當蒸汽爆破壓力為0.4 MPa時,子實體斷裂,成為片狀;當壓力增加到0.8 MPa,組織結構從內部開始破裂,進一步碎片化;當蒸汽爆破壓力為1.2 MPa 時,瓦尼桑黃呈現疏松的粉末狀。表明蒸汽爆破改變了瓦尼桑黃的微觀結構,蒸汽爆破后瓦尼桑黃內部比表面積和空隙率明顯增大,因此能大大增加與提取試劑的接觸體積,提高多糖的溶出率。
2.6 瓦尼桑黃多糖體外降血糖試驗
以阿卡波糖為陽性對照,測定不同質量濃度瓦尼桑黃多糖及阿卡波糖對α-葡萄糖苷酶活性抑制作用,結果見圖5。
由圖5 可知,瓦尼桑黃多糖對α-葡萄糖苷酶活性產生了明顯的抑制作用。樣品質量濃度在0.1~0.3 mg/mL時,瓦尼桑黃多糖對α-葡萄糖苷酶的抑制作用具有劑量濃度依賴性,經過蒸汽爆破處理的瓦尼桑黃多糖對α-葡萄糖苷酶活性抑制作用更強,多糖濃度為0.3 mg/mL,抑制率達到65%,兩者的抑制作用均低于阿卡波糖的抑制作用。
2.7 斑馬魚試驗
2.7.1 安全劑量
以不同劑量的多糖處理不同時期的斑馬魚幼魚,結果見表2。
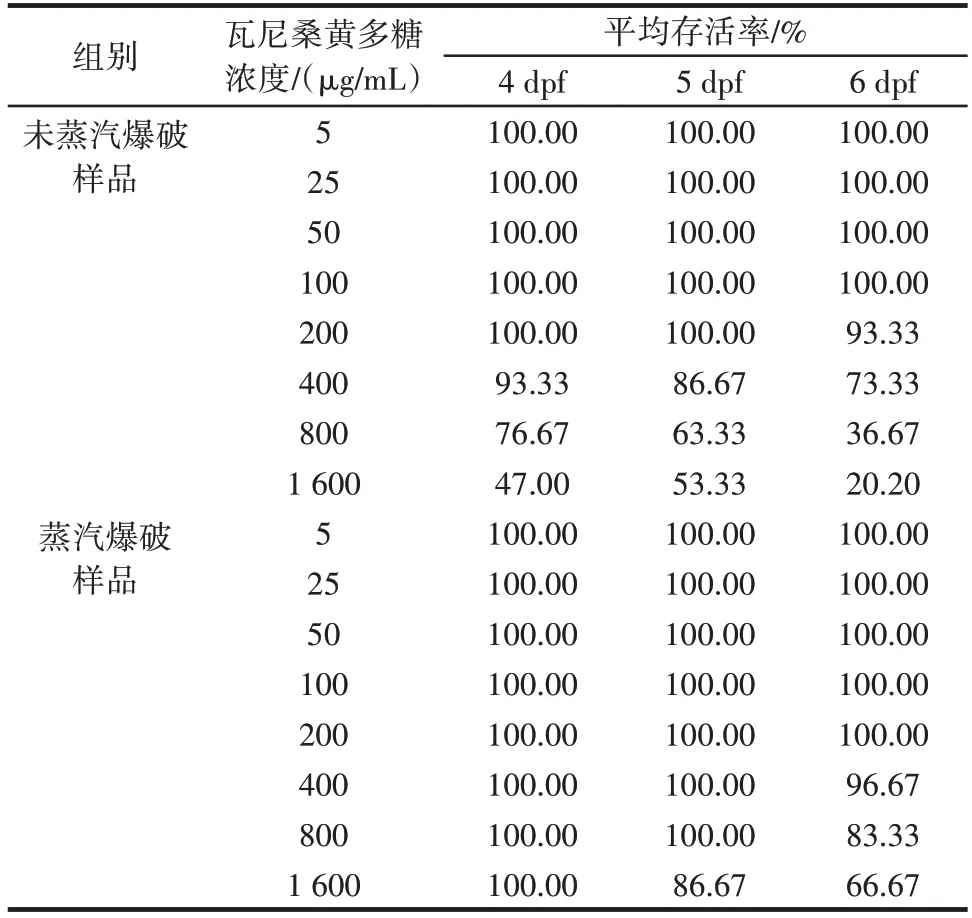
表2 瓦尼桑黃多糖對斑馬魚幼魚安全劑量測試Table 2 Safe dose test of Sanghuangporus vaninii polysaccharide to zebrafish
由表2 可知,在4 dpf 時,經過蒸汽爆破處理的多糖不會引起斑馬魚的死亡,在6 dpf 時,在400 μg/mL的濃度下引起斑馬魚死亡,當多糖濃度為1 600 μg/mL時,死亡率升高明顯。未經過蒸汽爆破處理提取的多糖表現出較強的急性毒性,在400 μg/mL 的濃度下即可引起較高的死亡率。蒸汽爆破影響多糖的組成比例及活性強弱,導致斑馬魚對其耐受度不同。根據以上結果,確定蒸汽爆破處理的多糖的安全劑量為≤800 μg/mL,未蒸汽爆破處理的多糖安全劑量為≤400 μg/mL。
2.7.2 降血糖功效評價
斑馬魚體內熒光效果圖見圖6。
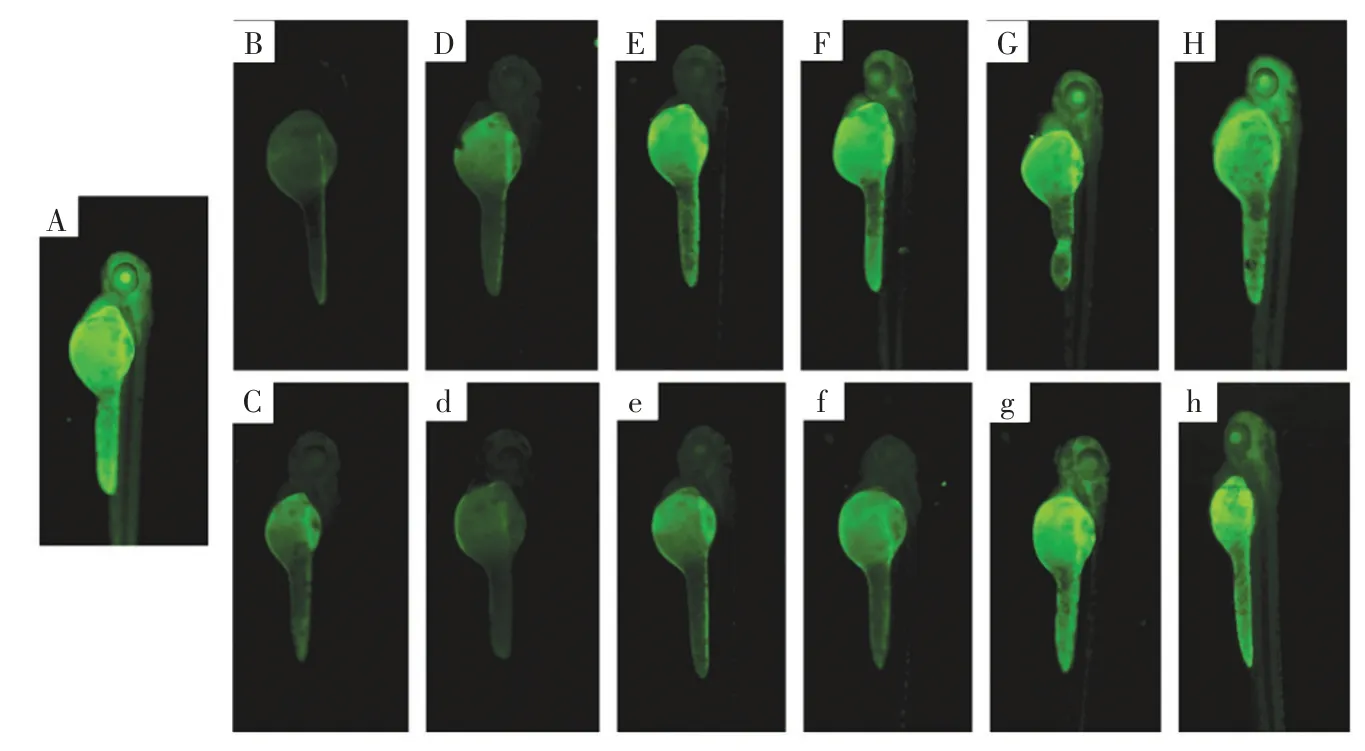
圖6 斑馬魚體內熒光效果圖Fig.6 Fluorescence images of zebrafish
如圖6 所示,空白組斑馬魚體內可以觀察到微弱的綠色熒光,腹腔內熒光強度相對較強,這是由斑馬魚組織內的維生素C、去氫抗壞血酸等小分子化合物產生的熒光。以0.6 mmol/L 2-NBDG 處理3 h 后,斑馬魚體內和眼部的熒光強度均增強,這說明斑馬魚體內能夠攝入一定量的2-NBDG。以蒸汽爆破后的多糖樣品處理斑馬魚1 h,然后用2-NBDG 處理3 h 后,斑馬魚體內和眼部的綠色熒光明顯增強,且熒光強度隨著樣品濃度的增加呈遞增趨勢,表明蒸汽爆破后的樣品可明顯促進2-NBDG 在斑馬魚體內的轉運效率。
瓦尼桑黃多糖、大黃素和2-NBDG 作用下斑馬魚體內和斑馬魚眼部平均熒光強度見圖7 和圖8。
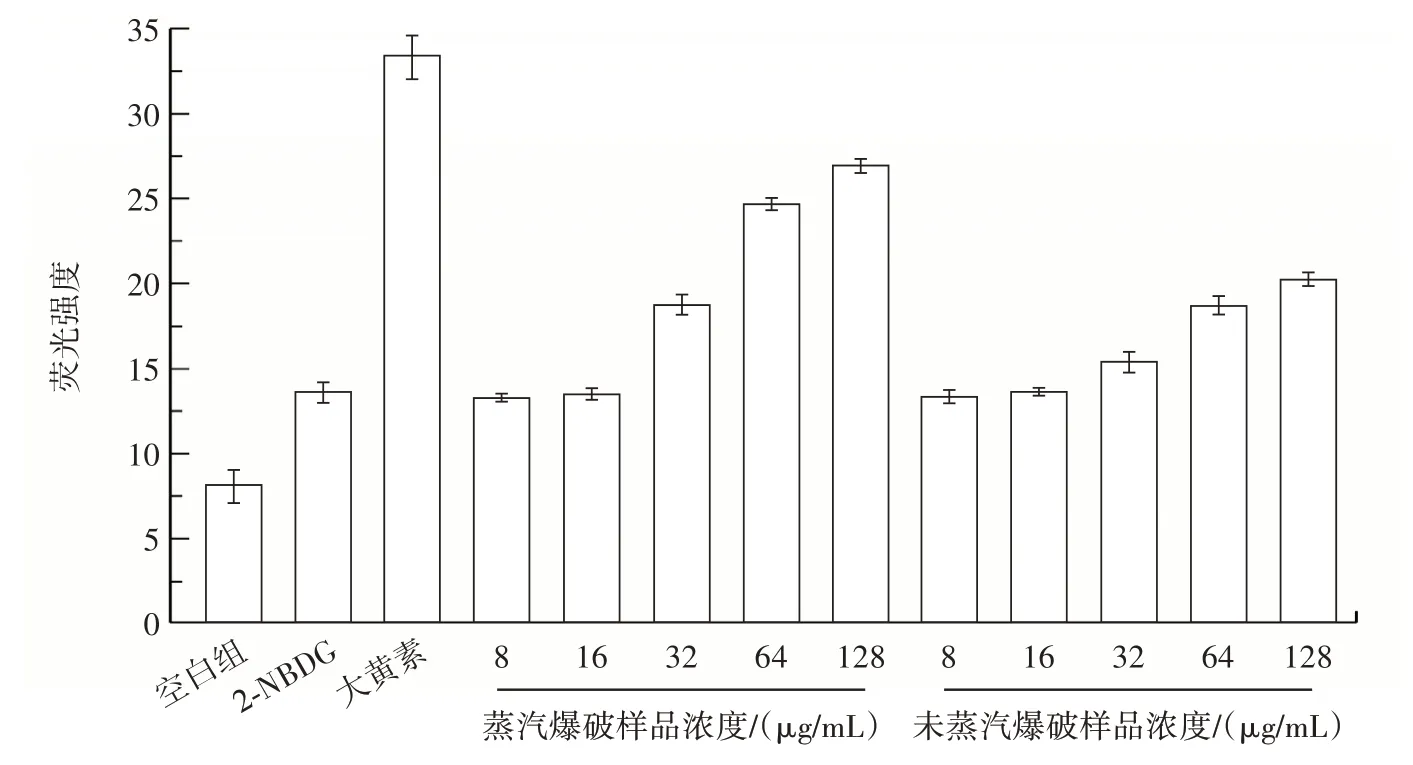
圖7 瓦尼桑黃多糖、大黃素和2-NBDG 作用下斑馬魚體內平均熒光強度Fig.7 Mean fluorescence intensity in zebrafish under the effects of Sanghuangporus vaninii polysaccharide,emodin and 2-NBDG
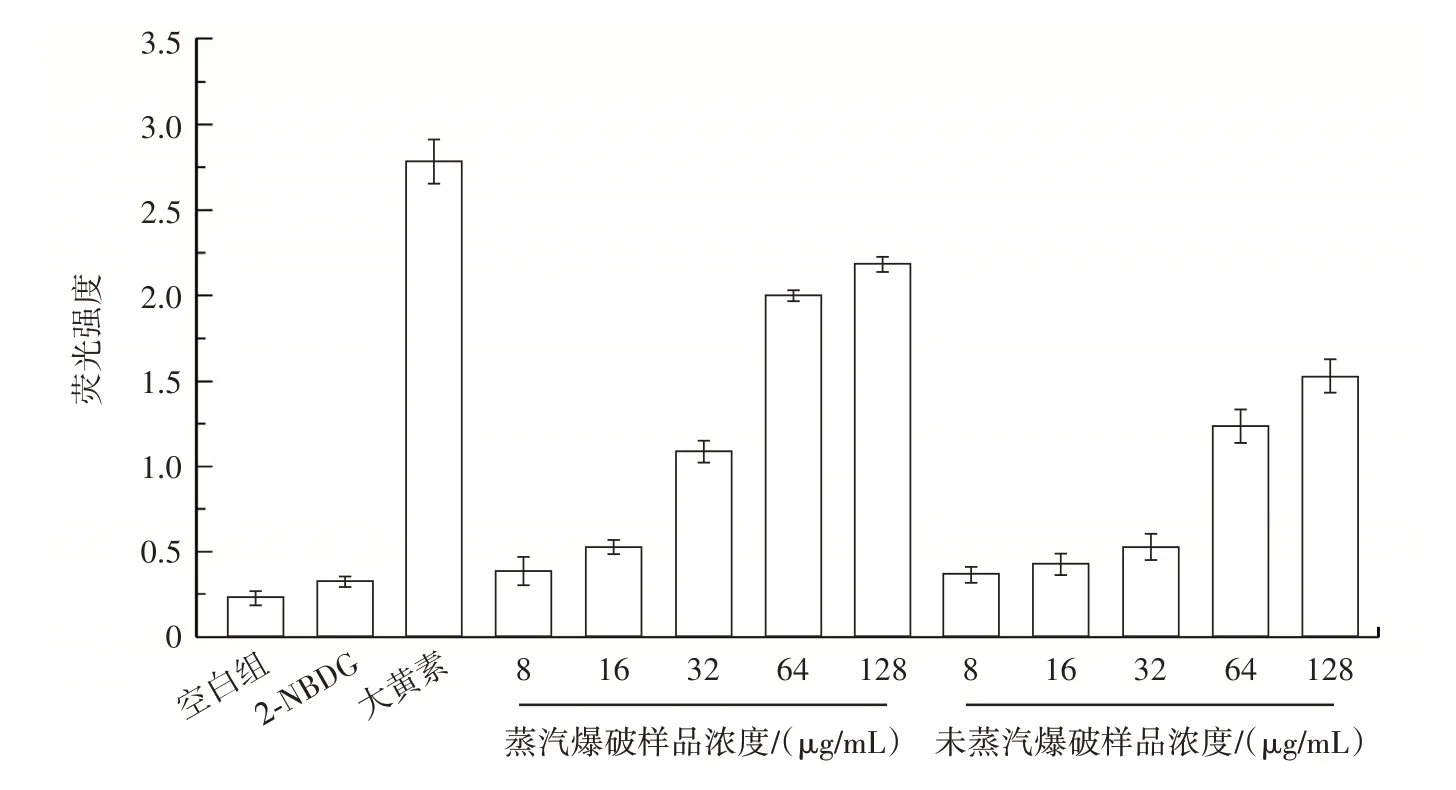
圖8 瓦尼桑黃多糖、大黃素和2-NBDG 作用下斑馬魚眼部平均熒光強度Fig.8 Mean fluorescence intensity in zebrafish eye under the effects of Sanghuangporus vaninii polysaccharide,emodin and 2-NBDG
由圖7 和圖8 可知,經過蒸汽爆破處理的多糖濃度為32 μg/mL 時,斑馬魚體內和斑馬魚眼部的熒光強度顯著增強,當多糖濃度達到128 μg/mL 時,熒光強度最強,與大黃素的促2-NBDG 轉運能力接近。未蒸汽爆破處理的樣品也可以引起斑馬魚體內和眼部的熒光強度增強,但是與蒸汽爆破處理的樣品相比,其強度相對較弱,表明蒸汽爆破后的樣品具有良好的降血糖功效。有關蒸汽爆破促進多糖功能活性的研究已有很多,蒸汽爆破處理后的牛膝多糖抗氧化性顯著增加,清除DPPH 自由基能力由77.9%增至90.1%[22]。Liu 等[23]利用蒸汽爆破提取葡萄中的多糖,發現蒸汽爆破處理后的多糖能明顯提高α-葡萄糖苷酶抑制率。Liang 等[24]研究了蒸汽爆破預處理對茯苓多糖免疫刺激活性的影響,蒸汽爆破處理過的多糖對細胞的吞噬能力、腫瘤壞死因子-α 和白細胞介素-6 的分泌均有促進作用,功能活性增強的原因可能歸結于內部官能團的改變、生物利用度的提高等因素。
3 討論與結論
本研究通過蒸汽爆破預處理瓦尼桑黃,驗證了蒸汽爆破壓力和維壓時間對瓦尼桑黃多糖溶出率的影響。經過蒸汽爆破處理的瓦尼桑黃多糖溶出率明顯提升,最高達到1.68%。但當蒸汽爆破壓力和維壓時間超過一定限度后,多糖溶出率反而下降。過高的蒸汽爆破壓力和過長的維壓時間,容易引起樣品焦化,多糖組織結構破壞嚴重,導致溶出率降低。未蒸汽爆破時瓦尼桑黃微觀結構完整,呈現樹枝狀,連接緊密。經過蒸汽爆破處理后,從內部開始破裂,進一步碎片化,并最終呈現疏松的粉末狀。蒸汽爆破處理后的多糖,吸收峰發生一定程度的紅移,表明蒸汽爆破處理對瓦尼桑黃多糖的微觀結構產生了影響,并且單糖組成比例也發生了變化。
本文探究瓦尼桑黃多糖的降血糖功效,經過蒸汽爆破處理的瓦尼桑黃多糖對α-葡萄糖苷酶活性抑制作用更強,抑制率最高可達65%。在斑馬魚試驗中,蒸汽爆破處理的樣品有更高的安全劑量,可明顯促進2-NBDG 在斑馬魚體內的轉運效率,表明經過蒸汽爆破處理后,樣品的降血糖功效增強。
綜上所述,蒸汽爆破作為一種新穎的預處理方式,不僅可以提高瓦尼桑黃多糖的溶出率,還能顯著提升其降血糖功效。將相關的瓦尼桑黃子實體蒸汽爆破處理,開發降血糖飲片茶,具有重要意義。

