不同葡萄品種灰霉病抗性鑒定及褪黑素抗病機理初探
王憲璞 代瑛姿 郭宏揚 楊志峰 許麗麗
(石河子大學農學院,特色果蔬栽培生理與種質資源利用兵團重點實驗室,新疆 石河子 832003)
葡萄(VitisViniferaL.)是世界四大水果之一,也是重要的經濟作物,栽培面積和產量逐年遞增,截至2022 年,我國葡萄栽培面積位居世界第三[1]。隨著栽培面積的不斷擴大,葡萄病害日益嚴重,其中灰霉病是嚴重危害我國葡萄產業的主要病害之一,病原菌可侵染葡萄全株,造成大量減產,嚴重威脅果農收益[2]。
葡萄種質資源大致可分為東亞種群、美洲種群、歐洲種群和特殊類型的圓葉種群[3],其中東亞種群灰霉病抗性較強,尤其以中國野生葡萄種質資源抗性最高[4],其次是美洲種群和圓葉種群,歐洲種群抗性最低,歐亞雜交種抗性居于歐洲種群與美洲種群之間。Gabler 等[5]對102 個葡萄品種果實接種灰霉病病原菌(Botrytiscinerea)后發現,僅11 個品種對灰霉菌表現為高抗,除皇帝和秋黑表現中等抗性外,其余歐洲葡萄品種均易感病。任志華等[6]對31 個葡萄品種葉片進行灰霉病抗性鑒定,其中歐亞種左優紅等抗性較強,歐洲品種無核白雞心等抗性較差。Rahman 等[7]接種了81 個葡萄品種葉片,發現雷司令和黑比諾表現高感,火焰無核表現感病,刺葡萄紫秋和巨玫瑰表現高抗。
目前,葡萄灰霉病防治多以化學手段為主,如噴施殺菌劑咯菌腈、唑醚·氟酰胺和寡雄腐霉等,具有操作簡便和高效經濟的特點。然而,長期使用化學藥劑嚴重威脅著果園生態環境和食品安全,隨著病原菌發生耐藥性變異,殺菌劑濫用問題也日益嚴峻。近年來有研究表明,果實內源次生代謝活性物質(如苯丙素、白藜蘆醇和木質素)可以激活植物防御信號通路,抵抗病原菌侵染,但其防治效果受多方面因素影響,目前仍處于研究利用的初期階段[8]。褪黑素(melatonin,MT)于1958 年在牛松果腺中被發現,又名美拉酮寧、抑黑素、松果腺素,化學名稱為N-乙酰基-5-甲氧基色胺(N-acetyl-5-methoxytryptamine)[9]。近年來,MT 在生物脅迫中的作用受到廣泛關注。例如用不同濃度MT灌溉蘋果根系,提高了其抗褐斑病能力[10];MT 處理誘導了擬南芥(煙草)致病相關基因的表達,暗示了MT是植物體防御病原體的信號分子[11-13]。此外,MT能誘導依賴水楊酸(salicylic acid,SA)和乙烯的相關基因的表達[14],通過茉莉酸(jasmonic acid,JA)、乙烯和一氧化氮信號途徑,協調合作抵抗病原菌[15-16]。但目前,有關MT 調控葡萄灰霉病抗性的研究報道較少,關鍵抗性機理尚不明確。
因此,本研究以10 個新疆主栽葡萄品種為試材,分別在果實及葉片中接種葡萄灰霉病病原菌Botrytis cinerea,通過病情嚴重度與綜合指標評價其灰霉病抗性;通過施用外源褪黑素研究總酚等次生代謝物在褪黑素誘導葡萄果實抗灰霉病中的作用。研究旨在揭示褪黑素提高葡萄對灰霉病菌抗性的生理機制,從而為褪黑素提高葡萄抗灰霉病的田間應用提供數據支撐,也為發掘、利用優質抗病種質提供理論依據。
1 材料與方法
1.1 試驗材料
灰葡萄孢菌株為西北農林科技大學葡萄酒學院惠贈。供試材料取自新疆主栽葡萄品種。參試葉片來自兩年生盆栽葡萄扦插苗,待植株具20 片功能葉時噴施孢子懸浮液。參試果實取自5 年生露地籬架式葡萄,待果實完全成熟后噴施孢子懸浮液。參試葡萄品種及其遺傳背景見表1。
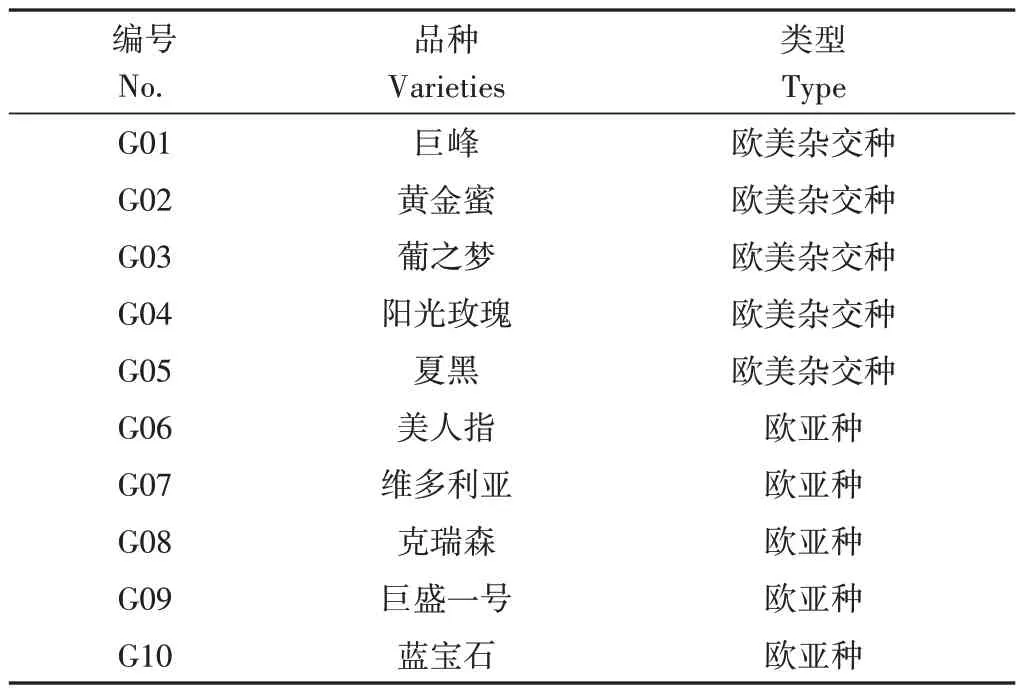
表1 參試葡萄品種信息表Table 1 Information of grape variety tested
1.2 材料處理
將活化的B.cinerea接種在馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA)培養皿中,22 ℃恒溫暗培養7 d,用無菌水沖洗培養基,無菌脫脂棉過濾后收集孢子懸浮液,室溫儲藏(當天使用)。將孢子懸浮液均勻噴施在參試葡萄葉片上,直至葉片表面見水珠滴下,每個品種設置10 株重復;對照為相同體積無菌水,處理方式同上。每隔5 d處理一次,15 d后采集葉片樣品進行抗性理化指標測定。
采集距新梢頂端性狀一致、長勢良好且無病蟲害的3~5 片葉,無菌水沖洗后吸干多余水分,使用經B.cinerea孢子懸浮液濕潤的脫脂棉處理葉片陽面。各參試品種試驗組及對照組均隨機選取2片性狀一致的葉片,每2 d處理一次,采用十字交叉法測量病斑直徑并計算病斑面積大小。每個處理組設置3個生物學重復。
隨機采集成熟期葡萄果穗進行室內離體侵染試驗,處理方式同上。每個品種設置10穗重復。
1.3 測定方法
1.3.1 葉片指標測定 目視法觀察葉片絨毛覆蓋率;YMJ-A型葉面積儀(山東恒美電子科技有限公司)測定葉片葉面積;480-505D型數顯外徑千分尺(桂林量具刃具有限責任公司)測量葉片厚度;稱重法計算葉片相對含水量:樣品相對含水量=(鮮重-干重)/鮮重×100%;HM-YA型葉綠素測定儀(山東恒美電子科技有限公司)測定葉片葉綠素含量;蠟質含量測定參考Jetter 等[17]的方法;葉片電導率測定參照趙世杰等[18]的方法;丙二醛含量測定采用試劑盒法(索萊寶,北京)。
1.3.2 果實指標測定 DS-303P型電子天平(廈門金河源科技有限公司)測量葡萄果實單果重;AK002B 型手持式糖度儀(深圳測友科技有限公司)測定可溶性固形物(total soluble solid,TSS)含量;LX-A 型水果硬度計(溫州韋度量具儀器有限公司)測定果實硬度;果實果膠含量測定參考馬麗等[19]的方法;總酚含量和活性氧清除酶類活性測定采用試劑盒法(索萊寶,北京)。
1.3.3 基因表達水平鑒定 采用實時熒光定量PCR(quantitative real-time PCR,qRT-PCR)鑒定基因表達水平。使用FastPure Plant Total RNA Isolation Kit 試劑盒(RC401,諾唯贊,南京)提取葡萄總RNA;使用HiScriptⅢ RT SuperMix for qPCR(R323,諾唯贊,南京)合成cDNA 第一鏈;利用Primer 5.0 軟件設計特異性定量引物,以β-Actin作為內參基因;數據分析采用2-ΔΔCT法。qRT-PCR引物序列見表2。
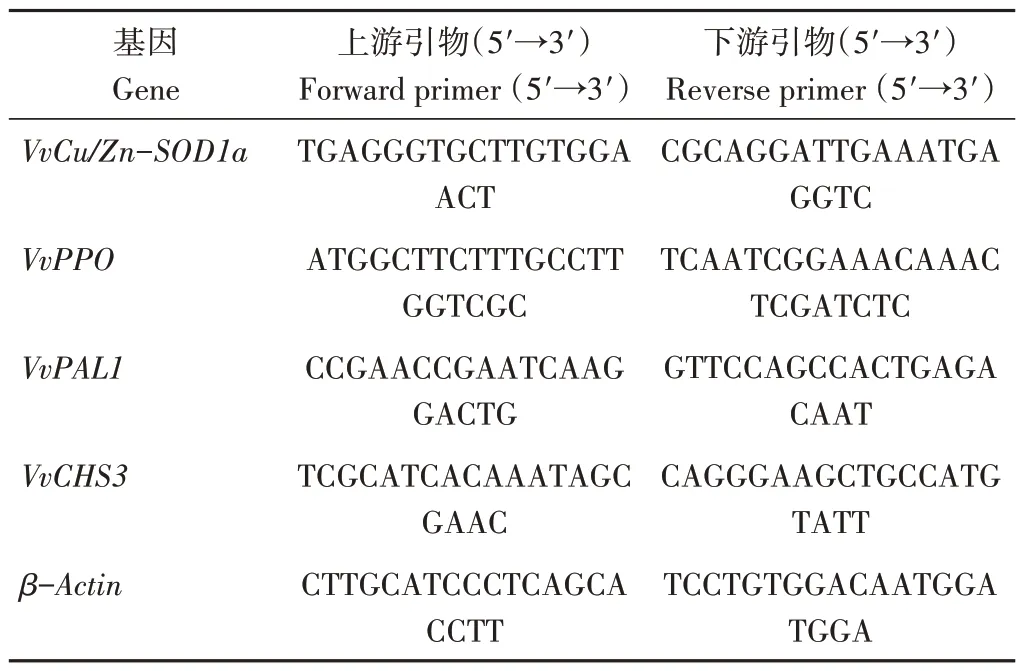
表2 抗氧化酶基因引物序列Table2 Primers of the related genes of antioxidants enzymes
1.3.4 灰霉病抗性綜合評價 利用模糊數學中隸屬函數的方法,采用公式(1)進行原始數據轉化[20],使用SPSS 27.0 軟件進行因子分析;采用公式(2)計算各綜合指標的權重;采用公式(3)計算各葡萄品種綜合抗病能力得分:
Uij表示i品種j指標的灰霉病抗性隸屬函數值,Xij表示i品種j指標的綜合系數,Xjmax表示所有品種中j指標的最大值,Xjmin表示所有品種中j指標的最小值,i表示某個葡萄品種,j表示某個抗性指標[21]。
Wj表示第j個綜合指標在所有綜合指標中的重要程度,Pj為各品種第j個綜合指標的貢獻率。
D為各品種灰霉病抗性綜合評價值。
1.4 數據處理
參考Tantasawat 等[22]的方法,利用公式(4)計算病情嚴重度(disease severity,DS):
依據DS 水平設定葡萄灰霉病抗性分級標準:DS=0 代表免疫;0<DS≤5%代表高抗類型(high resistance,HR);5%<DS≤15%代表抗病類型(resistance,R);15%<DS≤45%代表中抗類型(moderate resistance,MR);45%<DS≤75%代表感病類型(susceptible,S);75%<DS 代表高感類型(high susceptible,HS)。
設置3 次生物學重復。利用SPSS 24.0 進行相關性分析、隸屬函數分析和單因素方差分析(analysis of variance,ANOVA),顯著性水平為0.05,使用Origin 2021軟件作圖。
2 結果與分析
2.1 不同葡萄品種葉片與果實性狀指標測定
10 個葡萄品種基本性狀測定結果表明,除巨峰、葡之夢和陽光玫瑰葉片有絨毛之外,其他均無絨毛覆蓋;參試葡萄品種葉片面積為51.00~116.87 cm2,其中黃金蜜葉面積最大,巨盛一號最小;葉片相對含水量、蠟質含量及葉綠素含量分別為66.97%~71.73%、1.31~2.32 mg·g-1和1.00~2.46 mg·g-1,其中葉片含水量種間差異不顯著,巨峰葡萄葉片蠟質含量顯著高于黃金蜜,為2.32 mg·g-1,黃金蜜葡萄葉片蠟質與葉綠素含量均低于其他品種;果實單果重種間差異較大,其中巨盛一號、巨峰、美人指葡萄單果重達12.13、11.76和11.40 g,顯著高于其他品種;巨峰葡萄果實可溶性固形物、硬度與果膠含量低于其他品種,為16.81%、3.17 kg·cm-1和0.57 mg·g-1(表3)。
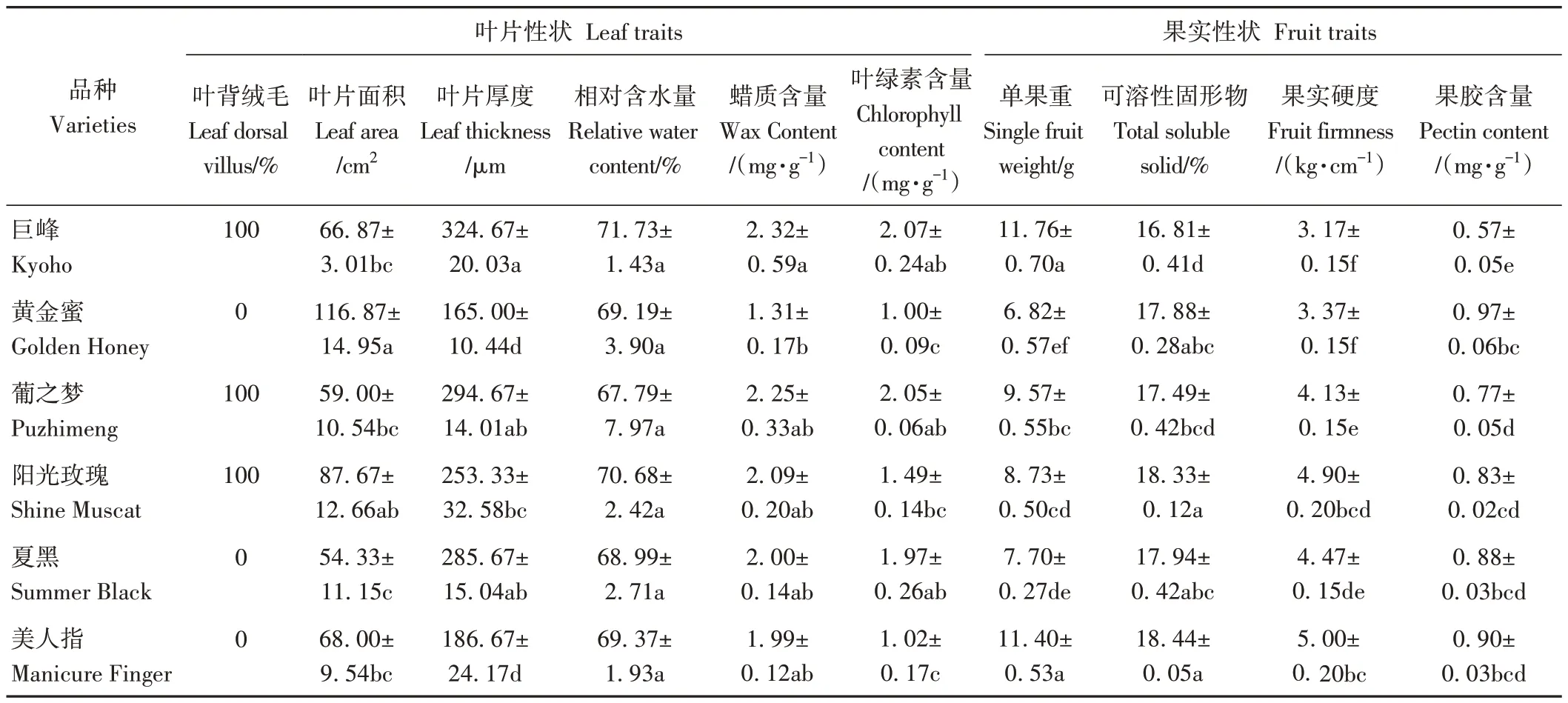
表3 不同葡萄品種葉片與果實基本性狀Table 3 Trait index of leaves and fruits in different grape cultivars
2.2 不同葡萄品種灰霉病抗性水平鑒定
接種B.Cinerea10 d 后,多數參試品種果實和葉片均發生不同程度褐變,抗性水平差異顯著(表4、5)。巨峰和巨盛一號葡萄病情嚴重度均未達15%,接種10 d 后,果實病情嚴重度分別為12.68%和8.94%,葉片病情嚴重度分別為6.00%和12.00%,均屬抗病類型;黃金蜜、葡之夢、夏黑、美人指、維多利亞接種后表現較穩定,第10 天果實病情嚴重度分別為31.12%、32.16%、24.80%、34.37%、32.71%,葉片病情嚴重度分別為30.00%、14.00%、25.33%、24.00%、25.33%,除葡之夢葉片表現為抗病類型外其他均表現為中抗類型;陽光玫瑰、克瑞森和藍寶石在灰霉菌孢子懸浮液處理10 d 后,除藍寶石果實病情嚴重度為36.17%,表現為中抗類型外,其葉片和其他品種的果實、葉片的病情嚴重度均大于50%,表現為感病類型。
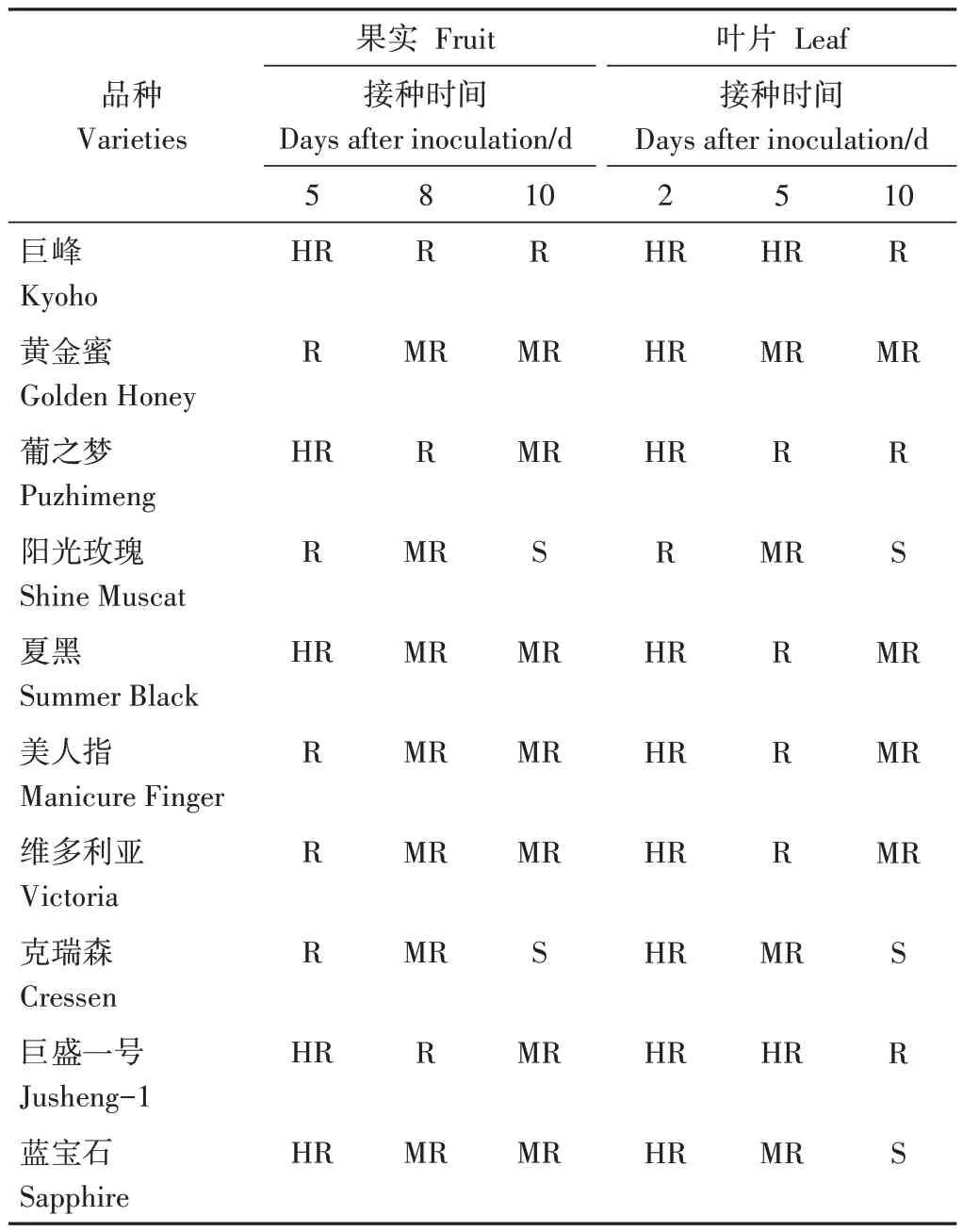
表5 不同品種葡萄果實灰霉病抗性類型Table 5 Resistance classification of different grape varieties to Botrytis cinerea
2.3 不同葡萄品種灰霉病抗性綜合評價
為探究不同葡萄品種葉片和果實基本性狀及接種10 d 后病情嚴重度(采用數值的相反數表示抗性)之間的相關性,采用隸屬函數對參試葡萄品種綜合抗性賦分,綜合評價其灰霉病抗性。對不同葡萄品種12個相互關聯的單項指標進行主成分分析和變量因子分析,結果表明,葉片面積與葉片蠟質含量和單果重顯著負相關;葉片絨毛覆蓋率與蠟質含量顯著正相關,與葡萄果實果膠含量顯著負相關;葉片厚度與蠟質含量及葉綠素含量顯著正相關;葉片蠟質含量與葉綠素含量呈顯著正相關,而與果膠含量顯著負相關;葉片病情嚴重度負數與果實病情嚴重度負數顯著正相關(表6)。前4 個綜合評價指標的累計貢獻率高達87.895%,綜合指標貢獻率分別為48.326%、16.989%、12.834%和9.746%(表7);計算各葡萄品種綜合指標隸屬函數值、權重及綜合得分,其中巨峰的D值最大,而白色葡萄黃金蜜與紅色葡萄克瑞森的D值僅為0.10 和0.14,說明兩者綜合抗性最弱(表8)。
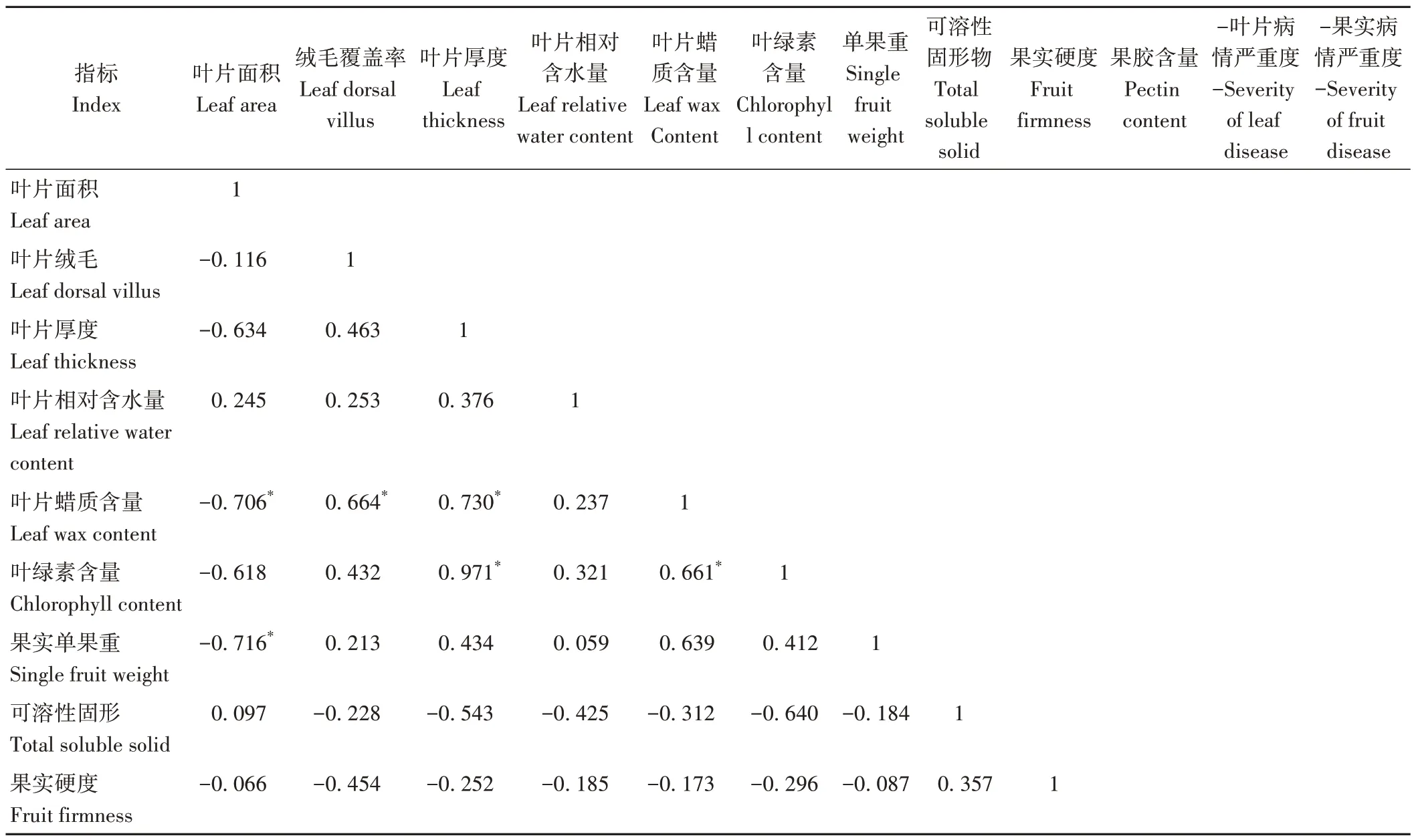
表6 不同葡萄品種各個指標之間的相關性分析Table 6 Correlation analysis of various indicators of different grape varieties
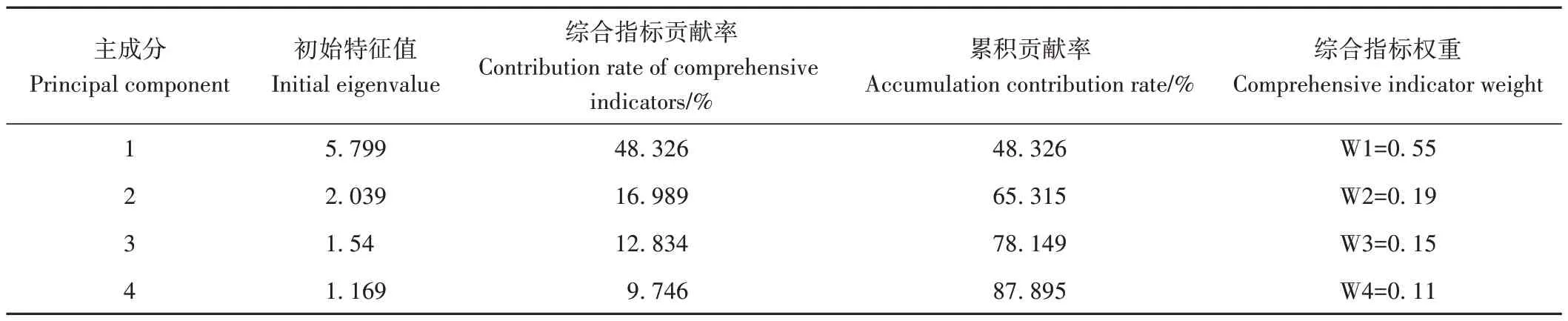
表7 不同葡萄品種主要指標特征值、貢獻率及綜合權重分析Table 7 Analysis of characteristic value,contribution rate and comprehensive weight of main indexes of different grape varieties
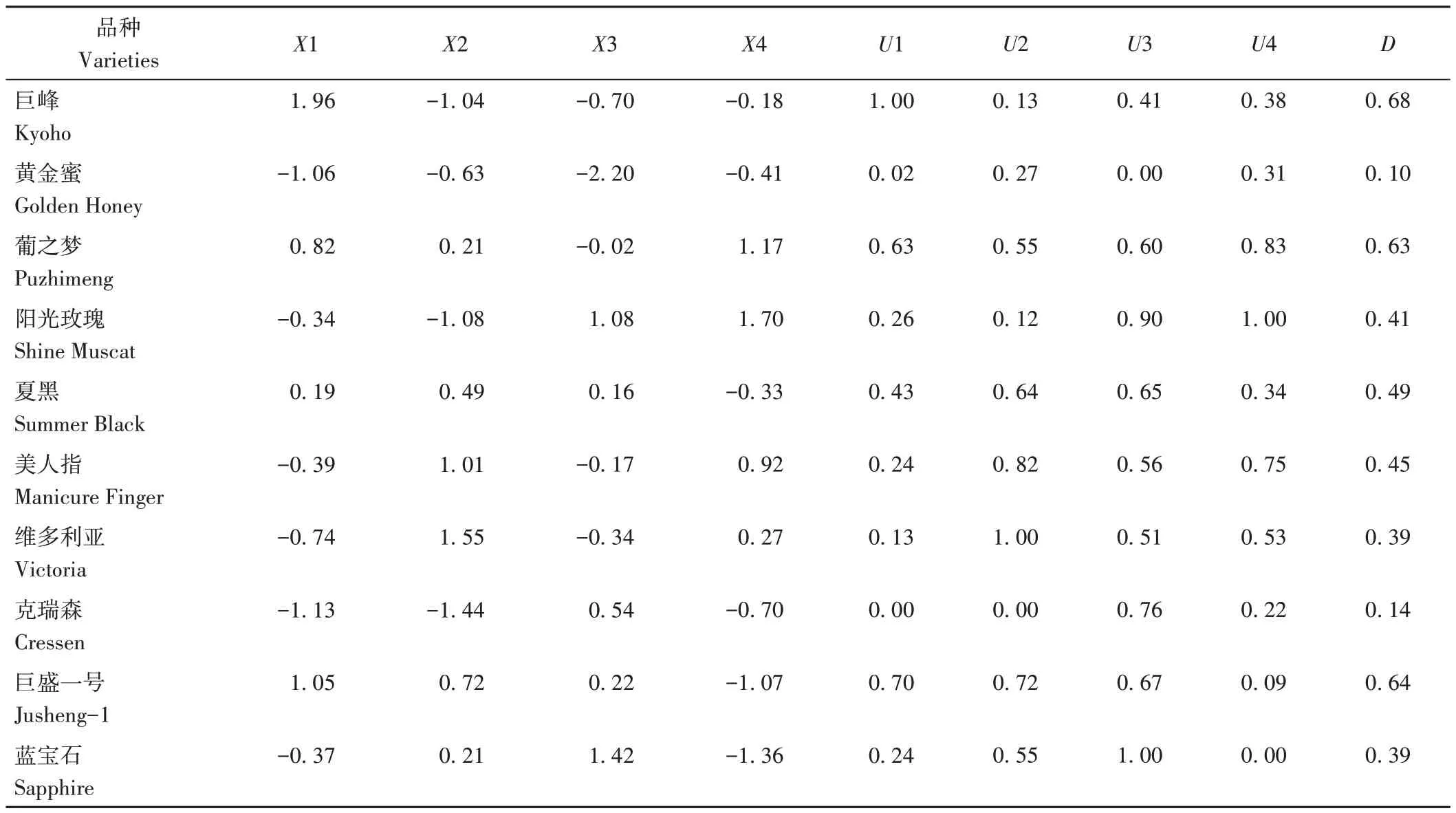
表8 不同葡萄品種的綜合系數、隸屬函數值、D值Table 8 Comprehensive index,membership funcition value,D value of different grape varieties
2.4 B.cinerea侵染對不同葡萄品種葉片相對電導率的影響
由以上隸屬函數分析可知,10個葡萄品種主要指標特征值均為葉片的性狀指標,因此測定B.cinerea侵染前后葡萄葉片中滲透調節物質含量的變化可為進一步反映B.cinerea對葡萄生理功能的影響。由圖1-A可知,B.cinerea未侵染葉片時,所有葡萄品種葉片相對電導率最高為0.78,最低為0.70,B.cinerea侵染葉片后,不同抗性品種的葉片相對電導率均出現了不同程度的增長,其中維多利亞葡萄葉片相對電導率增加了16.21%,差異達極顯著水平,陽光玫瑰、葡之夢、克瑞森差異達顯著水平,其他參試品種差異不顯著。B.cinerea侵染葡萄葉片,造成所有葡萄品種葉片中超氧陰離子產生速率程現不同程度的增加(圖1-B)。僅葡之夢、陽光玫瑰、克瑞森和藍寶石在灰葡萄孢侵染后表現出與對照組相比差異極顯著,其葉片中產生速率分別為30.43、34.47、34.48和33.82 nmol·min-1·g-1,而巨峰葡萄葉片中產生速率無顯著差異。同樣在B.cinerea侵染葡萄葉片后,所有葡萄品種葉片中丙二醛含量均增加,其中,陽光玫瑰和克瑞森葡萄葉片丙二醛含量分別增加了146.09%和172.45%,而巨峰、夏黑和維多利亞葡萄葉片丙二醛含量分別增加了22.28%、22.24%和30.02%,與對照組相比無顯著差異,其余參試品種與對照組相比,葉片丙二醛含量差異均達極顯著水平(圖1-C)。
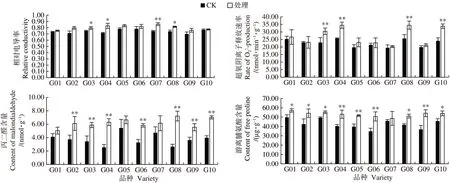
圖1 不同品種葡萄品種葉片電導率等含量測定Fig.1 Determination of electrical conductivity and other contents in grape leaves of different varieties
B.cinerea未侵染葡萄葉片時,巨峰葡萄葉片中游離脯氨酸含量為49.77 μg·g-1,在所有品種葉片中含量最高,且在B.cinerea侵染后,其含量增加至57.28 μg·g-1,同樣高于其他品種。除維多利亞葡萄葉片中游離脯氨酸含量侵染前后無顯著差異外,其他所有品種葉片均有顯著或極顯著性差異(圖1-D)。
2.5 外源MT 對巨峰和克瑞森葡萄B.cinerea 抗性的影響
為了探索B.cinerea感染后,巨峰和克瑞森葡萄果實多酚等氧化物質代謝的變化及外源MT 抵御B.cinerea侵染的作用,測定了葡萄總酚含量、總抗氧化能力、苯丙氨酸淀粉酶和多酚氧化酶活性(表9)。結果表明,接種B.cinerea10 d 后,巨峰和克瑞森葡萄果實4 項指標分別降低了60.27%、47.20%、54.00%、62.43%和15.83%、51.24%、17.04%、48.94%,且指標水平在接種B.cinerea前后差異顯著。
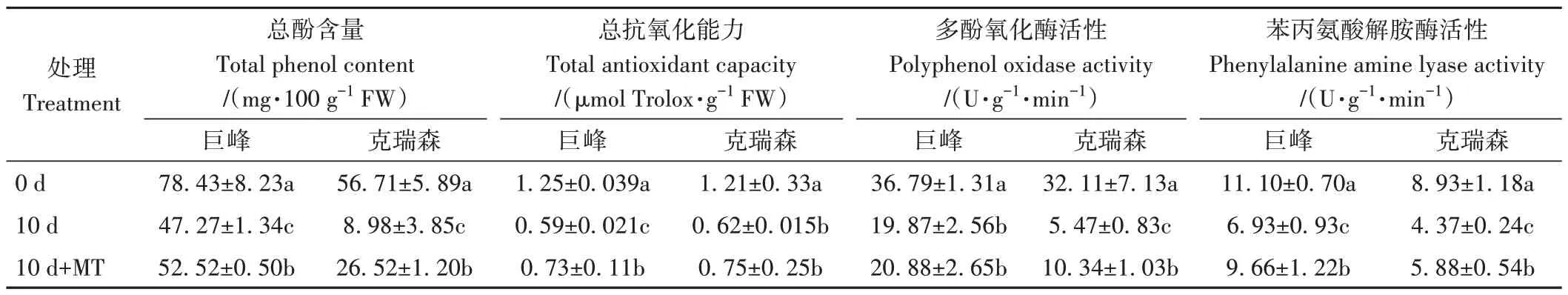
表9 葡萄果實總酚含量、總抗氧化能力、多酚氧化酶、苯丙氨酸解胺酶活性測定Table 9 Content of total phenols,total antioxidant capacity,phenylalanine amylase and polyphenol oxidase activity in grapes
與B.cinerea侵染10 d 的果實相比,外源MT 總體上提高了B.cinerea侵染10天后果實的總抗氧化能力、苯丙氨酸淀粉酶和多酚氧化酶活性。與對照相比,MT緩解了B.cinerea對果實的傷害,巨峰葡萄果實總酚、總抗氧化能力、苯丙氨酸淀粉酶活性分別增加了11.11%、23.73%和39.39%,呈顯著差異,克瑞森果實經MT 處理后,總酚、多酚氧化酶、苯丙氨酸淀粉酶活性分別增加了195.32%、89.03%和34.55%(表9)。
2.6 外源MT對B.cinerea侵染后葡萄果實VvCu/Zn-SOD1a等基因表達量的影響
為進一步探究外源MT 對受B.cinerea侵染果實活性氧清除相關基因表達水平的影響,通過qRT-PCR技術并分別檢測了B.cinerea處理0 d、10 d 及MT+B.cinerea處理10 d 后果實VvCu/Zn-SOD1a等基因的表達水平。
巨峰和克瑞森葡萄在受B.cinerea侵染10 d后,果實VvCu/Zn-SOD1a等基因表達量均顯著或極顯著降低,而在外源MT+B.cinerea處理后,所有基因表達水平又有所升高(圖2)。其中B.cinerea處理10 d后,巨峰和克瑞森葡萄果實中VvCu/Zn-SOD1a基因表達量下降幅度最大,分別降低96.86%和97.02%;B.cinerea浸染的巨峰和克瑞森葡萄果實經外源MT 處理后,VvCu/Zn-SOD1a基因表達量顯著上調,分別升高了378.85%和1 383.60%,與B.cinerea處理差異顯著。B.cinerea處理10 d后,兩個葡萄果實中VvPPO和VvPAL1的表達量分別降低81.75%、68.45%和83.28%、94.58%,MT+B.cinerea處理下VvPAL1基因表達量較前處理差異顯著,分別升高134.83%和82.22%。葡萄花青素合成通路中關鍵酶合成基因VvCHS3基因表達量下降幅度最小,在兩個葡萄品種中分別降低26.59%和59.18%,添加MT 后其表達量又分別升高12.65%和46.39%,除巨峰果實中VvCHS3 和VvPPO在B.cinerea浸染下后經MT處理的表達量差異不顯著外,其他均差異顯著或極顯著。
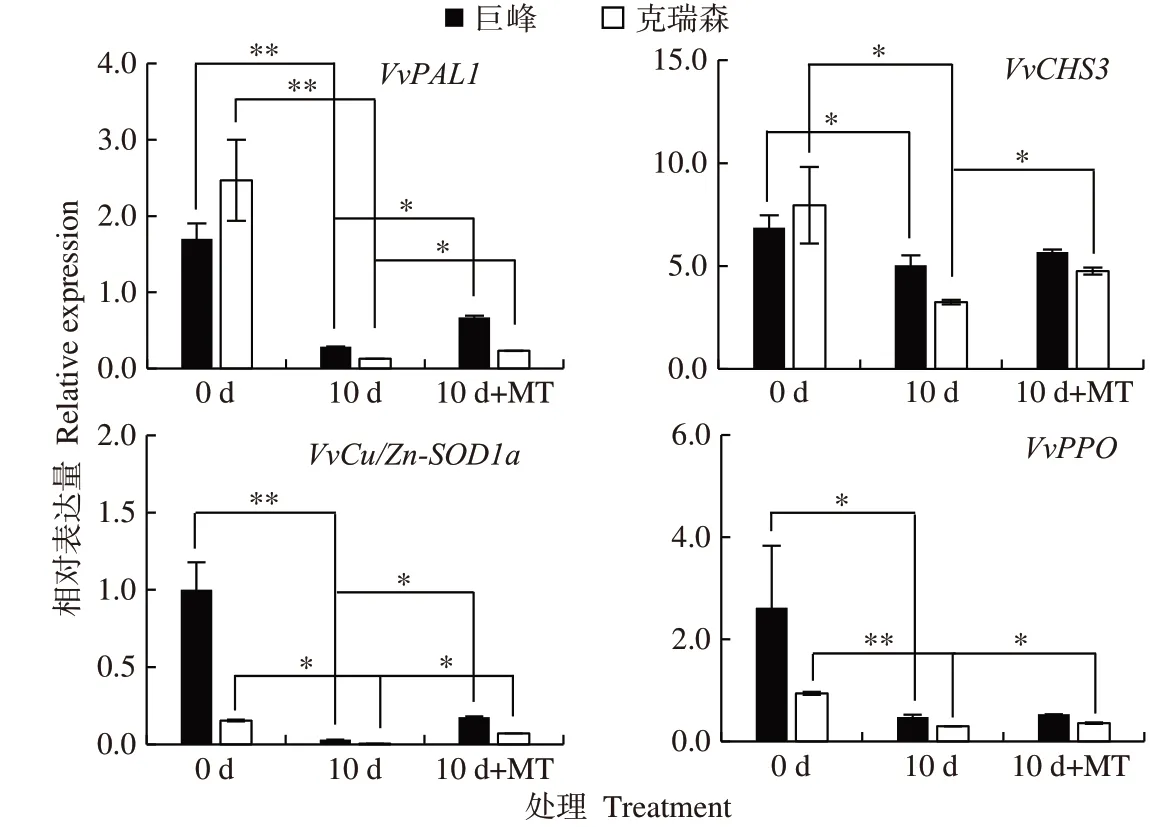
圖2 外源MT對B.cinerea感染10 d后巨峰和克瑞森葡萄活性氧清除相關基因表達水平的影響Fig.2 Effect of exogenous MT on the expression of active oxygen removing related genes in Kyoho and Crimson grape which infected with B.cinerea for 10 days
3 討論
3.1 葡萄種間灰霉病抗性差異
葡萄灰霉病抗性多受遺傳因素影響,屬多基因控制的數量性狀,群體間差異顯著。本研究發現,部分新疆主栽品種灰霉病抗性差異顯著,結合隸屬函數進行多表型綜合評價發現,歐美種葡萄抗性強于歐亞種,并以巨峰葡萄抗性最強,黃金蜜葡萄抗性最弱。田園園[23]結合病原菌侵染前后葉片、果實灰霉病抗性鑒定及防御酶活性、信號分子含量變化趨勢,分別對23 份葡萄品種(優系)進行了灰霉病抗性評價,其中以歐美種的巨峰優系葡萄抗性最強,感病品種以克瑞森、紅地球葡萄等歐亞種居多;任志華[24]通過葉片接種表型鑒定和顯微結構觀察,對31 個葡萄品種以及雜交后代群體進行了灰霉病抗性鑒定,發現歐美種葡萄對灰霉病抗性表現抗病,而歐亞種葡萄普遍表現感病,與本研究觀點基本一致。Hou等[25]研究發現葡萄品種雙優對葡萄灰霉病的抗性較高,而紅地球葡萄對葡萄灰霉病的抗性較低,提出不同葡萄品種對灰霉病菌感染的抵抗力受不同的基因型影響。
3.2 灰霉病誘導植物細胞膜透性升高,滲透調節物質積累
細胞膜透性是反映細胞膜損傷的主要指標之一[26],而植株電導率在一定程度上反映了植物細胞膜透性受逆境傷害的程度[27],可作為葡萄品種抗灰霉病特性的重要指標之一。本研究中葡之夢、陽光玫瑰、克瑞森和維多利亞經過灰霉病菌處理之后,植物葉片電導率出現顯著或極顯著變化,細胞膜透性顯著提高,而巨峰、夏黑、巨盛一號在處理前后膜透性變化不顯著,由此說明葡萄品種抗病性越弱,植物電導率變化越顯著。丙二醛(MDA)是植物細胞膜脂過氧化的重要產物,逆境脅迫導致植物活性氧水平升高,引起膜脂過氧化,造成MDA 積累,MDA 水平可直接反映逆境傷害的程度[28]。本研究發現,經過病菌接種試驗,所有葡萄品種葉片中MDA 含量全部增加,其中陽光玫瑰和克瑞森等葡萄葉片MDA 含量顯著增加,而巨峰、夏黑、維多利亞等抗病葡萄葉片MDA 含量與對照組相比無顯著差異。這可能是病害脅迫下細胞膜破壞產生,從而導致葉片MDA 積累所致。B.cinerea侵染導致植物葉片組織內活性氧水平升高,其產生速率受病害脅迫程度和時間的影響。以上3 個指標均與抗性程負相關性,而在逆境條件下,植物體內滲透調節物質游離脯氨酸含量顯著增加,抗性強的品種往往積累較多的脯氨酸。由圖1 可知,B.cinerea侵染后,大部分葡萄品種葉片MDA 和游離脯氨酸含量顯著或極顯著上調,而相對電導率及產生速率僅在個別葡萄品種葉片中出現差異。Govrin 等[29]指出,病害和許多其他脅迫都會導致活性氧生產,對植物葉片細胞膜產生傷害。這意味著B.cinerea在侵染感病葡萄如陽光玫瑰、克瑞森葉片時,極易破壞其細胞膜透性,造成離子失衡、MDA 迅速積累、產生速率升高,打破細胞內部氧化還原平衡狀態,加快細胞死亡,而抗病葡萄葉片如巨峰等則在細胞組織中積累較多的游離脯氨酸,可以很好地緩沖由B.cinerea侵染引起的細胞內外滲透壓不平衡。
3.3 MT通過調控活性氧平衡緩解B.cinerea對葡萄的危害
病原菌侵染后通過激活宿主細胞免疫抗性響應,誘導活性氧(ROS)大量積累,ROS 代謝失衡則對細胞膜系統造成嚴重損傷,MT的重要的特性是它的抗氧化活性,即通過清除細胞產生的多余自由基,增強抗氧化能力,從而提高植株的抗逆性[30-31]。本研究表明,MT可緩解B.cinerea對葡萄果實的脅迫:B.cinerea侵染后,葡萄果實總酚含量驟減,且抗氧化酶相關基因Cu/Zn-SOD1a、VvPPO等表達量也顯著或極顯著下調,而外源MT處理后,除巨峰葡萄VvCH3和VvPPO表達量無顯著差異,其他活性氧清除相關基因表達量均有不同程度上調(圖2),表明外源MT 可以降低生物脅迫下植物體內過氧化物含量的積累,緩解細胞膜脂過氧化。Mirshekari 等[21]也證實MT 處理可以調控超氧化物酶等抗氧化酶活性,進而降低ROS 的積累。上述研究均表明,MT可以提高葡萄植株內總酚含量、抗氧化酶,從而清除植物體內由生物脅迫產生的自由基,提高葡萄對灰霉病的抗性。
葡萄防御關鍵基因VvPAL1、VvPPO可通過誘導苯丙烷代謝相關酶的活性,促進類黃酮,酚類和木質素等抗真菌化合物的積累,提高果實病抗性水平。Xu等[32]研究表明,葡萄受病原菌TalaromycesrugulosusO1侵染后PPO 和PAL 活性上升,提高了對病原菌的抗性。盡管本研究發現B.cinerea侵染10 d 后,VvPAL1、VvPPO活性顯著降低、表達水平顯著或極顯著降低,經外源MT 處理后兩種防御酶活性有一定程度提高,增強了葡萄對病原菌的抗性。T.rugulosus與B.cinerea侵染前后,VvPPO 和VvPAL 活性變化趨勢存在差異,這可能與兩種病原菌致病機理和侵染時期有關。
4 結論
本研究明確了10 個新疆主栽葡萄品種的灰霉病抗性水平,揭示了MT 調控葡萄灰霉病抗性的生理基礎。部分葡萄品種灰霉病抗性差異顯著,其中以巨峰葡萄抗性最強,黃金蜜葡萄抗性最弱。B.cinerea誘導葡萄細胞膜透性升高,滲透調節物質積累。MT可通過抑制植物體內過氧化物含量的積累,緩解細胞膜脂過氧化,進而提高葡萄灰霉病抗性。

