木犀草素、歐當歸內酯A和黃芪皂苷Ⅰ單用及聯(lián)用對人肝星狀細胞株LX-2增殖、活化的影響*
陸倩, 張金娟, 蔣先慧, 國小利, 廖尚高,3***
(1.貴州醫(yī)科大學 藥學院, 貴州 貴陽 550025; 2.貴州醫(yī)科大學 基礎醫(yī)學院機能實驗室, 貴州 貴陽 550025; 3.貴州醫(yī)科大學 民族藥與中藥開發(fā)應用教育部工程研究中心/貴州省藥物制劑重點實驗室, 貴州 貴陽 550004)
肝纖維化(hepatic fibrosis,HF)是各種急慢性肝損傷引起的以炎癥反應和細胞外基質(extracellular matrix,ECM)在肝臟中過度累積為主要損傷修復特點的病理過程[1],是各種慢性肝病向肝硬化乃至肝癌發(fā)展的中間環(huán)節(jié)[2]。HF的逆轉可有效降低肝癌的發(fā)生率[3],但目前臨床尚無有效的抗HF藥物[4]。故尋找安全有效的HF治療方法及藥物成為臨床急需解決的重要問題。HF的發(fā)展是多基因、多步驟作用的過程,中藥可從多途徑、多靶點發(fā)揮作用,在抗HF方面有著獨特的優(yōu)勢[5-6]。與此同時,中醫(yī)中藥有著完備的理論體系和豐富的臨床經驗,故從中藥資源寶庫中尋找抗HF藥物不失為一種有效途徑。韋凌霞等[7]收集臨床治療HF的含當歸中藥復方,并對頻數>10的中藥進行系統(tǒng)聚類分析,發(fā)現(xiàn)丹參、當歸、黃芪累計頻次最高且聚為一類;此外,丹參、當歸和黃芪存在于多種治療HF的復方中,且占比較大,如扶肝化纖湯、復原化纖湯等[8]。課題組前期通過網絡藥理學對丹參、當歸和黃芪的抗HF成分及其作用機制進行分析,結果顯示木犀草素(luteolin, Lut)、歐當歸內酯A(levistilide a, Lev)及黃芪皂苷Ⅰ(astragaloside Ⅰ, Ast)分別為丹參、當歸和黃芪中的潛在核心抗HF活性成分;進一步對Lut、Lev及Ast的潛在抗HF靶點進行富集分析,發(fā)現(xiàn)3者既存在相同的抗HF靶點及通路,也存在不同的靶點及通路,并且均與促纖維化因子(transforming growth factor-β1,TGF-β1)相關;故而推測Lut、Lev及Ast 3個核心活性成分聯(lián)用可能會產生協(xié)同抗HF作用。LX-2細胞是永生化的人肝星狀細胞系,因其高轉染性和在無血清培養(yǎng)基中的高生存能力被廣泛用于體外HF的研究[9]。本研究擬考察Lut、Lev及Ast單用及聯(lián)用對LX-2細胞增殖、活化的影響,以期為Lut、Lev和Ast聯(lián)用治療HF提供實驗依據。
1 材料與方法
1.1 實驗材料
人肝星狀細胞株LX-2,(廣州吉尼歐有限公司),Lut、Lev和Ase(成都埃法),DMEM高糖培養(yǎng)基(美國Gibco),0.25%胰蛋白酶(武漢賽維爾),胎牛血清(加拿大維森特),二甲基亞砜(dimethyl sulfoxide,DMSO)、噻唑藍(methyl thiazolyl tetrazolium,MTT)試劑(北京索萊寶),α-smooth actin(α-SMA,南京巴傲得),TGF-β1(武漢愛博泰克),甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH;上海優(yōu)寧維)。
1.2 主要儀器
MS105DC型梅特勒-托利多十萬分之一天平(北京賽多利斯),2001HY-6003型CO2細胞培養(yǎng)箱(美國ThermoFisher Scientific),酶標儀(美國Bio-Tek),SW-CJ-2D型超凈工作臺(蘇州凈化設備),DYY-6C型電泳儀(北京六一),TS-8型轉移脫色搖床(海門其林貝爾)。
1.3 研究方法
1.3.1細胞培養(yǎng) LX-2細胞使用含有10%胎牛血清和1%雙抗(青霉素和鏈霉素)的DMEM高糖培養(yǎng)基(完全培養(yǎng)基)于37 ℃、5%CO2培養(yǎng)箱中培養(yǎng),待細胞融合至80%~90%時傳代培養(yǎng),取對數生長期細胞用于后續(xù)試驗。
1.3.2Lut、Lev及Ast對TGF-β1誘導LX-2細胞增殖的影響及聯(lián)用比例確定 取對數生長期的LX-2細胞,以3 500個/孔接種于96孔板中,細胞培養(yǎng)24 h,吸棄培養(yǎng)液,加入不含胎牛血清的DMEM饑餓12 h。之后將細胞分為Con組(完全培養(yǎng)基)、TGF-β1組(10.00 μg/L TGF-β1)、SB431542不同劑量組(10.00 μg/L的TGF-β1分別加6.25、12.50、25.00、50.00、100.00 μmol/L的SB431542)、Lut不同劑量組(10.00 μg/L TGF-β1分別加6.25、12.50、25.00、50.00、100.00 μmol/L的Lut)、Lev不同劑量組(10.00 μg/L TGF-β1分別加6.25、12.50、25.00、50.00、100.00 μmol/L的Lev)、Ast不同劑量組(10.00 μg/L TGF-β1分別加6.25、12.50、25.00、50.00、100.00 μmol/L的Ast),每組6個復孔。各組細胞按各自藥物和劑量加藥后培養(yǎng)48 h,吸棄培養(yǎng)液,加入5 g/L MTT溶液20 μL,繼續(xù)孵育4 h,棄盡孔中溶液,每孔加入 DMSO 100 μL,搖床振蕩10 min。以只加完全培養(yǎng)基的孔作為調零孔,在酶標儀上測定490 nm波長處的吸光度(optical density, OD)。計算細胞增殖抑制率:細胞增殖抑制率(%)=[(ODTGFβ1組-OD實驗組)/(ODTGFβ1組-OD調零孔)]×100%。使用Graph Pad Prism 8.0.1軟件計算IC50,以Lut、Lev和Ast的IC50比值作為聯(lián)用的比例。
1.3.3Lut、Lev及Ast聯(lián)用對TGF-β1誘導的LX-2細胞增殖的影響 按照“1.3.2”所述方法進行實驗,將細胞分為Con組(完全培養(yǎng)基)、TGF-β1組、SB431542組、聯(lián)用組為10.00 μg/L TGF-β1分別與Lut+Lev、Lut+Ast、Lev+Ast、Lut+Lev+Ast的組合(Lut∶Lev∶Ast=1∶1∶10,以Lut為基準,將濃度設為0.94、1.88、3.75、7.50、15.00、30.00、60.00 μmol/L)。按照“1.3.2”所述方法測定OD并計算細胞增殖抑制率。
1.3.4Lut、Lev及Ast聯(lián)用類型的分析 將Lut、Lev和Ast聯(lián)用比例、濃度及對應的細胞增殖抑制率輸入到CalcuSyn軟件中,計算CI值,以CI值分析Lut、Lev和Ast聯(lián)用類型,CI>1為拮抗作用,CI<1為協(xié)同作用,CI=1為加和作用。
1.3.5Western blot檢測TGF-β1誘導的LX-2細胞中α-SMA蛋白的表達 取對數生長期的LX-2細胞,以2×105個/孔接種于6孔板中。細胞培養(yǎng)24 h,吸棄培養(yǎng)液,加入不含胎牛血清的DMEM饑餓12 h。之后將細胞分為Con組(完全培養(yǎng)基)、TGF-β1組(10.00 μg/L TGF-β1)、SB431542組(10.00 μg/L TGF-β1加15.00 μmol/L的SB431542)、Lut組(10.00 μg/L TGF-β1加15.00 μmol/L的Lut)、Lev組(10.00 μg/L TGF-β1加15.00 μmol/L的Lev)、Ast組(10.00 μg/L TGF-β1與150.00 μmol/L的Ast)、聯(lián)用組(10.00 μg/L TGF-β1分別與Lut+Lev、Lut+Ast、Lev+Ast、Lut+Lev+Ast組合)。各組細胞按各自藥物和劑量加藥后培養(yǎng)48 h,經細胞蛋白裂解液裂解,BCA蛋白濃度測定試劑盒定量。SDS-PAGE凝膠進行電泳,常規(guī)方法進行轉膜、封閉后,一抗4 ℃孵育過夜。TBST洗膜(10.00 min/次、×3次),加入辣根過氧化物酶標記的羊抗兔IgG(二抗)室溫孵育2 h,洗膜。用ECL發(fā)光試劑盒顯影,采用Image J軟件分析。以GAPDH灰度值進行校正,計算α-SMA蛋白的相對表達量。
1.3.6Western blot檢測LX-2細胞中TGF-β1蛋白的表達 取對數生長期的LX-2細胞,以2×105個/孔接種于6孔板中。細胞培養(yǎng)24 h后,分為Con組(完全培養(yǎng)基)、SB431542組(30.00 μmol/L)、Lut組(30.00 μmol/L)、Lev組(30.00 μmol/L)、Ast組(300.00 μmol/L)、聯(lián)用組為(Lut+Lev、Lut+Ast、Lev+Ast、Lut+Lev+Ast組合)。按照“1.3.5”所述方法進行實驗,計算TGF-β1蛋白的相對表達量。
1.4 統(tǒng)計學方法
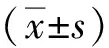
2 結果
2.1 Lut、Lev及Ast對TGF-β1誘導LX-2細胞增殖的影響及聯(lián)用比例確定
與Con組比較,TGF-β1組細胞增殖明顯(P<0.01);與TGF-β1組比較,各給藥組對細胞增殖具有顯著的抑制作用(P<0.01);且抑制率都隨濃度的增加而升高,具有濃度依賴性。Lut、Lev及Ast的IC50分別為38.60、34.40及303.80 μmol/L,確定Lut、Lev及Ast聯(lián)用摩爾比為1∶1∶10。不同劑量藥物組細胞存活率見圖1。

注:A~D分別為不同濃度SB431542、Lut、Lev及Ast組LX-2細胞存活率;(1)與Con組比較,P<0.01;(2)與TGF-β1組比較,P<0.01。
2.2 Lut、Lev及Ast聯(lián)用對TGF-β1誘導的LX-2細胞增殖的影響
各藥物聯(lián)用組細胞增殖抑制率如圖2所示。Lut+Lev+Ast組在0.94~60.00 μmol/L范圍內細胞增殖抑制率高于Lut+Lev、Lut+Ast和Lev+Ast組;Lut+Lev組在0.94~15.00 μmol/L范圍內細胞增殖抑制率低于Lut+Ast組,在15.00~60.00 μmol/L范圍內細胞增殖抑制率高于Lut+Ast組;Lev+Ast組在0.94~60.00 μmol/L范圍內細胞增殖抑制率高于Lut+Lev和Lut+Ast組。

圖2 Lut、Lev和Ast聯(lián)用對TGF-β1誘導的LX-2細胞增殖的影響Fig.2 Effect of Lut, Lev and Ast on the proliferation of TGF-β1-induced LX-2 cells
2.3 Lut、Lev和Ast聯(lián)用類型的分析
結果顯示,Lev+Ast組在細胞增殖抑制率>40%時的CI<1,Lut+Ast、Lut+Lev組在不同細胞增殖抑制率下CI≥1,3者聯(lián)用組在細胞增殖抑制率>15%時CI<1,表明Lut、Lev和Ast聯(lián)用在細胞增殖抑制率>15%時具有協(xié)同增效作用;初步確定3者聯(lián)合使用對TGF-β1誘導的LX-2細胞的增殖具有協(xié)同抑制作用。Lut、Lev和Ast聯(lián)用的CI見圖3。

注:Fa為細胞增殖抑制率,CI為聯(lián)合指數。
2.4 α-SMA蛋白表達
各組細胞中α-SMA蛋白表達結果如圖4所示,與Con組比較,TGF-β1組α-SMA蛋白表達顯著升高(P<0.01);與TGF-β1組相比,各給藥組的α-SMA蛋白表達顯著降低(P<0.01);其中3者聯(lián)用組的α-SMA蛋白表達較其他組均降低更顯著(P<0.05),提示Lut、Lev及Ast聯(lián)用可抑制LX-2細胞的活化。

注:A 為Lut、Lev、Ast單用及聯(lián)用時TGF-β1誘導的LX-2細胞中α-SMA蛋白條帶圖,B為相對表達量;(1)與Con組比較,P<0.01;與TGF-β1組比較,(2)P<0.05,(3)P<0.01。
2.5 TGF-β1蛋白表達
各組細胞中TGF-β1蛋白表達結果如圖5所示,與Con組比較,各給藥組TGF-β1蛋白表達均降低(P<0.05),3者聯(lián)用組細胞中TGF-β1蛋白表達較其他給藥組降低更顯著(P<0.01);提示Lut、Lev和Ast聯(lián)用對LX-2細胞增殖、活化的協(xié)同抑制作用可能與下調TGF-β1蛋白表達有關。

注:A 為Lut、Lev、Ast單用及聯(lián)用時LX-2細胞中TGF-β1蛋白條帶圖,B為相對表達量;與Con組比較(1)P<0.01,(2)P<0.05。
3 討論
肝組織ECM的異常沉積會導致肝正常的結構和功能被破壞,是HF病理過程中的特征性改變[10-11]。在生理情況下,ECM的合成與降解是一個動態(tài)平衡過程,由肝細胞、內皮細胞、肝星狀細胞等多種細胞調控,其中肝星狀細胞被認為是ECM的主要來源[12]。正常肝組織中的肝星狀細胞處于靜息狀態(tài),是儲存維生素A和類視黃醇的主要細胞;當肝臟受損時,靜息的肝星狀細胞被激活,迅速增殖產生大量ECM,打破原有的合成與降解平衡,從而引起肝組織結構重建進而促進HF的發(fā)生[13]。TGF-β1是迄今為止作用最強的促纖維化細胞因子之一,在纖維化進程中發(fā)揮關鍵作用[14];體外實驗常用TGF-β1誘導LX-2細胞使其活化,建立HF細胞模型從而開展實驗研究[15-16]。本實驗通過MTT法考察了Lut、Lev和Ast單用及聯(lián)用對TGF-β1誘導的LX-2細胞增殖的影響。結果顯示,3者單用及聯(lián)用均能抑制TGF-β1誘導的LX-2細胞的增殖,且聯(lián)用作用更為突出,并呈濃度依賴。
目前,用于評估藥物聯(lián)用類型的方法主要有Chou-Talalay組合指數法、等效線圖分析和曲線位移分析等[17];其中Chou-Talalay組合指數法是根據中效方程計算單用及聯(lián)合用藥在各種抑制率時的中效濃度,能夠在給定的抑制率水平下對藥物聯(lián)用影響療效的合理性提供量化指標[18],該方法應用最為廣泛。為了消除計算過程中的主觀評價和實現(xiàn)數據自動分析,該方法被整合到軟件程序(CalcuSyn)中,現(xiàn)在廣泛用于生物醫(yī)學科學的研究;CalcuSyn軟件通常建議以IC50或半數有效量(half maximal effective dose, ED50)為恒定比例進行聯(lián)合用藥[19]。為了探討Lut、Lev和Ast聯(lián)用是否具有協(xié)同作用,本研究采用CalcuSyn軟件進行分析,通過Graph Pad Prism8.0.1軟件計算IC50,以IC50作為藥物聯(lián)合的恒定比例進行試驗。結果顯示,3者聯(lián)用在細胞增殖抑制率大于15%時CI<1,證實Lut、Lev和Ast聯(lián)用對TGF-β1誘導的LX-2細胞的增殖具有協(xié)同增效的抑制作用。α-SMA在肝星狀細胞被激活時表達上調,被認為是肝星狀細胞激活的標志,其表達水平與肝臟的纖維化程度呈正相關[20-21]。本實驗研究顯示,Lut、Lev和Ast聯(lián)用能夠顯著下調TGF-β1誘導的LX-2細胞中α-SMA 蛋白的表達,提示3者聯(lián)用能抑制肝星狀細胞的激活。TGF-β1/Smad信號通路是介導肝星狀細胞激活、促進肝星狀細胞增殖和產生ECM的主要信號通路,在HF的進程中發(fā)揮著較為關鍵的作用,阻斷TGF-β1/Smad信號通路,對HF的治療有重要意義[22]。本研究結果顯示,Lut、Lev和Ast聯(lián)用能夠顯著下調LX-2細胞中TGF-β1蛋白的表達,提示3者聯(lián)用抑制LX-2細胞增殖、活化的協(xié)同增效的作用可能與下調肝星狀細胞TGF-β1蛋白表達有關。
綜上所述,Lut、Lev和Ast單用及聯(lián)用均能抑制TGF-β1誘導的LX-2細胞的增殖、活化,其中3者聯(lián)用抑制作用最強,且具有協(xié)同增效的作用,這種抑制作用可能與下調肝星狀細胞TGF-β1蛋白表達有關。本研究為Lut、Lev和Ast聯(lián)用治療HF提供了實驗依據。

