國槐枝枯病病原菌鑒定及其生物學特性
羅芷涵,劉朋飛,于 軍, 齊 鶴, 陳小光,樓兵干,*
(1.浙江大學 生物技術研究所,農業農村部作物病蟲分子生物學重點實驗室,浙江 杭州 310058; 2.塔里木大學 植物科學學院,新疆 阿拉爾 843399; 3.巴音郭楞蒙古自治州林業和草原局,新疆 庫爾勒 841000; 4.庫爾勒市園林局,新疆 庫爾勒 841000)
國槐[Styphnolobiumjaponicum(L.) Schott]是蝶形花科(Fabaceae)的一種落葉喬木,是常用的園林綠化樹種,也是經濟林兼用樹種。該樹原產于我國北方,現今在我國大部分地區均有分布,是北京、石家莊、大同、西安、蘭州等城市的市樹[1],也是新疆,尤其是南疆,如庫爾勒、焉耆、博湖、阿克蘇、阿拉爾等地的主要綠化樹種。
近年來,在新疆的庫爾勒市、阿克蘇市、阿拉爾市等多地的綠化、行道國槐上發生一種新病害——國槐枝枯病,其株發病率高達50%~70%。由于病樹多、病情嚴重,大量國槐樹出現枝條枯死,甚至全株枯死的現象,當地相當數量的國槐已無法發揮行道遮蔽、水土保持、防沙固沙等多方面的作用,該病害已嚴重影響到南疆的城市綠化。因此,明確造成國槐枝枯病的病因、找到防控措施迫在眉睫。查詢國內外相關文獻,未見任何類似病害的描述與報道。為了明確引起南疆國槐枝枯病的病原菌,更好地指導病害的防控工作,本文著重就新疆地區國槐枝枯病的癥狀、病原鑒定及病原菌的生物學特性進行研究。
1 材料與方法
1.1 樣本采集
2019—2022年連續在庫爾勒、阿克蘇、阿拉爾等地采集具有發黃枯死等癥狀的國槐枝條,裝入干凈樣本袋中,帶回實驗室進行病原菌分離。
1.2 培養基
馬鈴薯葡萄糖瓊脂培養基(PDA培養基):去皮馬鈴薯200 g,葡萄糖20 g,瓊脂20 g,蒸餾水1 L。改良營養瓊脂培養基(NA培養基):蛋白胨10 g,蔗糖30 g,NaCl 5 g,瓊脂15 g,蒸餾水1 L。甘薯葡萄糖瓊脂培養基(SPDA培養基):甘薯200 g,葡萄糖20 g,瓊脂15 g,蒸餾水 1 L。玉米粒瓊脂培養基(CMA培養基):玉米粒60 g,葡萄糖20 g,瓊脂15 g,蒸餾水1 L。固體查氏培養基(Czapek培養基):MgSO4·7H2O 0.5 g,KH2PO41 g,KCl 0.5 g,NaNO32 g,FeSO4·7H2O 0.01 g,蔗糖25 g,瓊脂 20 g,蒸餾水 1 L。燕麥片瓊脂培養基(OA培養基):燕麥片 30 g,瓊脂 15 g,蒸餾水1 L。水瓊脂培養基(WA培養基):瓊脂粉15 g,蒸餾水1 L。基本培養基(CM培養基):NaNO36 g,KCl 0.52 g,MgSO4·7H2O 0.52 g,KH2PO41.52 g,葡萄糖 10 g,蛋白胨2 g,酵母提取物1 g,酪蛋白氨基酸1 g,1 000×微量元素 1 mL,1 000×維生素1 mL,蒸餾水 1 L,具體配制方法參考《植病研究方法》[2]。
1.3 國槐枝枯病的病害調查
從2019年到2022年,在每年的春季、夏季、秋季對庫爾勒市、博湖縣、焉耆縣和阿克蘇市、阿拉爾市的國槐枝枯病的危害癥狀、株發病率進行觀察與調查,拍照記錄病害癥狀,并計算株發病率。
1.4 病原菌的分離與純化
采用組織分離法,用滅菌解剖刀剪取具有典型癥狀的國槐枝條病健交界處,使用75%乙醇消毒30 s、1%次氯酸鈉消毒5 min后用無菌水沖洗晾干,用無菌刀片切成5 mm×5 mm的小塊,在每個PDA平板上均勻放置3塊,置于28 ℃恒溫生化培養箱中培養,待長出菌落后,挑取菌落邊緣進行多次純化,直到菌落形態完全一致。純化的菌落轉入PDA培養基斜面上,4 ℃保存。采用真菌單孢分離法,采集肉眼可見黑色分生孢子的病枝條,按上述方法沖洗晾干后,用無菌水將枝條上的分生孢子沖洗到滅菌三角瓶中,不斷稀釋孢子懸浮液直至濃度為每10 μL一個孢子。將懸浮液均勻涂布在PDA培養基上進行培養,待生長出單一菌落后,挑取菌落進行多次純化,并保存。
1.5 病原菌致病性測定
通過上述方法分離得到GH01、GH02、GH03、GH04、GH05、GH06、GH07、GH08、 GH09、 GH10、 GH11、 GH12、 GH13、 GH14、 GH15和 GH16等16株菌,選擇代表性菌株GH01進行致病性測定。將菌株GH01在PDA培養基上培養3 d,用打孔器(直徑5 mm)在菌落邊緣打出菌餅,用滅菌手術刀在國槐當年生嫩枝上劃一小傷口,將菌絲面朝內貼到傷口處,用保鮮膜固定,接無菌PDA培養基做空白對照,定時觀察記錄拍照,等出現癥狀時,再進行病原菌分離純化。將菌株GH01在PDA培養基上培養7 d,用無菌水將分生孢子稀釋成1×109mL-1,用滅菌接種針在國槐當年生嫩枝上進行噴霧接種,同時噴霧無菌水作空白對照。定時觀察記錄拍照,等出現癥狀時,再進行病原菌分離純化。
1.6 病原菌形態學觀察
將分離純化的16株菌分別接于PDA平板上,置于28 ℃、12 h光暗交替培養。在培養2 d和7 d時,觀察記錄菌絲形態、顏色,通過光學顯微鏡觀察并記錄菌絲及分生孢子的形態和大小,參考Alizadeh等[3]與Pavlic等[4]的研究對分生孢子的各種形態進行觀察與描述。
1.7 rDNA ITS序列與2個看家基因的多重序列系統發育分析
采用基因組DNA快速抽提法[5]提取16株菌的基因組DNA,并于-20 ℃保存備用。對rDNA ITS序列和 2個看家基因(EF1-α、LSU)進行PCR擴增,擴增引物見表1。PCR擴增體系為: 10×PCR緩沖液(含Mg2+)5 μL,10 mmol·L-1dNTP 1 μL,10 μmol·L-1正反引物各1 μL,病原基因組DNA 2 μL,5 U·mL-1Taq酶0.5 μL,加ddH2O至總體積50 μL。PCR反應程序為:95 ℃ 預變性2 min:94 ℃變性30 s,按不同擴增序列設置不同退火程序(rDNAITS,55 ℃退火50 s;EF1-α,56 ℃退火50 s;LSU,55 ℃退火1 min),72 ℃延伸1 min, 35個循環; 72 ℃再延伸10 min,4 ℃保存。用1%瓊脂糖凝膠電泳檢測PCR產物,將產物送杭州擎科生物股份有限公司測序。序列經BLAST比對分析后,提交至GenBank獲得登錄號。應用MEGA 11.0軟件,采取鄰接法利用16個供試菌株與10個參考菌株(表2)[3,6-13]各序列的串聯基因構建系統發育樹,Bootstrap重復檢驗1 000次。

表1 擴增引物序列Table 1 Primers for amplification of gene fragments

表2 系統進化分析中使用的菌株及其GenBank登錄號Table 2 Botryosphaeriaceae isolates used in the phylogenetic analyses with its GenBank accession number
1.8 病原菌的生物學特性研究
選取代表性菌株GH01進行生物學特性的測定。將菌株GH01在PDA培養基上于28 ℃、12 h光暗交替條件培養2 d后,以無菌打孔器打取菌落周圍直徑5 mm的菌餅用于以下實驗。
(1)培養基種類對病原菌生長、產孢的影響:將菌餅分別置于不同的培養基上,于28 ℃、12 h光暗交替的培養箱中培養24 h,之后采用十字交叉法量取其直徑并計算生長速率,觀察并記錄菌落生長的狀況與形態,7 d后無菌水洗下平板表面產生的孢子并利用擦鏡紙過濾,使用血球計數板鏡檢統計產孢數量。每個處理重復3次。(2)溫度對病原菌菌落生長、產孢的影響:將新鮮菌餅置于PDA平板中間,分別置于5 、10、15、20、25、30、35、40 ℃的恒溫培養箱中培養。同上方法測量菌落大小及產孢數量。每個處理重復3次。(3)濕度對病原菌分生孢子萌發的影響。采用小容器空氣濕度法[2],設置10%、35%、50%、75%和90%共5種相對濕度。用滅菌涂布棒蘸取 106mL-1的分生孢子液,均勻涂抹在含有水瓊脂培養基的滅菌載玻片上,快速風干后,放置于不同濕度的干燥器中,25 ℃恒溫培養6 h后鏡檢觀察孢子萌發狀況,并統計孢子萌發率。每個處理重復3次。(4)pH對病原菌生長、產孢的影響:用0.5 mmol·L-1的氫氧化鈉溶液與稀鹽酸對PDA培養基的pH值進行調整,分別配置pH值為3.5、4、5、6、7、8、9、10、11的PDA培養基。將直徑為5 mm的菌餅置于具有不同pH值的培養基上,28 ℃ 光暗交替條件下培養,定期觀察菌落形態;7 d后在血球計數板上鏡檢產孢數量。同時,配制上述pH值的PDB培養基,將直徑5 mm菌餅置于其中,25 ℃、150 r·min-1振蕩培養。3 d后過濾菌液, 菌絲用蒸餾水沖洗數次, 60 ℃ 烘干稱重。每個處理重復3次。(5)病原菌生長及產孢對碳、氮源的利用:以固體查氏培養基為基礎,以等質量的阿拉伯糖、可溶性淀粉、果糖、麥芽糖、甘露糖、木糖、山梨糖、葡萄糖、蔗糖、乳糖、甘油、半乳糖等碳源代替配方中的蔗糖,制備不同碳源的培養基;以含氮量相同的牛肉膏、硫酸銨、精氨酸、硝酸鉀、蛋白胨、草酸銨、苯丙氨酸、硝酸銨、氯化銨、甘氨酸、尿素等氮源,代替配方中的硝酸鈉配制不同氮源培養基。以不加任何碳或氮源的培養基為對照,將菌株GH01菌餅接入各培養基中,同上方法測量菌落大小及產孢數量。同時,配制上述配方的液體培養基,分別將菌餅置于其中,25 ℃, 150 r·min-1振蕩培養3 d;培養結束后過濾菌液, 菌絲用蒸餾水沖洗數次, 60 ℃烘干稱重。每個處理各重復3次。
2 結果與分析
2.1 國槐枝枯病的癥狀與危害
國槐枝枯病自2018年于庫爾勒地區發現。本研究團隊從2019年到2022年,在每年的春季、夏季和秋季,對南疆各地的國槐進行病害調查。發現除庫爾勒地區外,博湖縣、焉耆縣和阿克蘇市、阿拉爾市等地的國槐也同樣出現了枝枯、葉落甚至整樹枯死的行道國槐。我們對此進行了調查,并對枝枯病癥狀進行了詳細的觀察,發現國槐枝枯病發生普遍,株發病率為50%~70%,危害嚴重。
該病害最易且最初侵染的是國槐的春梢嫩枝。初期,發病部位會呈現水漬狀(圖1-A),此后病斑逐漸擴展(圖1-B),發病后枝條表皮會由綠色變為黑褐色至灰白色,并形成清晰的病組織與健康組織分界,褪綠部分表面出現明顯的黑色點狀物質(即病原菌的分生孢子器)(圖1-C);此外,病原菌也侵染二年生、多年生的枝條,大枝上表現出病斑,表皮皺縮凹陷,呈現灰白色,病健交界表現為暗紅至黑色。隨著病情的發展,被侵染枝條將逐漸干枯,枝條上的葉變黃直至落葉(圖1-D);在病程后期,大枝表面出現肉眼可見黑色小突起,同時表皮下能夠發現大量黑色分生孢子(圖1-E、F)。國槐枝枯病在國槐整個生長季都能發生,輕則造成病株花序、果實和小枝條枯死,重則導致病株大枝枯死繼而整樹枯死(圖1-G、H)。病原菌在早春侵染,會導致不開花、不結莢,嫩梢枯死;夏季侵染則豆莢空癟,無法形成具有生活力的種子。國槐枝枯病的發生對治沙防沙及園林綠化造成嚴重影響。

A~C,春梢嫩枝發病癥狀;D,發病枝條枝枯、葉落;E,多年生枝條樹皮表面的黑色突起;F,樹皮下形成的大量分生孢子;G,多樹枝條發病干枯;H,全株即將枯死。A-C,Symptoms on current-year twigs ; D, Branches dieback, leaves falling off; E, Visible black protrusions on epidermis surface ; F, Black conidia formed under the epidermis; G, Most of the shoots are diseased and dry; H, Trees about to die completely.圖1 國槐枝枯病的癥狀Fig.1 Infection symptoms of branch dieback on S. japonicum
2.2 病原菌的分離及致病性測定
對采集的國槐發病枝條通過組織和單胞分離,共得到16株形態學及分子生物學特征一致的菌株,通過組織分離獲得GH01、GH02和GH03等3株菌,通過單孢分離獲得GH04、GH05、GH06、GH07、GH08、 GH09、 GH10、 GH11、 GH12、 GH13、 GH14、 GH15和GH16等13株菌。選擇代表性菌株GH01進行菌絲塊接種,接種后4 d即可見接種的嫩枝傷口周圍出現水浸狀(圖2),傷口變黑且病斑沿枝條向兩端延伸;接種一個月后,出現與自然發病一樣的癥狀。從接種的發病枝條處分離到與接種菌株相同形態學和分子生物學特征的真菌,明確該菌株為造成國槐枝枯病的病原菌。采用菌株GH01的孢子液接種7 d后,接種部位枝條出現水漬狀斑點,而后病斑逐漸擴大,呈橢圓形,病斑邊緣黑色,中央枯黃。

A,噴分生孢子液;B,噴無菌水對照;C,菌絲塊傷口接種;D,空白PDA培養基對照。A, Sprayed conidial; B, Sprayed sterile water; C, Mycelial inoculation; D, PDA medium control.圖2 分生孢子與菌絲塊在國槐嫩枝上的接種結果Fig.2 Results of pathogenicity test of conidia and mycelial plugs on S. japonicum branch
2.3 國槐枝枯病原菌鑒定
2.3.1 病原菌形態學特征
將分離得到的16株菌分別置于PDA平板上培養,各菌株形態學特征一致。菌株生長速度快,2 d即可長滿90 mm的平板。菌落初期呈白色,氣生菌絲發達,呈細絨毛狀且部分直立(圖3-A);培養3 d后,菌落逐漸變黑,7 d后菌落呈現出正面墨綠色、背面黑色的形態(圖3-B)。在光學顯微鏡下觀察,病原菌會產生鏈狀節孢子(arthroconidia),隨后節孢子變圓,呈現暗褐色,無隔膜或僅有一個隔膜。不成熟的節孢子會斷裂形成短鏈(圖3-D)。在平板培養過程中,未見其分生孢子器。在發病后期的枝條上分離得到了大量分生孢子,它們形態多樣,包括無隔孢子[(2.0~5.0) μm×(1.5~4.5) μm]、單隔孢子[(6.5~9.3) μm×(5.0~5.5) μm]、多隔孢子[(9.0~10.6 )μm×(3.5~5.5 )μm]及格磚狀孢子[(12.0~16.0 )μm×(11.4~16.0) μm]。從分布數量上看,多數孢子為無隔孢子,其次為單隔孢子,多隔孢子及格磚狀孢子數量較少。以上形態學特征,與Alizadeh[2]和Pavlic等[3]對Neoscytalidiumnovaehollandiae(現名N.dimidiatum)的形態特征相符合。

A,PDA培養基培養2 d;B,PDA培養基培養7 d;C,菌絲;D,節孢子;E~F,無隔孢子與單隔孢子;G,雙隔孢子;H,格磚狀孢子。A, Cultured with PDA medium for 2 d; B, Cultured with PDA medium for 7 d; C, Mycelium; D, Arthrospore; E-F, Septospore and single septospore ;G, Double septospore; H, Lattice spore.圖3 病原菌的形態學特征Fig.3 Morphology characters of isolates pathogen
2.3.2 病原菌rDNAITS及2對看家基因的序列特征
對供試16株菌株的rDNAITS與EF1-α及LSU這2對看家基因的序列進行擴增、測序與BLAST比對,發現這16個菌株在rDNAITS序列及LSU基因位點上與多個N.dimidiatum(原名N.novaehollandiae)菌株有100%的相似性,EF1-α與多個上述真菌的相似性達到99%。這說明從南疆發病國槐枝條上分離得到的菌株為新暗色柱節孢N.dimidiatum。將這些序列遞交至GenBank數據庫獲得GenBank登錄號(各菌株ITS序列及2對看家基因序列對應的GenBank號見表3)。利用MEGA 11.0版軟件對供試菌株以及已登錄GenBank的葡萄座腔菌目代表性菌株基于ITS-EF1α-LSU的序列構建聯合系統發育樹。進化樹采用鄰接法(Neighbor-joining method, NJ)構建。根據串級序列系統發育樹,可以看到16株供試菌株與3個N.novaehollandiae(現名N.dimidiatum)菌株以較高的自舉置信度位于同一分支上(圖4)。結合Blast比對結果與系統發育分析結果,可以認為從發病國槐枝條上分離得到的致病菌株與新暗色柱節孢N.dimidiatum的遺傳距離最小。結合致病性測定及形態學特征,確定引起國槐枝枯病的病原菌為新暗色柱節孢(N.dimidiatum)。
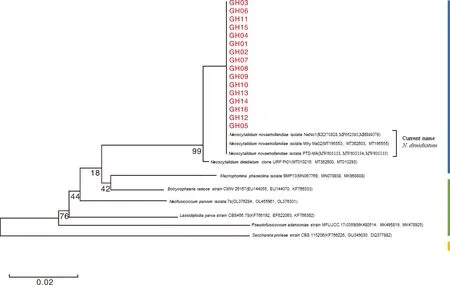
圖4 基于ITS-EF1α-LSU基因序列構建的國槐枝枯病原菌16個菌株與其他葡萄座腔菌目菌株的系統發育樹Fig.4 Phylogenetic tree of S. japonica pathogens and other Botryosphaeriales strains based on combined ITS-EF1α-LSU sequences

表3 培養基對國槐枝枯病原菌GH01菌絲生長及產孢的影響Table 3 Effects of different culture media on mycelial growth and sporulation of Neoscytalidium dimidiatum isolate GH01
2.4 國槐枝枯病病原菌的生物學特性
2.4.1 培養基對病原菌菌絲生長及產孢的影響
培養基種類對菌株GH01菌絲生長與分生孢子形成的影響具有一定差異。對菌絲生長有促進作用的培養基不一定能夠促進病原菌的分生孢子形成,同時,利于產孢的培養基也不一定能夠促進菌絲生長。綜合判斷,PDA培養基最適宜國槐枝枯病原菌的菌絲生長及分生孢子的形成,而WA培養基則最不利于病原菌的生長與產孢(表3)。在不同培養基上生長的病原菌落形態也有差異,在NA培養基上生長的菌絲較為致密,而其他供試培養基上生長的菌絲則相對稀疏。
2.4.2 溫度對病原菌生長及產孢的影響
不同溫度對菌株GH01菌絲生長及分生孢子形成的影響存在一定差異。從實驗結果來看,國槐枝枯病原菌在溫度≤5 ℃時,既不能進行正常的菌絲生長又無法產生分生孢子;當溫度處于10~40 ℃時,病原菌可完成菌絲生長及分生孢子形成;當溫度為34 ℃時,菌絲生長速率及產孢數量達到最大值并顯著高于其他溫度(圖5)。

同色塊數據后沒有相同小寫字母表示不同處理間差異顯著(P<0.05)。Same color blocks marked without the same lowercase letters indicate signficant (P<0.05) difference.圖5 溫度對國槐枝枯病原菌GH01菌絲生長及產孢的影響Fig.5 Effects of different temperature on mycelial growth and sporulation of Neoscytalidium dimidiatum isolate GH01
2.4.3 相對濕度對病原菌分生孢子萌發的影響
菌株GH01在相對濕度10%~90%的條件下均能夠萌發(圖6),但在不同相對濕度下分生孢子的萌發率存在一定差異。在相對濕度10%的條件下,病原菌的6 h孢子萌發率最高;在相對濕度75%與90%的處理下其萌發率無顯著性差異。
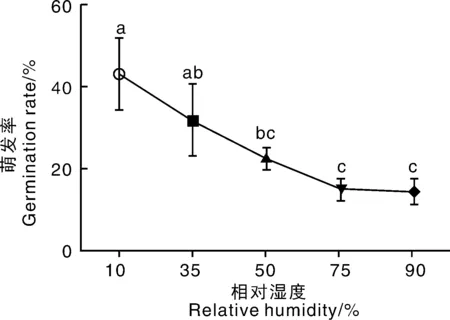
數據點上無相同小寫字母的表示不同處理間差異顯著(P<0.05)。Dots marked without the same lowercase letters indicate signficant (P<0.05) difference.圖6 相對濕度對國槐枝枯病原菌GH01分生孢子萌發的影響Fig.6 Effects of different relative humidity on spores’ germination of Neoscytalidium dimidiatum isolate GH01
2.4.4 pH對病原菌生長及產孢的影響
菌株GH01在pH值3.5~11的范圍內菌絲均能夠生長,當pH為5時,菌絲的干重最大,菌球分布均勻,密度最佳。在供試的pH值范圍內,病原菌也都能夠形成分生孢子,當pH值為7-9時,其產孢量最大。綜合來看,偏酸性環境利于國槐枝枯病原菌的菌絲生長;而中性偏堿的環境利于該病原菌分生孢子的形成(圖7)。

同一折線數據后沒有相同小寫字母的表示不同處理間差異顯著(P<0.05)。Data in the same line without the same lowercase letters indicate signficant (P<0.05) difference.圖7 pH對國槐枝枯病原菌GH01菌絲生長及產孢的影響Fig.7 Effects of different pH value on mycelial growth and sporulation of Neoscytalidium dimidiatum isolate GH01
2.4.5 不同碳、氮源對病原菌生長及產孢的影響
不同碳氮源對菌株GH01的生長及病原菌分生孢子的形成影響具有一定的差異。供試碳源中,木糖、甘油、山梨糖的菌絲生長速率不顯著高于無碳源的對照培養基,即這4種碳源無法被國槐枝枯病原菌絲生長所利用。在各不同碳源培養基上生長的菌絲干質量與其生長速率大致呈正相關(表4)。從病原菌的產孢數量來看,所有供試碳源均無法被病原菌產孢所利用。
在供試氮源中,除牛肉膏外菌株在其余氮源培養基上的生長速率均小于對照組,但由于菌絲疏密程度不同,其在蛋白胨、精氨酸等多種氮源培養基中生長的菌絲其干質量高于對照組;此外蛋白胨、苯丙氨酸、草酸銨及牛肉膏也可以較好地為病原菌的產孢所利用(表5)。

表5 不同氮源對國槐枝枯病原菌GH01菌絲生長及產孢的影響Table 5 Effects of different N sources on mycelial growth and sporulation of Neoscytalidium dimidiatum isolate GH01
3 討論
通過對國槐枝枯病菌的形態學特征觀察及rDNA ITS序列與EF1α、LSU這2對看家基因的序列系統發育分析,明確引起南疆地區國槐枝枯病的病原菌為新暗色柱節孢(N.dimidiatum)。據我們所知,這是一種之前未見報道的新病害。病原菌新暗色柱節孢是Crous等[14]在研究葡萄座腔菌科(Botryosphaeriaceae)的18個屬系統發育關系時重新整合建立的新種組合,近年,真菌分類學界又對該菌種的分類學地位進行了新的界定,將原Neoscytalidium屬的3種植物病原菌N.hyalinum、N.novaehollandiae、N.orchidacearum都囊括在了新暗色柱節孢N.dimidiatum中[15]。本次分離得到的病原菌N.novaehollandiae也因此被界定為新暗色柱節孢。根據前人的研究報道,病原菌新暗色柱節孢(N.dimidiatum)的寄主范圍廣泛。它能侵染危害松樹[3]和桑樹[16],且梨樹[17]、蘋果樹[18]、山楂樹[19]、葡萄[20]和杏樹[21]也是新暗色柱節孢的易感寄主,這些寄主廣泛分布于南疆和北疆。除了這些寄主外,南疆還廣泛分布有柳樹、杏樹、核桃樹、沙棗樹和其他種類的槐樹,據我們初步觀察,柳樹、黃金槐也有類似的癥狀引起大量枝條枯死。若南疆的梨樹、蘋果樹、杏樹、核桃樹、山楂樹也會被該菌侵染,其危害巨大,因此非常有必要開展進一步的研究。據報道,該病原菌的快速傳播已造成土耳其、伊朗等地的嚴重經濟損失[2,20-21]。南疆地區的氣候條件與上述國家及地區十分相近,存在病害嚴重發生的可能。 在病原物潛在寄主范圍廣、氣候條件適宜的南疆,明確新暗色柱節孢所引起病害的致病及流行機制、寄主范圍、病害的防治措施等,對于支持該地區的果樹產業發展、減少經濟損失十分重要。上述問題有待進一步研究解決。
綜上,本研究發現,造成新疆南疆地區大量行道國槐枝枯、葉落甚至枯死的病原菌為新暗色柱節孢(N.dimidiatum),該病原菌在10 ~ 40 ℃均可以生長,最適生長溫度為34 ℃,相對濕度較低時,分生孢子的萌發和生長速度更快。該菌株最適碳源為甘露糖,而對木糖、山梨糖的利用效果較差;最適氮源為牛肉膏、蛋白胨,而對硝態氮的利用效果較差,對尿素的利用效果最差。在實際生產過程中,應加強苗木的管護、及時清除銷毀病枝病樹,嚴防病害的傳染以減少其造成經濟及生態損失。

