羧胺三唑乳清酸鹽對人胰腺癌細(xì)胞系增殖及脂肪酸合成代謝的影響
郭泓江,徐也婷,張迪雅,仇佳星,王鈺鋮,鞠 瑞,郭 磊
中國醫(yī)學(xué)科學(xué)院基礎(chǔ)醫(yī)學(xué)研究所 北京協(xié)和醫(yī)學(xué)院基礎(chǔ)學(xué)院 藥理學(xué)系,北京 100005
胰腺癌(pancreatic cancer, PC)是全球癌死亡的主要原因,根據(jù)美國癌協(xié)會發(fā)布數(shù)據(jù),胰腺癌5年生存率僅有12%,并且其發(fā)病率仍以每年1%的速度增加,預(yù)計2040年將成為美國癌死亡的第2大原因[1-2]。中國國家癌中心2023年報告顯示,胰腺癌位居中國癌致死率第6位,其中胰腺導(dǎo)管腺癌(pancreatic ductal adenocarcinoma, PDAC)是最常見的胰腺癌類型。手術(shù)切除是胰腺癌最有效的治療手段,但由于起病隱匿,缺乏早期篩查方法,多數(shù)患者被診斷為晚期或轉(zhuǎn)移性疾病,無法進(jìn)行手術(shù)切除,因此幾乎所有患者都需接受輔助化學(xué)治療[3]。然而耐藥性的出現(xiàn)嚴(yán)重限制了化學(xué)治療有效性。快速增殖的癌細(xì)胞需要足夠的脂肪酸來支持膜和信號分子的生物合成,脂質(zhì)代謝功能對于PDAC進(jìn)展及耐藥表型產(chǎn)生尤為重要。因此,探索干預(yù)脂質(zhì)代謝的新方法對突破胰腺癌治療有重要意義。
羧胺三唑(carboxyamidotriazole,CAI)是一種非細(xì)胞毒類小分子化合物,通過抑制腫瘤細(xì)胞線粒體電子傳遞鏈復(fù)合物Ⅰ阻斷氧化呼吸,在多種癌模型中具有顯著的抗腫瘤活性[4]。近年來,不斷有證據(jù)發(fā)現(xiàn)CAI具有代謝調(diào)節(jié)劑的作用,通過激發(fā)腫瘤細(xì)胞谷氨酰胺代謝依賴性,使得CAI聯(lián)合谷氨酰胺代謝抑制劑策略在腫瘤治療中取得顯著療效[5]。其乳清酸鹽形式羧胺三唑乳清酸鹽(carboxyamidotriazole-orotate, CTO)可進(jìn)一步降低口服毒性并提高生物利用度。在缺氧或營養(yǎng)匱乏的微環(huán)境中,腫瘤細(xì)胞將改變其代謝模式以維持增殖,其中谷氨酰胺可以作為替代碳源,通過還原羧化作用優(yōu)先供應(yīng)脂肪酸的生成[6]。然而,CTO對胰腺癌細(xì)胞脂肪酸代謝的影響尚不明確。本研究旨在探索CTO對不同化療敏感性胰腺癌細(xì)胞增殖的影響,并初步探究CTO誘導(dǎo)胰腺癌細(xì)胞脂質(zhì)合成代謝重編程的機(jī)制。
1 材料與方法
1.1 材料
1.1.1 細(xì)胞系:人胰腺癌細(xì)胞系A(chǔ)sPC-1、PANC-1、MiaPaCa-2(國家生物醫(yī)學(xué)實驗細(xì)胞資源庫)、人胰腺癌細(xì)胞吉西他濱(gemcitabine, GEM)耐藥株AsPC-1/GEM(武漢普諾賽生命科技有限公司,以下簡稱AR細(xì)胞)。
1.1.2 藥品與試劑:羧胺三唑乳清酸鹽(MCE公司);DMEM高糖培養(yǎng)基、0.25%胰蛋白酶(國家生物醫(yī)學(xué)實驗細(xì)胞資源庫);XF Long Chain Fatty Acid Oxidation Stress Test Kit(Agilent 公司);DMSO(JiSiEnBei公司);甲醇(國藥集團(tuán)化學(xué)試劑有限公司);青霉素-鏈霉素混合液,胎牛血清、磺酰羅丹明B(sulfoehodamine,SRB)細(xì)胞增殖和毒性檢測試劑盒、BCA蛋白質(zhì)定量檢測試劑盒(翌圣生物科技有限公司);RIPA裂解液、PMSF(北京索萊寶科技有限公司);總RNA提取試劑、Evo M-MLV 反轉(zhuǎn)錄試劑預(yù)混液(湖南艾科瑞生物工程有限公司);PowerUpTMSYBRTMGreen Master Mix(Thermo Fisher公司);兔抗ACC、p-ACC、AMPK、p-AMPK抗體(CST公司);兔抗c-Myc抗體(Proteintech公司)。
1.2 方法
1.2.1 細(xì)胞的分組及處理:AsPC-1、PANC-1、MiaPaCa-2、AR細(xì)胞在含有10%FBS的DMEM高糖培養(yǎng)基中培養(yǎng)。取對數(shù)增殖期的細(xì)胞,分組為:對照組(control組);給藥組(CTO組),用DMSO將CTO配置為20 mmol/L母液,后用DMEM培養(yǎng)基稀釋為20 μmol/L工作液處理細(xì)胞。
1.2.2 細(xì)胞增殖實驗:使用sulforhodamine B (SRB)法檢測細(xì)胞存活情況。SRB實驗按照標(biāo)準(zhǔn)程序進(jìn)行,將細(xì)胞以每孔1×104個細(xì)胞接種于96孔板中,分組,給藥組以20 μmol/L CTO培養(yǎng)48及72 h,每孔加入200 μL DMEM培養(yǎng)。隨后按SRB檢測試劑盒說明書進(jìn)行固定及染色。在515 nm波長處測量吸光度,并依據(jù)吸光度計算細(xì)胞活率。計算公式為細(xì)胞活率=(Asample-Ablk)/(Acon-Ablk)×100%。
1.2.3 RT-qPCR檢測胰腺癌細(xì)胞系中脂肪酸合成關(guān)鍵基因mRNA轉(zhuǎn)錄水平:取對數(shù)生長期的各株胰腺癌細(xì)胞按照每皿1×106個細(xì)胞接種于6 cm培養(yǎng)皿中,過夜貼壁后給藥,48 h后使用Trizol提取總RNA,反轉(zhuǎn)錄為cDNA后使用SYBR Green Master Mix在CFX96 Touch Real Time PCR系統(tǒng)進(jìn)行檢測。所有樣品均單獨歸一化為β-actin。引物序列如表1所示。

表1 RT-qPCR引物序列Table 1 Primer sequences for RT-qPCR
1.2.4 Western blot檢測細(xì)胞AMPK/ACC通路相關(guān)蛋白表達(dá):取對數(shù)增殖期的各株胰腺癌細(xì)胞按照每皿5×105個細(xì)胞接種于6 cm培養(yǎng)皿中,過夜貼壁后給藥,48 h后提取蛋白,BCA法測定蛋白濃度后取30 μg蛋白進(jìn)行上樣、電泳、轉(zhuǎn)膜反應(yīng),加入一抗AMPK、p-AMPK、ACC、p-ACC、c-Myc抗體及內(nèi)參抗體β-actin(1∶1 000),4 ℃孵育過夜,然后與HRP標(biāo)記的山羊抗兔IgG二抗(1∶5 000)室溫孵育2 h。使用增強型化學(xué)發(fā)光液顯影,用Image J軟件分析吸光度值。
1.2.5 靶向代謝組學(xué)分析:接種4×106個AsPC-1/GEM細(xì)胞于10 cm培養(yǎng)皿中。給藥培養(yǎng)48 h后收樣,樣品置干冰上,按照每1×106個細(xì)胞加入40 μL預(yù)冷的80%(v/v)甲醇水直接萃取代謝物,并用細(xì)胞刮刀刮下,轉(zhuǎn)至離心管,然后在15 000 r/min,4 ℃下離心30 min。重復(fù)上述離心過程2次后,將50 μL上清液轉(zhuǎn)移至新的潔凈液相小瓶中,用于后續(xù)的液相-質(zhì)譜分析。對對照組和CTO組進(jìn)行差異代謝物分析[log2(fold change)≥1]。
1.3 統(tǒng)計學(xué)分析
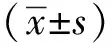
2 結(jié)果
2.1 CTO顯著降低胰腺癌細(xì)胞系的生存率
與對照組相比,AsPC-1、AR、PANC-1、MiaPaCa-2四株人胰腺癌細(xì)胞在20 μmol/L CTO作用48 h及72 h后,細(xì)胞生存率顯著降低(P<0.05,P<0.01,P<0.001)(圖1)。

A.survival rate of AsPC-1,AR,PANC-1 and MiaPaCa-2 cells after being treated with CTO for 48 hours; B.survival rate of AsPC-1,AR,PANC-1 and MiaPaCa-2 cells after being treated with CTO for 72 hours; *P<0.05, **P<0.01, ***P<0.001 compared with control.
2.2 CTO降低AR細(xì)胞中脂肪酸代謝物的含量
與對照組相比,AR細(xì)胞CTO給藥組有26個脂肪酸代謝物產(chǎn)生顯著變化,其中22個代謝物質(zhì)的含量顯著減少(P<0.05)。各組AR細(xì)胞脂肪酸代謝組學(xué)聚類熱圖見圖2。

The bottom showed the numbers of the samples in the control group and the CTO group, from left to right, there were 4 control groups and 4 CTO groups; the right side represented the name of 26 lipid metabolites with significant differences(P<0.05), the color of the thermal aggregation graph indicated the amount of metabolites in the sample, where the expression level from red to blue gradually decreased; the cluster tree was located on the left side of the picture, and 26 lipid metabolites were clustered.
2.3 CTO對AMPK/ACC通路的影響
與對照組相比,4株胰腺癌細(xì)胞在CTO作用后腺苷酸激活蛋白激酶(AMP-activated protein kinase,AMPK)、乙酰輔酶A羧化酶(acetyl-CoA carboxy-lase, ACC)蛋白表達(dá)均顯著降低,而p-AMPK、p-ACC蛋白表達(dá)顯著增加(P<0.05,P<0.01,P<0.001)(圖3)。

*P<0.05, **P<0.01, ***P<0.001 compared with control.
2.4 CTO下調(diào)胰腺癌細(xì)胞中脂肪酸合成關(guān)鍵基因的轉(zhuǎn)錄水平
與對照組相比,CTO給藥組的4株胰腺癌細(xì)胞內(nèi)脂肪酸合成關(guān)鍵基因SREBF1、FASN、ACACA、ACLY的mRNA水平均顯著降低(P<0.05,P<0.01,P<0.001)(圖4)。

*P<0.05, **P<0.01, ***P<0.001 compared with control.
2.5 CTO抑制胰腺癌細(xì)胞中c-Myc的表達(dá)
與對照組相比,CTO給藥組4株胰腺癌細(xì)胞中c-Myc蛋白表達(dá)均顯著降低(P<0.05,P<0.01)(圖5)。

*P<0.05, **P<0.01 compared with control.
3 討論
“代謝重編程”是腫瘤的標(biāo)志之一,在腫瘤微環(huán)境中,腫瘤細(xì)胞會啟動特定的能量代謝途徑,以滿足增殖的需求[7]。胰腺癌具有廣泛的代謝異質(zhì)性,改善代謝不僅影響胰腺癌細(xì)胞的存活,靶向代謝特征進(jìn)行干預(yù)可能是一種行之有效的治療耐藥的方式[8]。 脂質(zhì)代謝是腫瘤代謝重編程的重要途徑, 脂肪酸是細(xì)胞能量儲存、信號分子生成和膜增殖所必需的物質(zhì)[9]。腫瘤的高脂肪酸氧化水平可以代償性增加細(xì)胞ATP和NADPH,與化療耐藥密切相關(guān)[10]。因此,脂肪酸代謝從多個方面影響癌細(xì)胞的生物學(xué)性質(zhì)。
腫瘤細(xì)胞傾向于增加內(nèi)源性脂質(zhì)的從頭合成,這種異常的脂肪酸和膽固醇的生物合成為腫瘤細(xì)胞高度增殖和不斷適應(yīng)不利微環(huán)境(如缺氧和營養(yǎng)匱乏)提供了持續(xù)的養(yǎng)料。乙酰輔酶A羧化酶(acetyl-CoA carboxylase,ACC)是脂肪酸合成途徑的限速酶,主要由ACACA基因編碼,同時是 AMPK 的下游調(diào)控因子。AMPK 可通過將 ACC磷酸化而使得ACC 活性喪失,進(jìn)而控制脂肪酸的生成,對下游脂肪酸代謝產(chǎn)生重要影響[11]。在三羧酸循環(huán)過程中,細(xì)胞通過ATP檸檬酸裂解酶(ATP-citrate lyase, ACLY)催化檸檬酸產(chǎn)生乙酰輔酶A,后者經(jīng)由ACC催化生成丙二酰輔酶A,然后通過脂肪酸合成酶(fatty acid synthase, FASN)進(jìn)一步合成細(xì)胞增殖所需的各種脂肪酸。FASN也是脂肪酸合成的關(guān)鍵酶之一,其過表達(dá)通常與癌進(jìn)展緊密相關(guān)[12]。
前期研究證明,羧胺三唑可通過抑制細(xì)胞線粒體呼吸,減少細(xì)胞ATP的產(chǎn)生,影響能量感應(yīng)分子AMPK的活性和表達(dá),進(jìn)而誘發(fā)腫瘤細(xì)胞的代謝重編程[4]。本研究旨在進(jìn)一步探索CTO對多株胰腺癌的抗腫瘤作用,并探究其調(diào)控腫瘤細(xì)胞脂肪酸合成的機(jī)制,為尋找新的靶向代謝療法及聯(lián)合用藥策略提供理論基礎(chǔ)。
本研究證實,無論是否為化療藥敏感或耐藥的胰腺癌細(xì)胞,CTO均發(fā)揮顯著抑制其增殖的作用;CTO作為代謝調(diào)節(jié)劑,通過抑制癌基因c-Myc蛋白表達(dá),調(diào)控AMPK/ACC通路,下調(diào)脂肪酸合成路徑的基因表達(dá),進(jìn)而抑制細(xì)胞脂肪酸合成能力。這種作用可能是CTO抑制PDAC細(xì)胞增殖的重要機(jī)制之一。膽固醇調(diào)節(jié)元件結(jié)合蛋白(sterol regulatory element-binding proteins,SREBPs)是脂類代謝物合成的主要轉(zhuǎn)錄調(diào)控因子,通過調(diào)控FASN以及ACC等基因表達(dá)調(diào)節(jié)脂肪酸的合成。癌基因c-Myc可SREBPs協(xié)同調(diào)節(jié)脂質(zhì)生成,從而影響腫瘤細(xì)胞的增殖[13-14]。本研究初步證實CTO可以下調(diào)4株人胰腺癌細(xì)胞中c-Myc的蛋白表達(dá),同時證明CTO顯著下調(diào)細(xì)胞內(nèi)SREBF1等脂肪酸合成相關(guān)基因的轉(zhuǎn)錄水平,但是對于CTO調(diào)控c-Myc表達(dá)的機(jī)制以及c-Myc下游調(diào)控位點的探討仍然較淺,將在日后進(jìn)一步完善CTO對胰腺癌細(xì)胞c-Myc調(diào)控與脂肪酸代謝之間關(guān)聯(lián)的機(jī)制探索。

