暹羅芽孢桿菌Y-54 對番茄葉霉病的生防作用
曾婉寧,王彥譞,王繁珍,陳招榮,劉慧芹,,姜永成,艾則麥提·圖爾洪,李寶通,
(1.天津農學院 園藝園林學院,天津 300384;2.天津農學院 計算機與信息工程學院,天津 300384;3.和田職業技術學院,新疆 和田 848000;4.天津農學院 工程技術學院,天津 300384)
番茄葉霉病是由黃褐孢霉菌(Cladosporium fulvumCooke)引發的番茄上一種極為嚴重的葉部病害。葉霉病一旦發生,會迅速擴展,流行性極強,其防治往往是在加強栽培管理的基礎上,依靠化學藥劑防治控制病情[1]。但是化學藥劑防治病害造成的病原菌抗藥性增強、環境污染、農產品安全等問題日益嚴重。生物防治以其安全、健康、綠色的理念受到廣泛關注[2-5]。目前的研究表明,芽孢桿菌因其種類繁多、存在廣泛、功能豐富、適應性強,已成為植物病害生物防治中重要的菌種資源[6-10]。因此,深入開展芽孢桿菌對番茄葉霉病的生物防治研究,對進一步探明芽孢桿菌的生防機制及開展番茄葉霉病的綠色綜合防控具有重要意義。近年來,眾多學者在番茄葉部病害生物防治方面開展了生防菌挖掘篩選、生防效果和作用機制等的深入研究。WANG 等[11]研究表明,枯草芽孢桿菌WXCDD105 對番茄葉霉病的防效可達72.07%,對番茄種子萌發和幼苗生長均有促進作用。GAO 等[12]篩選了28 株拮抗細菌,其中貝萊斯芽孢桿菌ZSY-1 對番茄多種葉部病害有突出防效,且該菌可產生脂肽類抗菌物質伊枯草菌素A。SONG 等[13]的研究表明,高地芽孢桿菌B1-15 可產生揮發性有機物和較高水平的蛋白酶,有效促進番茄幼苗生長,減輕果實采后病害,延長貯藏期。此外,芽孢桿菌的微生物菌劑、微生物菌肥、微生物農藥等生防產品的研發應用都取得了巨大進展[14]。目前,我國建立了較為完善的有害生物生防體系,形成了農用微生物菌劑和微生物肥料的標準體系,對引導和規范行業發展發揮著重要作用[15-16]。暹羅芽孢桿菌(Bacillus siamensis)是芽孢桿菌屬近10 a 研究發現的新種[17],因其廣譜抗菌性及具有其他生物活性成為極具有開發潛力的新型芽孢桿菌[18]。暹羅芽孢桿菌Y-54 是從健康紅掌分離出的一株內生拮抗菌,對多種植物病原真菌有較強的抑制作用[19]。該菌株及其應用已于2021 年獲國家發明專利(專利號:20202010730157.5)。目前,雖然對番茄葉部病害生物防治的研究較為深入,但能夠有效抑制番茄葉霉病菌并對該病害有突出防效的拮抗菌株還較少,涉及生防菌定殖情況和促生表現等的研究不夠全面深入。因此,需要深入挖掘生防資源并就其功能和機制開展研究。為深入挖掘菌株Y-54 的生防潛力和擴寬應用范圍,研究該菌株對番茄葉霉病菌的抑制作用及其定殖變化和促生作用,并分析其在盆栽試驗中的防治效果,以期為番茄葉部病害的綠色防控提供理論依據。
1 材料和方法
1.1 材料
供試菌種:暹羅芽孢桿菌(B.siamese)Y-54、番茄葉霉病菌(C.fulvumCooke),由天津農學院植物病理學實驗室提供;番茄品種:春野、精品L400,由遼寧綠野農業科技有限公司提供;培養基:LB 固體及液體培養基、PDA 培養基;藥劑:10%苯醚甲環唑WDG(山東百農思達生物科技有限公司)、50%多菌靈WP(浙江一帆化工有限公司)。
1.2 方法
1.2.1 菌株活化、發酵液及孢子懸浮液的制備 菌株活化:挑取菌株Y-54 單菌落在LB 培養基中劃線,于28 ℃培養箱培養48 h。使用打孔器打取直徑5 mm 番茄葉霉病菌菌餅,接種于PDA 培養基,于25 ℃恒溫培養3~5 d。
菌株Y-54 發酵液制備:挑取菌株Y-54 單菌落至裝有250 mL LB 液體培養基的三角瓶中,28 ℃、180 r/min 振蕩培養24~36 h,形成菌液,調節菌液濃度至1.0×108cfu/mL,再依次稀釋為10×、20×、50×、100×發酵液。
番茄葉霉病菌孢子懸浮液制備:活化好的葉霉菌產孢后,用無菌水洗脫孢子,過濾菌絲,10 000 r/min 離心1 min,棄上清液,收集孢子,再用無菌水沖洗孢子,用血球計數板調節孢子濃度為1.0×107cfu/mL。
1.2.2 拮抗菌株Y-54 對番茄葉霉病菌的抑制作用測定 菌株對峙:將病原菌接種至PDA 平板中間位置,距病原菌四周1.5 cm 處劃線接種拮抗菌;發酵液抑制:采用四點對峙培養的方法,將病原真菌接種在PDA 培養基的正中央,距病原菌四周1.5 cm 處放置4 個濾紙片,然后分別在濾紙片上滴10 μL 拮抗菌發酵液;無菌濾液抑制:拮抗菌發酵液經12 000 r/min 離心20 min,取上清液經0.22 μm 一次性微孔濾膜過濾后得到無菌濾液。將其與PDA 培養基(1∶9)充分混合,制成平板后將病原菌菌塊接至培養基中央。以空白PDA 培養基為CK,均放入28 ℃培養7 d,重復3次,測定抑菌率。
菌絲生長抑制:挑取適量病原菌菌絲于無菌離心管中,分別加入1 mL 菌株Y-54 無菌濾液、1 000×苯醚甲環唑、500×多菌靈,充分浸泡24 h 后在顯微鏡下觀察菌絲的形態變化,以加入無菌水為CK[20]。
1.2.3 拮抗菌株Y-54 抗利福平篩選及其定殖能力測定 參照劉慧芹等[21]及高振峰等[22]的利褔平(Rif)標記法對菌株Y-54進行不同濃度梯度的抗性標記,使其抗生素抗性達到100 μg/L。將抗性菌株的菌液濃度調至約1.0×108cfu/mL,取100 mL 菌液澆灌在番茄幼苗基部,以澆灌無菌水為對照。每3 d 在番茄苗根、莖、葉等不同部位取樣,每部位隨機取樣5 次,共3.0 g。樣品經超聲波清洗并用75%乙醇消毒,研磨后加100 mL 無菌水稀釋,在含有50 μg/L Rif 的LB 平板上涂布100 μL,于28 ℃培養72 h后計算菌落數。每個處理重復3次。
1.2.4 拮抗菌株Y-54 對番茄種子萌發的影響試驗 番茄種子用0.1%高錳酸鉀液浸泡5 min,無菌水沖洗后,分別在0×(原液)、10×、20×、50×、100×菌株Y-54發酵液中浸泡24 h,以無菌水為CK,無菌培養皿中放30 粒種子,25 ℃黑暗培養,每日定時補添無菌水保持種子濕潤,設3 次重復,7 d 后測定發芽率。
1.2.5 拮抗菌株Y-54 對番茄幼苗生長的影響試驗 選取有2~3 片真葉時的盆栽番茄幼苗,分別用0×(即原液)、10×、20×、50×、100×發酵液進行灌根,每株10 mL,10 d 補施1 次,以無菌水為CK,室溫培養,播種30 d 后測量株高、鮮質量、葉長、葉寬及根長。采用YT-YD 便攜式葉綠素測定儀測定葉片的SPAD值,均設3次重復。
1.2.6 拮抗菌株Y-54 對番茄葉霉病的防治效果測定 于盆栽番茄幼苗長至3~4 片真葉期時,使用0×(原液)、50× Y-54 發酵液澆灌番茄幼苗,每株10 mL,以無菌水為對照,14 d后再補灌第2次菌液。第1 次澆灌Y-54 菌液7 d 后,利用針刺接種葉霉病菌,保濕24 h,室溫20~32 ℃,待其發病。針刺接種約14 d 后發病,一部分對照分別噴施50%多菌靈WP 500 倍液和10%苯醚甲環唑WDG 1 000 倍液,另一部分對照作空白。發病后7 d 和14 d 調查病情指數及防效。病情分級標準參考陳樂樂等[23]的方法。每個處理10 株,3 次重復。病情指數=∑(各級病株數×該病級值)/(調查總株數×最高級值)×100;防治效果=[1-(對照區藥前病情指數×施藥區藥后病情指數)/(對照區藥后病情指數×施藥區藥前病情指數)]×100%。
1.3 數據統計與分析
試驗數據采用SPSS 16.0 和Excel 2007 軟件進行統計分析,應用Duncan氏新復極差法進行處理間差異顯著性檢驗。
2 結果與分析
2.1 拮抗菌株Y-54對番茄葉霉病菌的抑制作用
菌株Y-54 對番茄葉霉病菌的抑制作用如圖1所示。菌株對峙培養、發酵液和無菌濾液均對番茄葉霉病菌有較強的抑制作用,抑制率分別達到78.42%、86.42%和91.26%。由此可見,菌株經過發酵后抑制效果更佳。
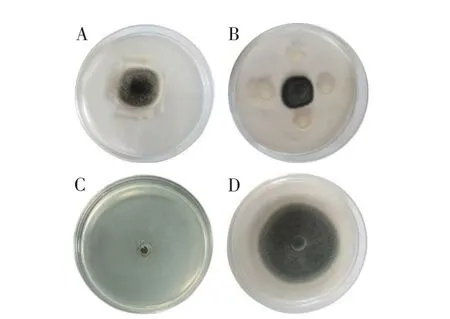
圖1 菌株Y-54對番茄葉霉病菌的抑制作用Fig.1 The inhibition effect of strain Y-54 on C.fulvum
菌株Y-54 對葉霉病菌菌絲生長的影響如圖2所示。CK(圖2A)菌絲粗細均勻,形態飽滿,結構完整。無菌濾液和1 000×苯醚甲環唑、500×多菌靈處理后會嚴重影響其生長發育,菌絲生長變形彎曲,菌絲體前端膨脹呈圓球狀,中段萎縮形成拐點或節點(圖2B、C);菌絲內物質外滲(圖2D),菌絲出現中空斷裂等現象(圖2B)。

圖2 菌株Y-54對番茄葉霉病菌菌絲生長的影響Fig.2 Effect of strain Y-54 on mycelium of C.fulvum
2.2 拮抗菌株Y-54在番茄中的定殖情況
抗性菌株Y-54 在番茄幼苗中的定殖情況如圖3 所示。在30 d 內,菌株Y-54 均可在番茄的根、莖、葉中定殖,但不同時間及不同部位的定殖量不同,整體上定殖量為根>葉>莖。在根部和葉部,18 d時定殖量達到最大,分別為8.37×105cfu/mL 和3.29×105cfu/mL,而在莖部則表現為15 d 時定殖量最大,為2.24×105cfu/mL。在莖、葉部,定殖的菌量變化趨勢較為一致,進入高峰期后,回落較平穩;而在根部定殖的菌量則表現為升降較明顯。可見,該菌株可以在番茄不同部位定殖,且更易在根部存活。
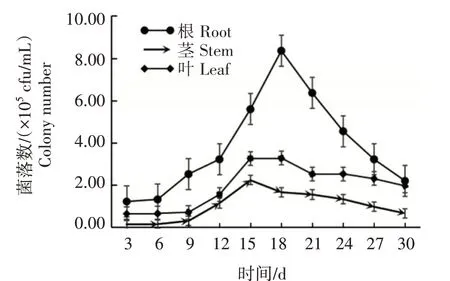
圖3 菌株Y-54在番茄幼苗中的定殖情況Fig.3 Colonization of strain Y-54 in tomato seedlings
2.3 拮抗菌株Y-54對番茄種子萌發的影響
菌株Y-54對番茄種子萌發的影響如表1所示。5 個稀釋倍數的發酵液均對種子萌發有促進作用。其中發酵原液(0×)對番茄種子萌發的促進作用最明顯,發芽率達93.33%;其次是10×與20×發酵液處理,番茄種子發芽率雖然顯著低于發酵原液處理,但也達86%以上,顯著高于50×和100×發酵液處理(P<0.05);50×和100×處理發芽率有所下降,但仍保持在76%以上,顯著高于CK(P<0.05)。整體上看,隨著稀釋倍數的增加,番茄種子發芽率降低,即濃度越高,發芽率越高。
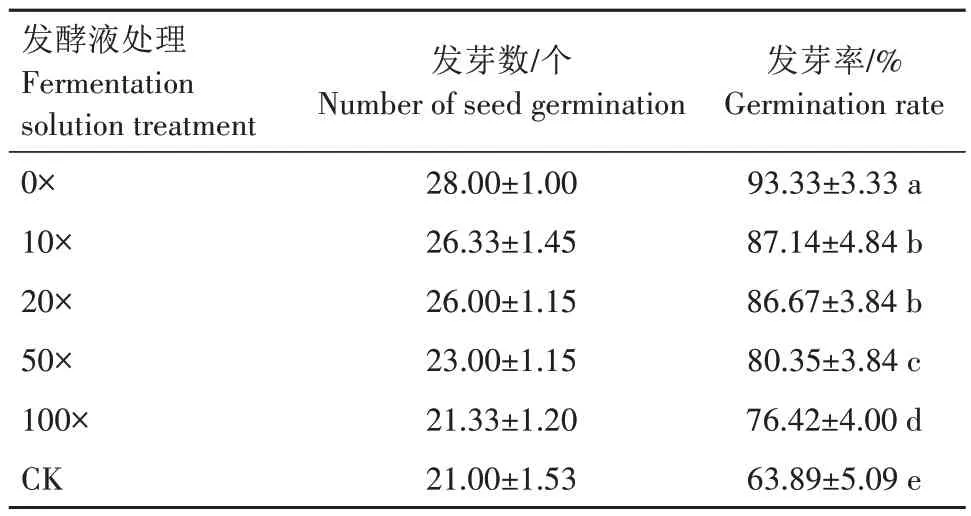
表1 菌株Y-54對番茄種子萌發的影響Tab.1 Effects of strain Y-54 on tomato seed germination
2.4 拮抗菌株Y-54對番茄幼苗生長的影響
采用不同稀釋倍數的菌株Y-54 發酵液對番茄幼苗灌根處理后,幼苗的生長狀況如表2 所示。根長、株高、莖粗、葉長、葉寬、鮮質量、葉綠素含量(SPAD 值)的變化較為一致,即隨著稀釋倍數增加,其各指標遞減。原液(0×)處理后幼苗各指標的表現最佳。0×、10×、20×發酵液處理對幼苗的影響均明顯,對各指標的促生作用影響均顯著高于CK(P<0.05)。
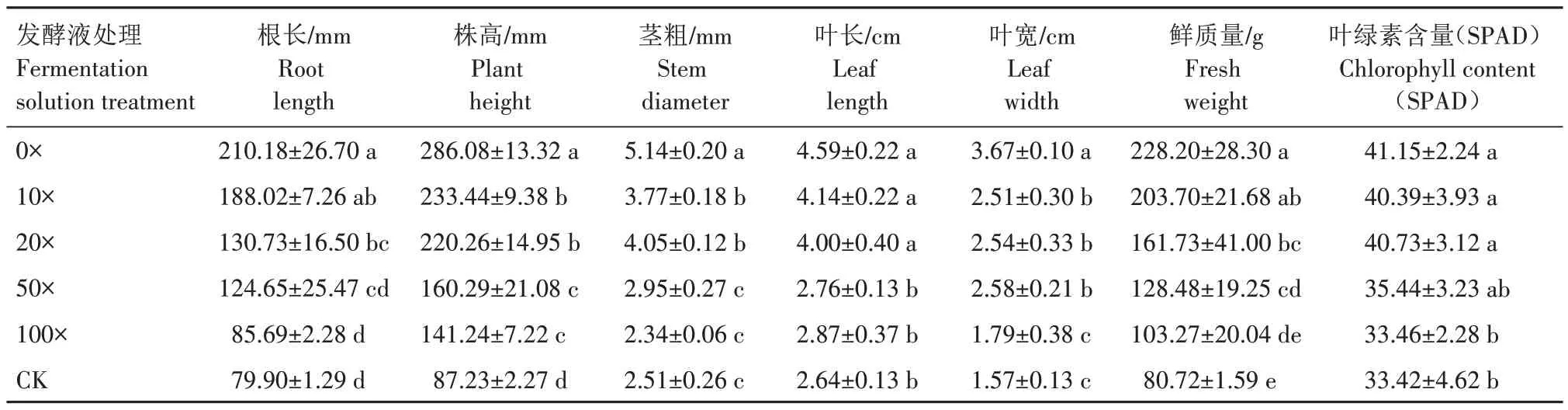
表2 菌株Y-54對番茄幼苗生長的影響Tab.2 Effects of strain Y-54 on tomato seedlings growth
2.5 拮抗菌株Y-54對番茄葉霉病的防治效果
菌株Y-54 對番茄葉霉病的防治效果如表3 所示。苯醚甲環唑對番茄葉霉病的防效最好,7 d 和14 d 的防效均在70%以上;其次是原液(0×)處理,7 d 時其防效略低于苯醚甲環唑處理,為68.04%,但二者之間并無顯著差異(P>0.05),14 d 時則顯著低于苯醚甲環唑處理,但2 次的防效均顯著高于多菌靈處理(P<0.05);50× Y-54 發酵液處理的防效較差,均顯著低于其他處理(P<0.05)。
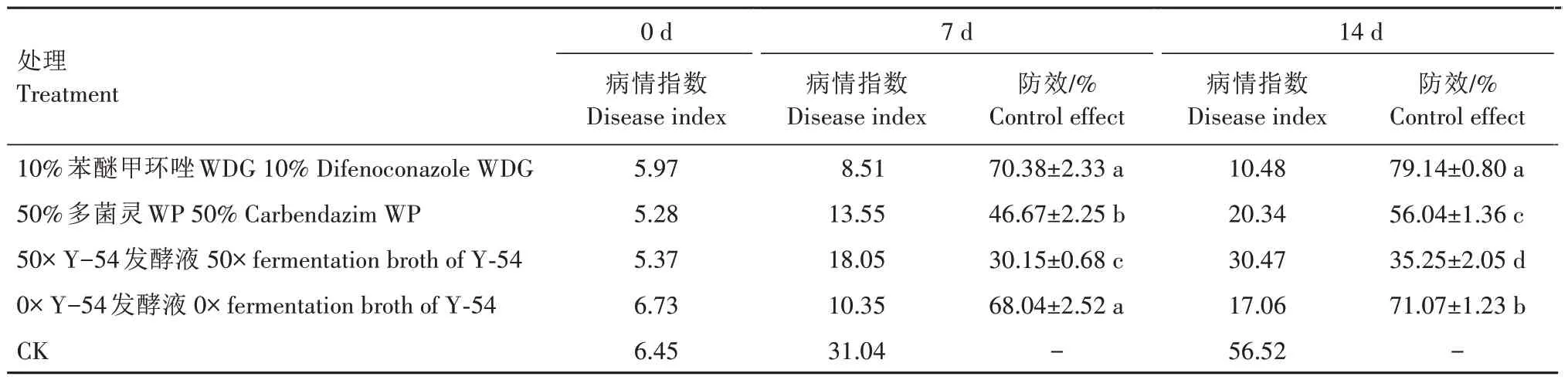
表3 菌株Y-54對番茄葉霉病的防效Tab.3 Control effect of strain Y-54 on tomato leaf mold
3 結論與討論
每個植物都是一個獨立的微生態個體,其體內的微生物體系在其適應環境、調節自身生長發育等方面發揮著重要作用[24],但外來的有益菌或致病菌往往會打破植物體內原有的微生態平衡,干擾植物的生長和生理變化。前期研究發現,菌株Y-54 可廣泛地生存在多種植物中[19],在本研究中,菌株Y-54可以定殖在番茄中,并與其他眾多芽孢桿菌具有相同的定殖特性[25-26],即更容易從根部經莖部到達葉部,且在根中的定殖量多高于其他部位,定殖菌量隨著接種時間延長呈先上升后下降的變化趨勢。在植物體內的生防菌能否成功控制病害,取決于其在植物、土壤等環境中的定殖能力和存活能力[27],該菌株具有定殖能力強、定殖范圍廣、在植物體內容易轉運的特點,表明其具備防控病害的優質潛力。
本試驗采用菌株對峙、發酵液以及無菌濾液3種方式均驗證了菌株Y-54 對番茄葉霉病菌有較強的抑制作用,尤其是發酵液及無菌濾液的抑菌效果較好,分別達到86.42%和91.26%,接近于WANG等[11]篩選的枯草芽孢桿菌WXCDD105 對該病菌的抑制率(94.44%)。芽孢桿菌可抑制病菌菌絲的正常生長發育,其抑菌機制表現在多個方面,如莫哈韋芽孢桿菌[28]和蠟蚧芽孢桿菌[29]可產生多種揮發性有機化合物;貝萊斯芽孢桿菌[30]可產生活性二肽等,引起菌絲變形、膨脹、萎縮、斷裂等現象。暹羅芽孢桿菌Y-54 同以上芽孢桿菌一樣,嚴重導致葉霉病菌菌絲變形,因此,推測菌株Y-54 也可能會產生類似的抑制物質,或通過誘導作用對病菌直接產生作用。
通過提前澆灌和后期補灌的方式,菌株Y-54對番茄葉霉病的防效比較突出,尤其是發酵原液在接種發病后7 d 和14 d 的防效達到70%左右,接近苯醚甲環唑處理,明顯好于多菌靈處理。可見,該菌株對番茄葉霉病有較理想的防治效果。該菌株對番茄的促生作用也較為明顯,其中原液作用最明顯,使種子發芽率達到93.33%;在幼苗生長過程中,各濃度發酵液均能促進番茄幼苗根長、株高、莖粗、鮮質量、葉綠素含量等指標增長,且發酵原液(0×)和10×、20×發酵液可顯著提高幼苗的各項生長指標。這與楊曉云等[27]研究的解淀粉芽孢桿菌B1619、陳秀香等[31]研究的枯草芽孢桿菌FC21 的作用效果一致。
生防微生物防治病害的機制是多方面的,包括對靶標菌的抑制作用、與病原物競爭作用位點,以及能夠產生蛋白質、多肽類、植物激素等物質,誘導植物產生多樣抗病性[25]。本研究僅測定了菌株Y-54抑菌、定殖、促生、防治作用,鑒于菌株Y-54具有較好的潛力,在后續研究中將就其抗病機制和生產應用開展深入的探索。
綜上,菌株Y-54 對番茄葉霉病菌有著較強的抑制作用,可導致病菌菌絲變形、膨脹、萎縮、斷裂等。菌株Y-54 可在番茄的根、莖、葉部位進行定殖,定殖菌量在30 d 內的變化趨勢呈先上升后下降,且在15~18 d 時達到最大。菌株Y-54 可以有效促進番茄種子的萌發,特別是發酵原液浸泡的種子發芽率最高,達93.33%;并且能有效促進幼苗根長、株高、鮮質量、葉綠素含量等各項指標的增長,以發酵原液(0×)和10×、20×發酵液的促生作用較好,顯著高于對照。菌株Y-54 的發酵原液(0×)對番茄葉霉病發病后7 d 和14 d 內的防效接近于苯醚甲環唑處理,達到70%左右,顯著高于多菌靈的防效。

