單細胞RNA測序技術在腎病中的研究進展
鄒皓珍 楊佳 席哲帆 紀瑞 董華
濱州醫學院附屬醫院腎內科,濱州 256603
科學技術的迅猛發展使生物醫學研究發生了翻天覆地的改變,由之前研究的器官、組織水平轉向了解單個細胞不同組成方向水平發展。腎臟是一個復雜且重要的器官,在生理穩態中發揮排泄代謝廢物,調節水電解質和酸堿平衡,維持內環境穩態及內分泌等多種重要功能。有研究表明,哺乳動物腎臟中存在超過16 種高度分化上皮細胞,而內皮細胞、免疫細胞和間質細胞的類型更多,各種細胞具有自己獨特的轉錄特征及專屬功能,不同類型細胞間的相互作用對腎功能至關重要[1]。既往技術僅檢測多種細胞的平均水平,無法辨別各種細胞在疾病發生、發展過程中的具體作用。而單細胞轉錄組測序(scRNA-seq)技術可以從單細胞水平精確辨別細胞類型,了解其在疾病中扮演的角色,可更好地了解疾病相關機制。由于scRNA-seq 技術在腎病研究領域飛速發展,本文就scRNA-seq 技術在臨床常見腎病中的最新發展及應用進行綜述。
scRNA-seq技術
scRNA-seq(圖1)是一項在單細胞水平對轉錄組進行高通量測序及分析的新技術,用于檢測和定量分析數千到數百萬個細胞樣本中信使RNA 分子的方法,可獲得單個細胞內近萬個基因的特異表達信息,同時解決了傳統測序無法解決的細胞異質性難題,為辨別生物組織中各細胞的轉錄組特征、解析單細胞行為、機制及與其機體的關系提供有利的工具。例如用于在胚胎發育、癌癥、成肌細胞、肺上皮分化以及淋巴細胞命運多樣化等情況,追蹤異質及相關的細胞狀態之間的譜系和發育關系。
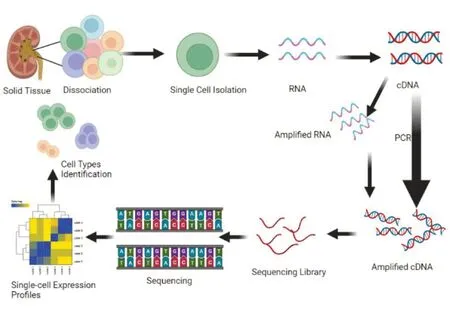
圖1 單細胞轉錄組測序(scRNA-seq)流程圖:固體組織分離→單細胞分離→RNA逆轉錄成cDNA→聚合酶鏈式反應擴增→建庫→測序→單細胞表達譜→識別細胞類型
2009 年Tang 等[2]首次應用scRNA-seq 技術,以高分辨率描述單個細胞中的RNA 分子,可測轉錄本的全長。隨著單細胞RNA 技術不斷發展,在單細胞分離、核苷酸序列擴增、基因測序、數據分析等步驟中演變出STRT-seq[3]、Smart-seq[4]、CEL-seq[5]、Quartz-seq[6]、Smart-seq2[7]、Drop-seq[8]、inDrop[9]等技術,存在偏倚性較強,錯誤率高,細胞通量少,價格貴等缺點(表1)。2017年后,10×Genomics平臺結合微流控技術實現高通量分析。同年Gierahn 等[10]開發Seq-Well 結合納米孔陣列,使捕獲率升高,成本降低。隨后,美國艾倫研究所開發Split-seq 技術,無需對單個細胞進行分離[11]。隨著商業化測序平臺的不斷發展,目前10×Chromium 和BD Rhapsody平臺是主流方法。scRNA-seq技術從最初檢測幾個細胞到十萬個細胞,顯著提高了實驗效率。同時,有效信息量不斷增加、成本不斷降低,這些都是scRNA-seq 技術在幾年內取得的成績。但scRNA-seq 技術仍有許多局限性,首先單細胞RNA 量很少,經高效擴增后只測得原細胞基因數的8%~16%;其次進行單細胞分離,獲取高質量單細胞懸液是單細胞研究成功的關鍵,取樣時需要新鮮的腎組織細胞,而實際情況是對超低溫冰凍腎組織細胞進行分離;一方面因細胞的狀態不同影響捕獲率,另一方面是細胞處于應激狀態,會改變部分基因表達[12]。為解決這一問題,研究人員發現單細胞RNA 測序(snRNA-seq)能捕獲細胞核中的mRNA,和scRNA-seq 相比具有同等基因檢測靈敏度,還能檢測出更多的足細胞,可解決組織保存及細胞分離的問題,同時可深入了解核內特異性調控機制;也可消除解離誘導的轉錄應激反應[13]。

表1 scRNA-seq技術的優缺點
scRNA-seq在腎病中應用
IgA 腎病(IgAN)是世界范圍內最常見的原發性腎小球腎炎,也是終末期腎病(ESRD)的重要病因,可發生于任何年齡,但以20~30歲男性多見,其特征是IgA 免疫復合物在腎小球沉積[14]。Tang 等[15]對IgAN 患者的腎活檢進行了全面的scRNA-seq 分析,首次發現IgAN 系膜細胞顯示4 種與細胞增殖和基質積累有關的新基因表達增加。IgAN 的發病機制可能與炎癥相關,吳昌為[16]從腸道感染、呼吸道感染和非特異性炎癥三個方面證明炎癥與IgAN 相關并且α 1-抗胰蛋白酶在IgAN 中表達增高。金美玲等[17]和Ding等[18]發現CD8+T 細胞、M2巨噬細胞參與了IgAN的發生發展過程,有可能作為IgAN 的干預靶點。研究發現系膜細胞中免疫球蛋白J鏈、氯離子通道蛋白1、核糖體蛋白基因S 26及IgAN足細胞中JunB原癌基因上調,這為IgA1 原位二聚體和沉積的發生機制提供了思路[19-20]。Zeng 等[21]對早期外周血細胞測序闡述自然殺傷(NK)細胞、B 細胞、核因子-κB 信號通路的變化及與臨床參數的相關性。Du 等[22]認為濾泡輔助性T 細胞可能通過腫瘤壞死因子超家族成員14-干擾素受體超家族成員14 信號通路激活B 細胞來促進IgAN 的進展。以上可為IgAN 的發病機制提供新的見解,并確定新的治療靶點[23]。
糖尿病腎病(DN)是持續高血糖引起的糖尿病微血管并發癥,是導致ESRD 的重要原因。scRNA-seq 在尿液細胞研究中也有進展,Abedini 等[24]對5 名DN 患者及10 名健康對照受試者的尿液樣本進行分析,將尿液細胞與人類腎臟和膀胱數據集進行比較發現除了巨噬細胞、淋巴細胞和膀胱細胞外,幾乎所有的腎細胞類型(如足細胞、近端小管、髓袢和集合管)都可以在尿液中識別。以上研究表明尿液細胞與人腎細胞在基因表達上具有相似性,以后可采集患者尿液細胞而非腎活檢,這種簡單的取材方式有助于疾病的診斷,并有助于患者個性化預后[25]。在信號通路及作用機制方面研究已久,DN 最早的結構改變之一就是腎小球,Liu等[26]發現在DN中肌醇相關轉錄因子-血清反應因子轉錄途徑的激活不僅發生在系膜細胞中,也存在腎小球細胞中,其研究提供了早期DN的全面單細胞轉錄組學景觀,突出了機械敏感信號通路為糖尿病腎小球疾病的新靶點。在作用分子方面,Zhang 等[27]發現Slit 引導配體3、磷酸二酯酶1A 和補體因子H 這3 個免疫基因可作為DN 的診斷標志物和治療靶點。
膜性腎病(MN)特征為腎小球基底膜上皮細胞免疫復合物沉積伴基底膜增厚。Xu 等[28]為了定義特發性膜性腎病(IMN)單細胞分辨率的轉錄組景觀,使用scRNA-seq 分析6 名抗磷脂酶A2 受體(PLA2R)陽性IMN 患者和2 名健康對照受試者的腎臟樣本,發現大多數腎實質細胞中的差異表達基因(DEG)主要參與炎癥和免疫反應調節,包括白細胞介素-17、腫瘤壞死因子、NOD 樣受體和絲裂原活化蛋白酶激信號傳導,伴有大量蛋白尿的IMN 表現出參與炎癥信號通路的基因表達升高,由此認為炎癥信號通路可能參與IMN 進展的發病機制。Chen 等[20]發現高表達基因如HLA-DRB5、HLA-DQA2、編碼干擾素γ、CC趨化因子配體2和核受體相關蛋白1 涉及最高富集途徑,顯示出細胞特異性表達方式。關于膜性腎病的分子特征,Sealfon R 等[29]在NEPTUNE 和歐洲腎臟cDNA 庫兩個隊列中鑒定158 個DEG,與其他腎小球疾病相比,MN 具有獨特的分子特征,包括許多足細胞表達基因的上調。以上研究有助于深入了解MN 的潛在病理生理機制。乙肝病毒相關性膜性腎病(HBV-MN)與血清PLA2R 陽性的IMN 相比,腎內皮細胞中過表達的基因主要富集于內質網蛋白靶向、胞吐、病毒基因表達、白細胞介素-6和白細胞介素-1分泌的調節。受體-配體串擾分析揭示了HBV-MN 中內皮細胞和其他細胞之間的潛在相互作用[29]。
目前,腎移植是ESRD最有效的治療方法,然而,慢性抗體介導的排斥反應(cABMR)仍然是腎移植患者長期生存急待解決的問題。Kong 等[30]對cABMR 患者和對照受試者的外周血單核細胞(PBMC)進行scRNA-seq 發現cABMR 患者的大多數細胞類型表現出強烈的干擾素反應和促炎性細胞因子的釋放,還發現線粒體ND6基因、CXC基序趨化因子配體8、核因子κB 抑制因子a、核因子κB 抑制物ζ 和其他基因的表達在T細胞和B細胞中上調,這些基因與促炎反應和免疫調節相關。研究發現,腎移植中的急性排斥反應(AR)患者在GEO、腎臟病數據庫和定量實時聚合酶鏈式反應中的表達水平均顯著升高。scRNA-seq 顯示AR 患者PBMC 中天然T、CD1C+_B DC、NK T 細胞、NK 細胞和單核細胞的百分比較高;高表達的六個中樞基因(靶向胞質分裂作用因子蛋白、NCK相關蛋白1、白細胞介素-2受體共同γ鏈、信號轉導淋巴細胞激活分子家族8、CD180分子和蛋白酪氨酸磷酸酶受體E型)與同種異體移植排斥反應、干擾素γ反應、干擾素α反應和炎癥反應相關[31]。Zhuang等[32]發現了一種新的B細胞亞群[白細胞分化抗原19(+)IGLC3(低)免疫球蛋白輕鏈kappa 恒定區(高)TCL1A(-)白胞分化抗原127(+)],該亞群在有調節的腎移植受體中表達被抑制,而白細胞介素-32可能是誘導該B 細胞簇分化的關鍵細胞因子,可能揭示了臨床上常用的免疫抑制劑對B細胞亞群的影響及其相關機制。
腎纖維化的定義是細胞外基質出現大量膠原沉積和積聚,造成腎實質逐漸硬化,破壞腎實質功能,直至腎臟完全喪失臟器功能。關于腎纖維化,Xu等[33]利用單細胞測序表明,嗜焦巨噬細胞上調一種叫CXC趨化因子配體10(CXCL10)的趨化因子釋放,從而激活腎內成纖維細胞,連接蛋白43 介導腎損傷期間腎小管上皮細胞釋放腺苷三磷酸,誘導腎小管周圍巨噬細胞焦下垂,隨后導致CXCL10的釋放和腎內成纖維細胞的活化,加速腎纖維化。Wu等[34]發現對照缺血再灌注損傷單側輸尿管梗阻和對照順鉑單側輸尿管梗阻階段的纖維化過程不同,其中免疫細胞和小管細胞(T 細胞活化主要發生在免疫細胞中,而脂肪酸代謝過程和花生四烯酸代謝發生在小管細胞中)具有不同的功能。單側輸尿管梗阻小鼠腎組織中的snRNA-seq 研究表明,補體C3 和C5 的合成增加主要發生在腎小管上皮細胞(近端和遠端)中,而補體C3a受體1和補體C5a受體1的表達增加發生在間質細胞中,包括免疫細胞[35]。
scRNA-seq技術應用的挑戰與展望
單細胞測序研究面臨眾多挑戰。首先,用于研究的腎臟活檢樣本來源匱乏;其次,獲取高質量的細胞懸液技術有待提高,腎臟的酶解分離困難,現有的單細胞分離技術都會在不同程度上對細胞造成損傷;第三,在測序前cDNA 擴增過程中,由于技術限制會產生擴增偏倚、非特異擴增;最后如何進一步減少反應量來降低成本,mRNA 的捕獲率繼續提高,并減少對特定設備的需求[36]。綜上都是單細胞測序應用于腎臟研究所面臨的挑戰。針對這些問題,如何提高擴增準確性、覆蓋率和操作便捷,如何高效獲取單細胞樣本,如何降低生物噪音,如何實現單細胞測序技術低成本推廣是未來科研工作者的研究目標。
隨著單細胞技術的深入研究,scRNA-seq 技術與常規組學或單細胞組學的聯合分析或將成為大熱點,如結合scRNA-seq 與批量RNA測序可以發現組織轉錄數據特異性信息,識別細胞與組織水平的共同特征;腎scRNA-seq 與尿蛋白組學聯合分析有助于挖掘疾病活動的生物特異性的標志物,尋找反映腎臟復雜分子生物學活動的尿蛋白[37]。scRNA-seq 技術在生物醫學領域產生了深遠的影響:發現新的細胞類型和標記基因、追蹤細胞譜系、分析細胞的異質性、揭示個體差異的因素,從而提出合適的個性化治療方案[38]。最后,它還有利于新藥的研發。scRNA-seq 可能會取代大量基因表達實驗,包括腎臟疾病。雖然在腎臟疾病領域應用較少,但是,隨著單細胞測序相關方法變得更精煉、廉價、高通量,以及在靈敏度、準確性、成本效益、處理時間和每個細胞可評估參數方面的改進[39],相信未來幾年該項技術在腎臟領域的基礎和臨床方面的研究將更加廣泛[40]。
利益沖突所有作者均聲明不存在利益沖突
作者貢獻聲明鄒皓珍、紀瑞:起草文章,指導;楊佳:對文章的知識性內容作批評性審閱,指導,支持性貢獻;席哲帆:分析/解釋數據,起草文章,指導;董華:對文章的知識性內容作批評性審閱,獲取研究經費,行政、技術或材料支持,指導,支持性貢獻

