綠原酸抗菌作用及機制的研究進展
李陽昱 李慶蓉 陳孝紅 薛麗 和平安 呂梅 楊旭


摘要:綠原酸是植物體在有氧呼吸過程中經莽草酸途徑合成的一種苯丙素類物質,自然存在于多種中藥材和食物中,杜仲、金銀花和咖啡等植物中含量較高,具有抗菌、抗炎、抗氧化、抗癌和免疫調節等多種藥理活性。近年來,綠原酸作為研究活性物質的焦點之一,因其抗菌譜廣,對多種細菌和真菌均有較好的抗菌活性,故綠原酸對臨床菌株的抗菌作用逐漸被重視和研究。本文綜述了近年來國內外關于綠原酸對多種致病菌的抗菌作用及機制的研究進展,旨在為綠原酸抗菌作用的深入研究提供參考,為臨床抗感染治療和控制帶來新思路,有助于綠原酸在醫藥領域的開發。
關鍵詞:綠原酸;活性多酚;抗菌作用;臨床耐藥菌;機制
中圖分類號:R966文獻標志碼:A
Advances in research on the antibacterial effects and mechanism of chlorogenic acid
Abstract Chlorogenic acid (CGA) is a phenylpropyl substance synthesized by shikimic acid pathway in plants during aerobic respiration. It naturally exists in a variety of Chinese medicinal materials and foods, with relatively high contents in Eucommia ulmoides, honeysuckle, coffee and other plants, which have various pharmacological activities such as antibacterial, anti-inflammatory, antioxidation, anticancer and immune regulation. In recent years, as one of the focal points of research on active substances, CGAs antibacterial effect on clinical strains has been gradually paid attention to and studied due to its wide antibacterial spectrum and good antibacterial activity against a variety of bacteria and fungi. This study summarized recent developments in research on the antibacterial action and mechanism of CGA against a variety of pathogenic bacteria both at home and abroad, aiming to provide a reference for further research on the antibacterial activity of CGA, bring new ideas for clinical anti-infection treatment and control, and contribute to the development of CGA in the field of medicine.
Key words Chlorogenic acid; Active polyphenol; Antibacterial effects; Clinical drug resistant bacteria; Mechanism
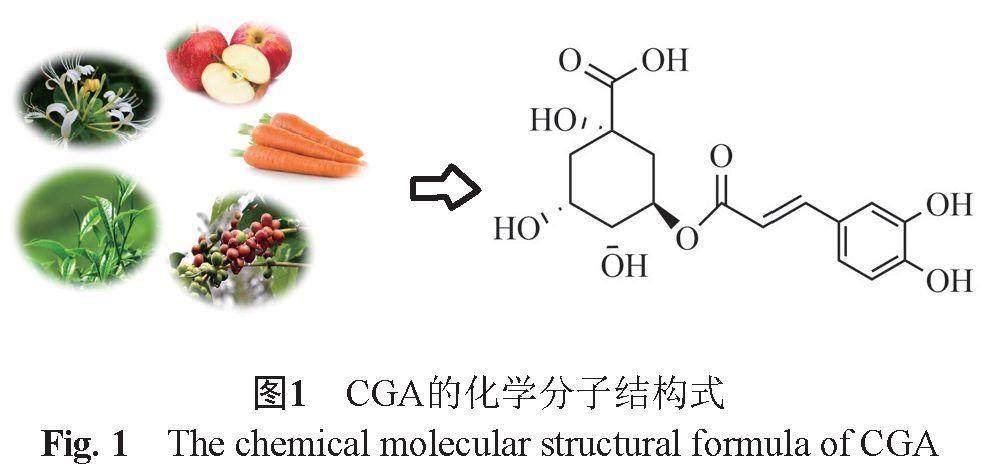
近年來,隨著長期抗生素的過度使用,臨床出現多重耐藥菌,常與高發病率和高死亡率密切相關。傳統抗生素有效性下降,新抗生素研發慢且細菌易獲得耐藥性,加大了臨床抗感染治療的難度,因此,迫切需要尋找潛在的抗生素替代藥物。綠原酸(chlorogenic acid, CGA) (圖1)是由咖啡酸和奎寧酸縮合而成的縮酚酸,又名咖啡鞣酸,是植物體在有氧呼吸過程中由肉桂酸和奎寧酸經莽草酸途徑合成的一種苯丙素類物質[1]。國內外的研究發現CGA具有抗菌、抗炎、抗氧化和免疫調節等多種藥理活
性[2-4]。CGA作為一種天然活性多酚,廣泛存在于各種植物中,在杜仲和金銀花中含量較為豐富,其他植物如咖啡、綠茶、蘋果和胡蘿卜中也有分布,廉價易得,副作用小。CGA抗菌譜廣且抗菌機制復雜多樣,對多種常見致病菌有較好的抗菌作用,但是關于CGA抗菌作用及機制的研究進展鮮有報道,本文綜述近年來國內外關于CGA抗菌作用及機制的研究進展,以期為臨床抗菌藥物的研發提供新思路。
1 CGA的抗菌作用
1897年科學家發現向日葵籽中含有一種物質,可以導致向日葵籽蛋白變黑;1909年經多次實驗證明了此化合物就是CGA;1947年Nelson和Rudkin通過研究首次確定CGA的化學結構,是一種由咖啡酸和奎寧酸形成的酯[5]。目前已有大量研究證明CGA對多種致病菌有廣譜抗菌活性,包括革蘭陰性菌,如大腸埃希菌、肺炎克雷伯菌、銅綠假單胞菌、鼠傷寒沙門菌、小腸結腸炎耶爾森菌、痢疾志賀菌、嗜麥芽窄食單胞菌,以及革蘭陽性菌,如金黃色葡萄球菌、枯草芽胞桿菌、化膿鏈球菌、肺炎鏈球菌
等[6-10],見表1。2005年,屈景年等[7]從金銀花中提取CGA后,通過平板法測定抑菌圈大小確定了CGA對大腸埃希菌和金黃色葡萄球菌有較好的抗菌活性,抑菌圈直徑與CGA濃度呈正相關,且抗金黃色葡萄球菌的活性較大腸埃希菌強。元超等[8]從艾納香中分離出CGA成分,通過微量稀釋法測定最低抑菌濃度(minimal inhibitory concentration,MIC)顯示,CGA對金黃色葡萄球菌和枯草芽孢桿菌有較強的抗菌活性,MIC值均為64 ?g/mL,優于大腸埃希菌(MIC>
128 ?g/mL)。Su等[9]研究了銅綠假單胞菌對CGA的敏感性,發現經CGA處理后,銅綠假單胞菌的脂多糖(lipopolysaccharide,LPS)含量降低,其內膜通透性增高,致使重要內容物被釋出,最終引起細菌死亡。CGA可通過誘導細胞內代謝失衡抑制枯草芽孢桿菌生長[11],影響化膿性鏈球菌中的脂質代謝和清除活性氧(reactive oxygen species, ROS)[12]。Primavilla等[13]還發現從藏紅花瓣中提取的CGA對產氣莢膜梭菌、肉毒梭菌和艱難梭菌有抗菌作用。
更為重要的是,已有研究證明CGA對多重耐藥菌也有抗菌作用。耐甲氧西林金黃色葡萄球菌、耐碳青霉烯類肺炎克雷伯菌、多重耐藥大腸埃希菌和多重耐藥銅綠假單胞菌是臨床常見的耐藥性致病菌,隨著細菌耐藥性日益嚴重,臨床可選擇的有效抗生素越來越少,而CGA抗耐藥菌活性的發現,為臨床尋找潛在的抗生素替代藥物帶來新思路。CGA的抗菌機制復雜多樣,首先,CGA直接靶向細胞壁和細胞膜,損傷細胞表面,增加細胞膜通透性,這是CGA對不同細菌的共同作用機制;其次,CGA抑制耐藥菌生物膜形成,一定濃度的CGA及其代謝產物可抑制耐甲氧西林金黃色葡萄球菌的生物膜形成并消除已成熟生物膜[14],調節耐碳青霉烯類肺炎克雷伯菌和多重耐藥銅綠假單胞菌的群體感應(quorum sensing,QS) 系統,降低胞外多糖和莢膜多糖(capsular polysaccharide,CPS )的產生,抑制其生物膜形成[15-16];最后,CGA靶向多重耐藥大腸埃希菌的外排泵并抑制其活性,下調耐藥性相關基因Tsr、Tar、CheA和CheW[17-18],此外也有CGA抗β-內酰胺酶活性的報道[19],這些研究表明CGA能遏制細菌耐藥性發展,進一步為臨床治療多重耐藥菌感染提供了新希望。以上研究還發現CGA可提高細菌對抗生素的敏感性,與抗生素聯合表現出協同抗菌作用,如在CGA治療多重耐藥大腸埃希菌引起的小鼠乳腺炎模型中,CGA聯合頭霉素C或者替米考星具有協同作用[20],CGA與左氧氟沙星協同抵抗多重耐藥銅綠假單胞菌[21],原因可能是CGA損傷細胞表面結構,破壞細胞完整性,促使足夠濃度的抗生素進入細胞發揮抗菌效應。此外,CGA還有抗真菌作用,并伴有一定的劑量效應[22]。綜上,CGA作為天然活性分子,抗菌活性強,可緩解細菌耐藥性,具有作為新型抗菌藥物的潛力,有很大的臨床開發應用價值。
2 CGA的抗菌機制
CGA的抗菌機制復雜多樣,一直是近年研究的熱點,已有大量研究證明了CGA對多種致病菌的抗菌機制,見圖2,據目前的研究結果主要總結為以下幾點。
2.1 抑制細菌生物膜形成
生物膜是細菌在相對惡劣的環境中形成的一種黏附在物體表面或氣-液交界面、以微菌落為基本單位的膜狀結構,由細菌及其自身分泌的代謝產物(胞外多糖、蛋白質、胞外DNA和脂質等)組成,常定植于醫療設備和植入物,細菌從浮游狀態轉變為生物膜狀態是一個受環境與遺傳因素高度調控的過程。生物膜形成后,為細菌提供營養和信息交流,可以逃避宿主免疫攻擊,使細菌難以被清除并長期持留在宿主內形成慢性感染灶,造成持續的炎癥和組織損傷;生物膜還會阻止抗生素進入細胞,使細菌衍生出較強的耐藥性,與浮游菌相比,生物膜保護的細菌對抗生素的耐藥性高出達1000倍[23]。CGA可通過多種途徑抑制生物膜形成,破壞其屏障作用,使足夠濃度的抗生素進入細胞內,具體機制如下。
2.1.1 下調生物膜形成相關基因的表達
細菌豐富的菌毛、CPS與LPS共同介導細菌與物體表面之間的相互作用,對維持生物膜結構穩定性和細胞間通訊至關重要。肺炎克雷伯菌生物膜形成較嚴重,其3型菌毛是一種由mrkABCDF操縱子編碼的蛋白質,促進細菌黏附于物體表面;treC基因通過調節CPS的產生在生物膜形成、初始黏附、表面定植和分散中發揮積極作用;wzm和wbbM是合成LPS的相關基因,有研究發現CGA通過下調mrkA、mrkD和wbbM基因的表達抑制生物膜形成[16],且CGA處理后的所有測試菌株在定量和主觀上都顯示出生物膜表面積的顯著減少,進一步證實了上述觀點[19]。此外,CPS的厚度能夠直接影響生物膜的成膜能力,CGA通過下調treC基因的表達抑制CPS合成[19],Wang等[16]最新的研究發現在1/2或1/4×MIC CGA處理后,透射電鏡下發現肺炎克雷伯菌的莢膜變薄,經掃描電鏡發現生物膜的網絡結構被破壞,菌落數量減少并出現分散,進一步說明CGA對生物膜有破壞作用。AgrA蛋白是耐甲氧西林金黃色葡萄球菌生物膜的關鍵蛋白,曾銘等[14]通過分子對接技術發現CGA的3種體內代謝物苯甲酸、對香豆酸和對羥基苯甲酸可以結合在AgrA蛋白表面,占據DNA與AgrA蛋白的結合位點,直接影響AgrA蛋白與DNA的識別,下調agrA基因,降低細菌致病性。
2.1.2 抑制QS系統
CGA還被認為是1種有效的QS抑制劑。QS系統,是細菌群體密度信號的感受系統,是單個細菌為應對外部環境,通過分泌自誘導信號分子相互溝通,協調和控制細菌群體中基因表達的信號和反應;還能響應種群密度的變化來調節生物學功能,以適應環境變化,QS系統在生物膜形成全程發揮作用[24]。Las,Rhl和Pqs是銅綠假單胞菌3種主要的QS系統, CGA通過與這3種QS受體LasR,RhlR和PqsR形成氫鍵,干擾信號分子與其受體結合,下調QS系統本身及相關基因表達,減少外膜囊泡和外排DNA的分泌來抑制生物膜形成[15,24]。有研究通過計算建模進一步驗證了CGA代謝產物奎寧酸可與RhlR、RhlA和RhlB結構上的芳香族氨基酸殘基形成5~10個氫鍵,與受體結構上的一個口袋擬合,可能因抑制QS信號通路而降低鼠李糖脂含量,減弱對生物膜的固定、擴散、“蘑菇帽”結構形成和通道開放作用。此外,六元環周圍存在大量芳香族氨基酸殘基,在一定程度上限制了奎寧酸的分子流動性,進一步增強了與3種蛋白質的結合親和力[21]。肺炎克雷伯菌QS系統中的AI-2信號分子在生物膜形成中起主要作用,其產生依賴于luxS基因,當 AI-2濃度達到閾值時,可觸發信號傳導的級聯反應,誘導CPS、LPS和菌毛等多種基因表達,啟動生物膜的形成,誘導生物膜成熟[25]。有學者篩選了CGA抗肺炎克雷伯菌QS的生物活性,發現luxS基因表達不受CGA影響,說明CGA對肺炎克雷伯菌生物膜形成的抑制與LuxS-QS系統無關,而是受其他途徑調控[19]。還有研究發現,盡管CGA下調了耐碳青霉烯類肺炎克雷伯菌株(FK8002)中luxS的表達水平,但沒有顯著差異[16],與上述觀點類似,這可能與菌株特性以及形成生物膜的能力有關系。CGA作為QS抑制劑的潛力已經被證明,但是不同的細菌CGA抗QS的活性不同。未來研究還應集中在CGA如何影響細菌生物膜空間結構,以阻止有害細菌的群體感應,促進有益細菌的群體感應。
2.1.3 抑制β內酰胺酶活性
生物膜形成與某些耐藥菌產生β-內酰胺酶之間存在很大相關性,有報告表明,產生超廣譜β-內酰胺酶(extended-spectrum β-lactamase, ESBLs)的肺炎克雷伯菌比不產ESBLs的菌株形成更嚴重的生物膜,且耐藥性更普遍[26]。β-內酰胺酶通過水解β-內酰胺類抗生素賦予細菌耐藥性,Rajasekharan等[19]進一步研究了CGA對β-內酰胺酶的抑制活性,分子對接結果顯示CGA與巰基-可變-1β-內酰胺酶的活性位點緊密結合,有效抑制β-內酰胺酶活性,進而影響生物膜形成。
由于細菌的持續存在,細菌生物膜很難根除,因此,有研究還同時評估了CGA去除成熟生物膜的能力,CGA對大多數細菌的成熟生物膜有明顯消除作用,并且呈劑量依賴性[14,27],但是CGA清除肺炎克雷伯菌生物膜的能力較差,這可能與生物膜中存在持久耐藥性有關。
2.2 增加細胞膜通透性,破壞細胞完整性
Lou等[6]系統闡明了CGA對革蘭陰性菌的抗菌作用機理,革蘭陰性菌外膜中的LPS和蛋白質通過與二價陽離子(如Mg2+等)的靜電作用維持在一起,而CGA表面負電荷通過靜電作用與LPS位點結合并螯合Mg2+,破壞外膜完整性,增加細胞膜通透性,使胞質內電解質、ATP及可溶性蛋白、核酸、酶等大分子泄漏,然后使細胞膜去極化,最終細胞因失去維持膜電位和代謝產物的能力而死亡。同樣的,Chen[27]和Zhan等[18]的研究結果表明CGA因分子極性強,對脂質等大分子物質親和力高,能與細菌表面結合并改變其外膜結構,從而增加膜通透性,使細胞內重要物質部分泄漏,進而干擾蛋白質合成;同時更容易使細胞外的有害物質進入,影響細胞結構的穩定性,使細胞逐漸死亡,這與一些抗生素在細胞膜形成孔隙直接殺死細菌的方式不同。然而,關于CGA與細胞膜的哪些成分結合,如何發揮作用以及結合是否影響其他細胞代謝等還尚未有研究報道。
此外,CGA誘導大量β-半乳糖苷酶合成并泄漏至胞外,間接說明CGA改變了細胞膜通透性[28]。Ren等[29]通過楊氏模量和細菌彈簧常數K發現CGA處理后的細菌因細胞壁硬度降低而易變形,可能是因為CGA對細胞膜有損傷,進而引起膜通透性增加,導致細胞質成分泄漏,致使細胞內膨脹壓力降低,細胞壁受到細胞膜的支撐減少,在外界壓力下容易發生變形。Su等[9]發現銅綠假單胞菌經CGA處理4~24 h后掃描電鏡發現細胞表面出現凹陷和空洞,推測CGA可能誘發了細胞表面損傷,而細胞外蛋白質含量增加、細胞內ATP水平急劇下降均說明了CGA增加細胞內膜的通透性,其后用熒光探針PI和cFDA 直接證明了上述結果。還發現CGA下調LPS合成相關基因LPxB和LPxC的表達,降低細胞外膜中LPS含量,可能通過擾亂LPS和磷脂之間的平衡,誘導外膜脫落,最終導致細胞死亡,這與Sun等[30]研究結果一致。最新關于沙門菌的研究進一步證實了CGA損害細菌的細胞完整性,細菌細胞表現出變形和萎縮,關于CGA如何損壞細胞表面,該學者證明了細胞膜損傷與ROS無關,用DPH熒光偏振檢測細胞膜流動性,發現CGA呈劑量依賴性方式誘導細胞膜流動性顯著增加,表明CGA誘導細胞表面損傷可能與膜流動性增加有關[31]。膜流動性對細胞膜滲透作用至關重要,膜流動性的突然變化會損害細胞膜的正常功能,而細胞膜脂質雙分子層中磷脂具有物種特異性甚至菌株特異性,CGA對膜脂質組成的影響以及CGA處理后LPS降低與膜流動性增強是否存在相關性可能是一個值得探究的機制。
2.3 擾亂細胞代謝
CGA是一種酚類化合物,是酚類酶催化最適宜的反應底物,它能影響相關代謝酶的活性,降低物質和能量代謝水平,使代謝過程受阻,從而抑制細菌活性。三羧酸循環是3大營養物質(蛋白質,糖類,脂質)提供和轉換能量的最終代謝途徑,其產生的乙酰輔酶A是三羧酸循環的關鍵物質。有研究發現CGA等酚酸類物質影響大腸埃希菌的代謝水平,下調脂肪酸β氧化、苯丙氨酸和賴氨酸代謝途徑中的關鍵酶,阻礙乙酰輔酶A合成導致三羧酸循環受抑制,進而中斷細菌的物質轉化和能量代謝[18]。CGA還抑制蘋果酸脫氫酶和琥珀酸脫氫酶的活性,這是三羧酸循環和電子傳遞鏈中的2種主要代謝酶,最終因抑制了細胞存活的能量代謝導致細胞死亡[30]。在CGA對枯草芽孢桿菌抗菌活性的研究中,發現CGA誘導細胞內ATP含量降低,這可能與CGA影響細胞代謝有關,進一步代謝組學研究表明,CGA誘導細胞內三羧酸循環和糖酵解代謝失衡,導致細菌代謝紊亂,主要表現為CGA顯著降低三羧酸循環中檸檬酸、異檸檬酸和琥珀酸水平,以及糖酵解途徑中的葡萄糖6-磷酸和果糖1,6-二磷酸[11]。以上研究均表明CGA可以通過擾亂細胞代謝發揮抗菌作用。
2.4 調控信號轉導通路
有學者驗證了CGA通過上調lncRNA GAS5/miR-23a/PTEN軸調節p38 MAPK通路,促進自噬并抑制鼠傷寒沙門菌感染,調節腸道炎癥因子平衡和減少腸道損傷[32]。同樣的,CGA通過抑制NLRP3炎癥小體活化,上調miR-124-3p表達并滅活p38MAPK途徑來下調肺炎克雷伯菌感染的炎癥水平,進一步說明了CGA對細菌感染的保護作用[33]。此外,與常見的由ROS積累引起細菌凋亡的機制相反,由于CGA具有較強的抗氧化活性,可通過消耗細胞內ROS來影響細胞代謝的信號通路,誘導細菌凋亡[34]。適當水平的ROS在體內穩態和細胞內信號傳導中發揮重要作用,ROS耗竭或過量積累時細胞內氧化還原平衡被打破,影響細胞內的信號通路,導致細胞功能障礙。
2.5 CGA的其他抗菌機制
最新研究報道,CGA可能作為一種活躍的外排泵抑制劑,AcrB是來自大腸埃希菌AcrAB-TolC藥物轉運復合物的膜蛋白,是評估外排泵抑制劑特征化合物的優秀模型系統,分子對接技術結合分子動力學模擬分析發現,CGA通過氫鍵與AcrB高親和力結合,形成穩定的復合物來抑制外排泵表達,最大限度減少耐藥性;CGA還可能作為一種能量抑制劑,通過瞬時耗散膜電位抑制外排活動,干擾維持外排泵功能所需的能量來抑制細菌外排泵系統[17]。CGA還可能下調多重耐藥大腸埃希菌的耐藥相關蛋白(Tsr、Tar、CheA和CheW)、外膜孔蛋白F(OmpF)和鞭毛蛋白(FliC),誘導細菌鞭毛脫落[18],抑制鞭毛合成,減少鞭毛數量,使細菌形態變得更加光滑,降低細菌群集能力、生物膜穩定性和細胞壁硬度[29]。SrtA是一種“管家”分選酶,介導多達19種表面蛋白與細胞壁的共價附著,對金黃色葡萄球菌定植和感染非常重要,Wang等[35]通過體內外實驗證明了CGA能明顯抑制SrtA的催化活性,CGA通過氫鍵和疏水作用力與SrtA中C184和G192位點結合,阻止表面蛋白的分選信號進入,有效抑制SrtA轉肽,降低細菌毒力,促進細菌清除,而不會施加明顯的耐藥選擇性壓力,這表明CGA可作為SrtA抑制劑阻斷其活性來破壞細胞表面蛋白質發揮抗菌作用。神經氨酸酶是肺炎鏈球菌的關鍵毒力因子之一,可以去除宿主細胞表面聚糖中的唾液酸,暴露出某些受體,促進細菌黏附和定植,Guan等[36]研究CGA對肺炎鏈球菌神經氨酸酶的抑制作用顯示,CGA通過氫鍵,鹽橋和陽離子-π相互作用與A型神經氨酸酶活性位點Arg347強力結合并形成帽狀結構,抑制其活性,降低細菌毒力。此外,有研究證明CGA促進小鼠肺泡巨噬細胞從MI型極化為M2型來緩解肺炎克雷伯菌誘導的炎癥,明顯提高小鼠生存率[37]。肺泡巨噬細胞是構成關鍵的免疫效應因子之一,肺炎克雷伯菌小鼠肺炎模型表明,耗竭肺泡巨噬細胞會加劇肺部感染[38],而臨床上細菌感染的原因很大程度與患者免疫功能低下有關,因此,CGA可能具有通過調節宿主天然免疫功能增強抵抗細菌感染的潛力,但是關于CGA對宿主免疫功能的調節與抗菌作用的關系及具體機制還有待深入研究。
除了抗細菌作用,CGA還具有抗真菌活性,Martíne等[39]在2017年報道了CGA通過抑制真菌孢子的早期透膜化來控制不同植物病原真菌的生長,具有生物殺真菌劑的潛力。近年來學者更多關注CGA對唑類耐藥白念珠菌的抗菌作用及機制,ALS3是白念珠菌發病機制中與黏附和生物膜形成相關的重要蛋白質,CGA與氟康唑耐藥白念珠菌的ALS3活性位點殘基相互作用,抑制其生物活性發揮抗生物膜作用[22]。CGA可誘導K+流出而促進白念珠菌細胞凋亡,其機制可能為K+外流導致細胞體積調節功能失調,不能滿足細胞周期檢查點要求而誘導 G2/M細胞周期停滯,從而導致細胞凋亡[40]。CGA的抗菌作用主要取決于其濃度,CGA抑制白念珠菌的MIC為
80 ?g/mL,雖然兩性霉素B(MIC值為10 ?g/mL)抗白念珠菌活性比CGA強,但兩性霉素 B 有較強的人紅細胞溶血活性而CGA沒有,并且還證明了40 ?g/mL的CGA能破壞菌絲和假菌絲,從而抑制白念珠菌的生長[41]。
3 CGA開發及應用前景
CGA是許多中藥材、水果和蔬菜的主要活性成分,如杜仲、金銀花、向日葵、咖啡、蘋果、胡蘿卜、大豆和馬鈴薯等含量較高[1]。目前,已報道的用于CGA提取、分離和定量的制備方法包括水提法、有機溶劑提取法、酶解法、超臨界流體萃取法、微波輔助提取、紅外輔助提取、超高壓萃取、超聲輔助提取,以及逆流色譜,離心分配色譜,分子印跡聚合物和雙水相系統等。此外,還開發了NKA-9樹脂、 X-5樹脂和聚酰胺樹脂技術[42]。CGA的半水合物為白色或黃色針狀結晶體,在110 ℃狀態下會轉變成無水物,其在25 ℃水中的溶解度約4% ,易溶于極性溶劑如乙醇、 丙酮和甲醇,微溶于乙酸乙酯,難溶于氯仿、乙醚和苯等親脂性有機溶劑。CGA為極性有機酸,不太穩定,在提取過程中易發生異構化。隨著CGA的研究深入和制備技術的更新發展,極大提高了CGA的提取率和穩定性,這將有助于更好地利用各種植物來源的CGA,進而提高制藥行業中的潛在價值。
目前臨床抗致病菌感染以抗生素治療為主,但是細菌耐藥情況日益嚴重。CGA作為一種抗菌活性良好的綠色天然多酚,抗菌譜廣且不易耐藥。目前已有很多研究報道CGA通過納米復合技術、微膠囊化、納米包封和納米乳液優化其生物活性和生物利用度,從而提高CGA的穩定性和抗菌活性[43]。用CGA代替化學試劑合成抗菌功能的納米材料,克服了CGA水溶性低,很容易被體內的蛋白質滅活而影響藥物吸收和利用的局限,還能使CGA以足夠的濃度在細菌內積累,有效發揮抗菌作用,且細胞毒性小。將CGA負載到分散性好、高水溶性和良好生物相容性的納米粒子或纖維上,表現出很強的抑菌作用和有效的生物活性,可以協同破壞細菌細胞壁和細胞膜并抑制細菌生長,可能與CGA被釋放后穿過細胞膜進入細胞內,誘導ROS增加有關[44-45]。經評估發現CGA沒有明顯的體內毒性,不會造成內臟器官損傷,這種修飾大大提高了CGA的水溶性和穩定性,保護CGA不被蛋白質滅活,并且提高其抗菌活性,目前已有應用于腫瘤靶向治療的研究[46]。負載CGA的納米顆粒還可以延長CGA的釋放時間,減輕小鼠牙周炎的骨質流失,并顯示出良好的生物相容性和生物安全性[47]。此外,含CGA的復合海藻酸鈉水凝膠/杜仲橡膠膜作為新型抗菌傷口敷料已有研究報道,體外對大腸埃希菌和金黃色葡萄球菌具有抵抗作用,且可加速傷口愈合[48]。李肖寒等[49]研究發現利用水溶性天然高分子材料透明質酸(hyaluronic acid,HA)與CGA形成的水溶性綴合物HA-CGA較CGA單體有較強的抗菌活性,大大提高CGA的水溶性和生物利用度,改善抗菌性能。盡管CGA在人類的利用、代謝和排泄方面存在較大的個體差異,這可能與劑量、模型、細胞類型、個體差異以及腸道微生物群等因素有關,但是許多基礎研究和臨床研究已證明CGA是一種抗菌活性好的天然化合物。
CGA可聯合抗生素發揮協同抗菌作用。有研究報道CGA聯合左氧氟沙星協同抑制生物膜形成,其抗菌效果比單獨使用更為顯著[50]。CGA破壞生物膜基質中胞外多糖的結構,使左氧氟沙星滲透到細菌生物膜的內層,影響細菌生物膜形成的多種途徑和靶點,包括通過靜電干擾細菌和/或糖萼對基質的黏附;激活或釋放相關胞外蛋白酶以破壞胞外多糖;抑制細菌核酸的合成,減少細胞外DNA的量;以及細菌生長固定期的殺菌作用[21]。有溴化乙錠積累和棋盤協同作用的測定結果表明,CGA聯合四環素對大腸埃希菌具有良好的協同作用,其FIC指數為0.25,這種協同作用直接將抗生素劑量減少了128倍[17],一般抗生素無法穿透革蘭陰性菌完整的外膜,但當CGA破壞細菌外膜完整性后,使細胞膜通透性增加,使足夠濃度的抗生素能夠穿透受損的外膜進入細胞內,發揮效應。同樣地,CGA和唑類抗生素都對膜滲透性起作用,可協同抵抗白念珠菌,提高抗菌活性。因此,CGA聯合抗生素使用可以提高多重耐藥菌對抗生素的敏感性,使其最大程度殺滅細菌,減少耐藥性的產生,這表明CGA可能作為一種增強劑聯合抗生素協同抗菌。
4 小結與展望
4.1 小結
臨床上多重耐藥菌的出現和廣泛傳播是感染患者死亡的主要原因,尋找新型抗菌藥是研究的重點。近年來,越來越多的學者開始關注和研究CGA對臨床菌株和多重耐藥菌株的抗菌作用及機制,主要包括抑制細菌生物膜形成、增加細胞膜通透性和破壞細胞完整性、擾亂細胞代謝及調控信號轉導通路等,而抗菌效果與CGA及其化合物濃度、處理時間和細菌耐藥性等直接相關。已有大量研究表明CGA聯合抗生素或者負載抗菌納米材料可以提高其生物活性和抗生素敏感性,最大限度地減少藥物毒性,限制耐藥性。加之CGA對細菌的選擇性壓力小,可以克服抗生素易產生耐藥性的缺點,更加堅定了CGA可作為一種安全的抗菌藥物或佐劑治療和控制微生物感染,具有很高的臨床應用價值。
4.2 展望
CGA是一種分布廣泛、抗菌活性好的天然化合物,主要來源于植物。而我國擁有豐富的CGA植物資源如金銀花、杜仲和向日葵等,但對其利用效率遠落后于發達國家,且CGA的口服生物利用度低,靜脈注射可能產生過敏反應。因此,對CGA的生物利用度、抗菌作用機制、毒理學和臨床研究等方面仍有待深入探索和完善。對于未來的研究應主要從以下兩方面入手:一方面,應該把握優勢,合理利用豐富資源,發展CGA的提取純化技術,提高提取物功效,增加其穩定性,促進藥物的研發;另一方面,加大CGA對臨床菌株的抗菌作用研究,開發體外和體內模型系統,對CGA進行更多臨床藥理和安全性評估,同時進行更多宿主免疫學研究,以確定CGA在動物和人類中的最大有效和安全劑量,深入研究CGA及其代謝產物的抗菌機制。
參 考 文 獻
王慶華, 杜婷婷, 張智慧, 等. 綠原酸的藥理作用及機制研究進展[J]. 藥學學報, 2020, 55(10): 2273-2280.
Naveed M, Hejazi V, Abbas M, et al. Chlorogenic acid (CGA): A pharmacological review and call for further research[J]. Biomed Pharmacother, 2018, 97: 67-74.
Bagdas D, Gul Z, Meade J A, et al. Pharmacologic overview of chlorogenic acid and its metabolites in chronic pain and inflammation[J]. Curr Neuropharmacol, 2020, 18(3): 216-228.
Lee T K, Kang I J, Kim B, et al. Experimental pretreatment with chlorogenic acid prevents transient ischemia-induced cognitive decline and neuronal damage in the hippocampus through anti-oxidative and anti-inflammatory effects[J]. Mole, 2020, 25(16): 3578
王玲娜, 姚佳歡, 馬超美. 綠原酸的研究進展[J]. 食品與生物技術學報, 2017, 36(11): 1121-1130.
Lou Z X, Wang H X, Zhu S, et al. Antibacterial activity and mechanism of action of chlorogenic acid[J]. J Food Sci, 2011, 76(6): M398-403.
屈景年, 莫運春, 劉夢琴, 等. 金銀花中綠原酸一步提取法及綠原酸抗菌活性[J]. 化學世界, 2005(3): 167-169.
元超, 王鴻發, 胡璇, 等. 艾納香中綠原酸類化學成分研究 [J]. 熱帶作物學報, 2019, 40(6): 1176-1180.
Su M, Liu F, Luo Z, et al. The antibacterial activity and mechanism of chlorogenic acid against foodborne pathogen Pseudomonas aeruginosa[J]. Foodborne Pathog Dis, 2019, 16(12): 823-830.
Miao M S, Xiang L L. Pharmacological action and potential targets of chlorogenic acid[J]. Adv Pharmacol, 2020, 87: 71-88.
Wu Y, Liang S, Zhang M, et al. The effect of chlorogenic acid on Bacillus subtilis based on metabolomics[J]. Mole, 2020, 25(18): 4038.
Le Y J, He L Y, Li S, et al. Chlorogenic acid exerts antibacterial effects by affecting lipid metabolism and scavenging ROS in Streptococcus pyogenes[J]. FEMS Microbi Let, 2022, 369(1): 1-8.
Primavilla S, Pagano C, Roila A R, et al. Antibacterial activity of Crocus sativus L. petals extracts against foodborne pathogenic and spoilage microorganisms, with a special focus on clostridia[J]. Life (Basel), 2022, 13(1): 60.
曾銘, 魯蘭, 樊榮, 等. 綠原酸體內代謝產物抗金黃色葡萄球菌生物被膜作用及機制研究[J]. 中藥藥理與臨床, 2021, 37(3): 34-41.
Xu W Y, Zhang X C, Wang L B, et al. Effect of chlorogenic acid on the quorum-sensing system of clinically isolated multidrug-resistant Pseudomonas aeruginosa[J]. J App Microbi, 2021, 132(2): 1008-1017.
Wang L B, Zhang Y, Liu Y, et al. Effects of chlorogenic acid on antimicrobial, antivirulence, and anti-quorum sensing of carbapenem-resistant Klebsiella pneumoniae[J]. Front Microbi, 2022, 13: 997310.
Samreen Q F A, Ahmad I. In silico screening and in vitro validation of phytocompounds as multidrug efflux pump inhibitor against E. coli[J]. J Biomol Struct Dyn, 2023, 41(6): 2189-2201.
Zhang G Y, Yang Y Q, Memon F U, et al. A natural antimicrobial agent: Analysis of antibacterial effect and mechanism of compound phenolic acid on Escherichia coli based on tandem mass tag proteomics[J]. Fronti Microbi 2021, 12: 738896.
Rajasekharan S K, Ramesh S, Satish A S, et al. Antibiofilm and anti-beta-Lactamase activities of burdock root extract and chlorogenic acid against Klebsiella pneumoniae[J]. J Microbiol Biotechnol, 2017, 27(3): 542-551.
Feng S Y, Zhang Y H, Fu S D, et al. Application of chlorogenic acid as a substitute for antibiotics in multidrug-resistant Escherichia coli-induced mastitis[J]. Inter Immuno, 2023, 114: 109536.
Lu L, Zhao Y, Yi G, et al. Quinic acid: A potential antibiofilm agent against clinical resistant Pseudomonas aeruginosa[J]. Chinese Med, 2021, 16(1): 72.
Rocha D A, Silva C, Sa L, et al. Evaluation of the antifungal effect of chlorogenic acid against strains of Candida spp. resistant to fluconazole: Apoptosis induction and in silico analysis of the possible mechanisms of action[J]. J Med Microbiol, 2022, 71(5): 1-17.
Sharma D, Misba L, Khan A U. Antibiotics versus biofilm: An emerging battleground in microbial communities[J]. Antimicr Resist Infect, 2019, 8: 76.
Wang H, Chu W H, Ye C, et al. Chlorogenic acid attenuates virulence factors and pathogenicity of Pseudomonas aeruginosa by regulating quorum sensing[J]. App Microbi Biotech, 2018, 103(2): 903-915.
賈雯, 郭瑞林. 肺炎克雷伯菌生物膜形成及調控機制的研究進展 [J]. 中國醫學科學院學報, 2021, 43(6): 936-944.
Dan B Z, Dai H P, Zhou D G, et al. Relationship between drug resistance characteristics and biofilm formation in Klebsiella pneumoniae strains[J]. Infect Drug Resist , 2023, 16: 985-998.
Chen K, Peng C, Chi F, et al. Antibacterial and antibiofilm activities of chlorogenic acid against Yersinia enterocolitica[J]. Front Microbiol, 2022, 13: 885092.
羅藝晨, 黃利明, 楊穎, 等. 綠原酸抑制金黃色葡萄球菌機理研究[J]. 西南大學學報(自然科學版), 2016, 38(3): 15-19.
Ren S, Wu M, Guo J, et al. Sterilization of polydimethylsiloxane surface with Chinese herb extract: A new antibiotic mechanism of chlorogenic acid[J]. Sci Rep, 2015, 5: 10464.
Sun Z L, Zhang X X, Wu H H, et al. Antibacterial activity and action mode of chlorogenic acid against Salmonella enteritidis, a foodborne pathogen in chilled fresh chicken[J]. World J Microbi? Biotech, 2020, 36(2): 24.
Yang L, Zhang C L, Su Z J, et al. Inactivation of Salmonella typhimurium SL1344 by chlorogenic acid and the impairment of cellular integrity[J]. Front Microbi, 2022, 13: 887950.
Tan S, Yan F, Li Q, et al. Chlorogenic acid promotes autophagy and alleviates Salmonella typhimurium infection through the lncRNAGAS5/miR-23a/PTEN axis and the p38 MAPK pathway[J]. Front Cell Dev Biol, 2020, 8: 552020.
Zhang Y Z, Zhu C Y, Zhao H J, et al. Anti-inflammatory effect of chlorogenic acid in Klebsiella pneumoniae-induced pneumonia by inactivating the p38MAPK pathway[J]. Inter J Med Microbi, 2023, 313(2): 151576.
Lee B, Lee D G. Depletion of reactive oxygen species induced by chlorogenic acid triggers apoptosis-like death in Escherichia coli[J]. Free Radic Res, 2018, 52(5): 605-615.
Wang L, Bi C, Cai H, et al. The therapeutic effect of chlorogenic acid against Staphylococcus aureus infection through sortase A inhibition[J]. Front Microbiol, 2015, 6: 1031.
Guan S S, Zhu K T, Dong Y J, et al. Exploration of binding mechanism of a potential Streptococcus pneumoniae neuraminidase inhibitor from herbaceous plants by molecular simulation[J]. Interna J Mole Sci, 2020, 21(3): 1003.
Li Q R, Tan S R, Yang L, et al. Mechanism of chlorogenic acid in alveolar macrophage polarization in Klebsiella pneumoniae-induced pneumonia[J]. J Leukoc Biol, 2021, 112(1): 9-21.
Liu D, Chen Z, Yuan Y, et al. Innate immune effectors play essential roles in acute respiratory infection caused by Klebsiella pneumoniae[J]. J Immunol Res, 2020: 5291714.
Martinez G, Regente M, Jacobi S, et al. Chlorogenic acid is a fungicide active against phytopathogenic fungi[J]. Pestic Biochem Physiol, 2017, 140: 30-35.
Yun J E, Lee D G. Role of potassium channels in chlorogenic acid-induced apoptotic volume decrease and cell cycle arrest in Candida albicans[J]. Biochimica et Biophysica Acta (BBA) - General Subjects, 2017, 1861(3): 585-592.
Sung W S, Lee D G. Antifungal action of chlorogenic acid against pathogenic fungi, mediated by membrane disruption[J]. Pure? Appl Chem, 2010, 82(1): 219-226.
Lu H, Tian Z, Cui Y, et al. Chlorogenic acid: A comprehensive review of the dietary sources, processing effects, bioavailability, beneficial properties, mechanisms of action, and future directions [J]. Compr Rev Food Sci Food Saf, 2020, 19(6): 3130-3158.
Feitosa B F, De Alc?ntara C M, De Lima A B S, et al. Bioactive natural products for chemical control of microorganisms: Scientific prospecting (2001–2021) and systematic review[J]. Molecules, 2022, 27(18): 5917.
Wang Z, Zhai X, Sun Y, et al. Antibacterial activity of chlorogenic acid-loaded SiO2 nanoparticles caused by accumulation of reactive oxygen species[J]. Nanotechnology, 2020, 31(18): 185101.
Mei L, Ren Y, Gu Y, et al. Strengthened and thermally resistant poly(lactic acid)-based composite nanofibers prepared via easy stereocomplexation with antibacterial effects[J]. ACS Appl Mater Interfaces, 2018, 10(49): 42992-43002.
Shahabadi N, Akbari A, Karampour F, et al. In vitro cytotoxicity, antibacterial activity and HSA and ct-DNA interaction studies of chlorogenic acid loaded on gamma-Fe2O3@SiO2 as new nanoparticles[J]. J Biomol Struct Dyn, 2022: 1-21.
Li H, Xu J, Hu J F, et al. Sustained release of chlorogenic acid-loaded nanomicelles alleviates bone loss in mouse periodontitis[J]. Biomater Sci, 2022, 10(19): 5583-5595.
Guo C F, Zhou Z Y, Zhang S Q, et al. Sulfonated, quaternized, and chlorogenic acid composited sodium alginate hydrogels/Eucommia ulmoides rubber films as in vitro antibacterial wound dressings for accelerating wound healing[J]. Industrial Crops? Products, 2022, 190: 115885.
李肖寒, 程雪丹, 張智博, 等. 綠原酸綴合物HA-CGA的抗菌活性研究[J]. 中國抗生素雜志, 2023, 48(1): 49-53.
Tan S R, Gao J, Li Q R, et al. Synergistic effect of chlorogenic acid and levofloxacin against Klebsiella pneumonia infection in vitro and in vivo[J]. Sci Rep, 2020, 10(1): 20013.

