實時熒光PCR 檢測鼠源性成分的定性方法驗證
◎ 張從黨,王均華,王亞平,張維益,包靜云
(江陰市食品安全檢測中心,江蘇 無錫 214400)
隨著生活質量的不斷提升,人們對優質肉類及產品的需求逐年上升。然而,僅通過肉眼觀察難以分辨各類肉質的好壞[1-2],一些經營者為牟取暴利,采取摻雜低廉肉品、注膠注水等手段,嚴重影響了食品安全[3-5]。鼠肉價格低廉,通常是不法商家的首選。然而,鼠肉攜帶多種病菌,含鉛、砷等有毒有害物質較高,食用后會對人類健康造成嚴重危害,并增加疫病傳播風險[5]。因此,對肉類及其制品中鼠源性成分的檢測,是保障食品安全的重要環節[6]。對于鼠源性成分的檢測方法,目前國內標準主要有GB/T 38164—2019《常見畜禽動物源性成分檢測方法 實時熒光PCR 法》和BJS 201904 《食品中多種動物源性成分檢測實時熒光PCR 法》[7-8]。
本研究旨在驗證GB/T 38164—2019《常見畜禽動物源性成分檢測方法 實時熒光PCR 法》在肉類食品中鼠源性成分檢測上的適用性,并將其與其他鼠源成分PCR 鑒定方法進行對比,以提供肉類摻假鑒別的方法依據和技術支撐。
1 材料與方法
1.1 實驗材料
本次實驗所用鼠DNA 樣品分別來自:1 號鼠DNA樣品由中國檢驗檢疫科學研究院饋贈(褐家鼠);2 號鼠DNA 樣品由南京市食品藥品監督檢驗院饋贈(Balb/c 小鼠)。小家鼠新鮮組織樣本由本實驗采購。
1.2 儀器與試劑
①儀器:熒光定量PCR 儀(CFX-96,BIORAD,美國),紫外分光光度計(SHIMADZU) ;Dneasy mericon 食物核酸提取試劑盒(QIAGEN,德國)。②試劑:鼠種特異性基因測定試劑盒(熒光 PCR 法,北京良潤);TaKaRa Taqman Real Time PCR 預混液(日本TAKARA 公司);引物與熒光探針均由南京金斯瑞生物科技公司完成。
1.3 樣本處理及總 DNA 提取
生鮮肉組織用滅菌水進行簡單沖洗,稱取適量樣品,并使用組織研磨儀進行研磨。采用離心柱型Dneasy mericon 食物核酸提取試劑盒,按照說明書操作,提取200 mg 肉制品中的總DNA,并命名為3 號鼠。
1.4 引物和探針
分別依據標準GB/T 38164—2019《常見畜禽動物源性成分檢測方法 實時熒光PCR法》、BJS 201904《食品中多種動物源性成分檢測實時熒光PCR 法》合成鼠成分熒光PCR 檢測相應的引物及探針,序列見表1。
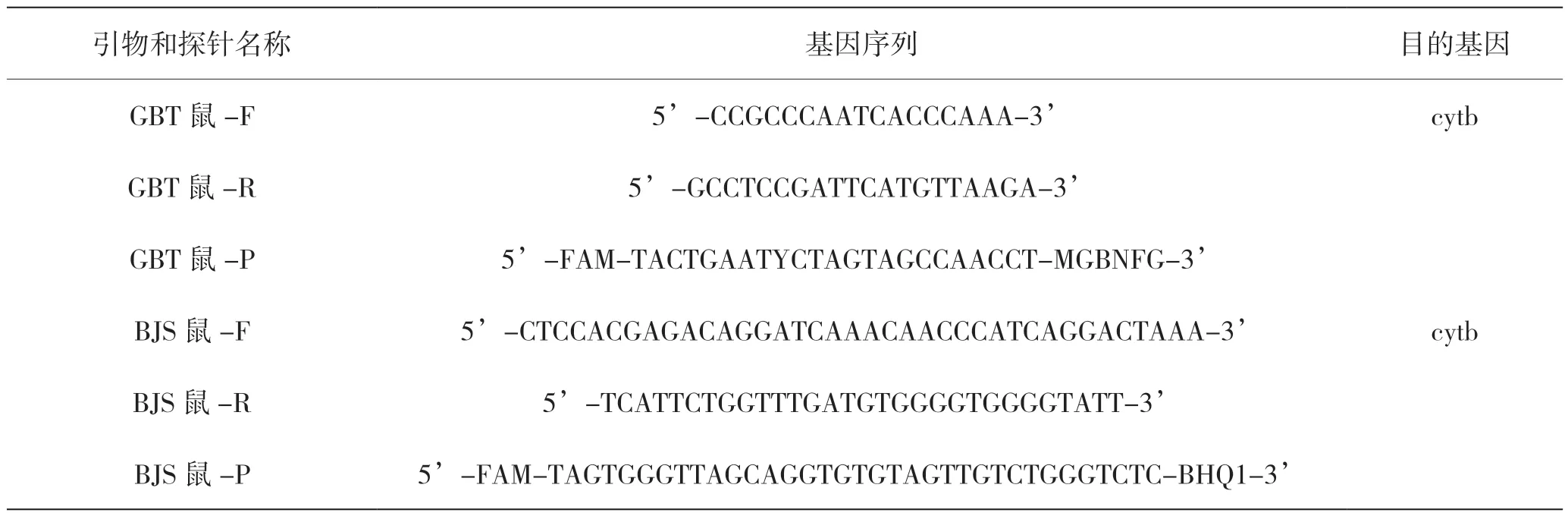
表1 引物探針序列表
1.5 有效性實驗
根據GB/T 38164—2019 的實驗方法,以3 號鼠的DNA 為模板,使用GBT 引物和探針進行PCR 擴增,以評價國標方法的有效性。PCR 反應體系如下:DNA模板2 μL(濃度為50 ng·μL-1),引物GBT 鼠-F/GBT 鼠-R 和 探針GBT 鼠-P 各1 μL,2×Premix Ex Taq 12.5 μL,滅菌雙蒸水補足至25 μL。PCR 擴增條件分別為:95 ℃、30 s;95 ℃、5s;62 ℃、40 s,共40 個循環,在62 ℃時,采集熒光信號。
1.6 對比實驗
根據BJS 201904《食品中多種動物源性成分檢測實時熒光PCR 法》,以及鼠種特異性實時熒光PCR 檢測試劑盒的實驗方法,以3 號鼠DNA 為模板,進行相應的熒光PCR 擴增。通過對比2 種方法的擴增曲線和Ct 值,評估GB/T 38164—2019 方法的特異性。BJS 201904 方法使用BJS 引物和探針進行PCR 擴增,除了反應退火溫度和時間外,PCR 反應體系和擴增條件與步驟1.6 相同。試劑盒的熒光PCR 反應體系及擴增條件,按照試劑盒說明書進行操作。
1.7 溫度梯度實驗
根據GB/T 38164—2019 實驗方法,以3 號鼠DNA為模板進行實驗。為了分析不同退火溫度對實驗結果的影響,本研究設置了6 種不同的退火溫度。除了退火溫度不同外,PCR 反應體系和擴增條件與步驟1.6相同。
1.8 適用性評估實驗
根據GB/T 38164—2019 實驗方法,分別以1 號鼠、2 號鼠和3 號鼠的DNA 為模板,使用GBT 引物和探針進行PCR 擴增,以評估國標方法在檢測不同鼠源性成分上的局限性。PCR 反應體系和擴增條件與步驟1.6相同。
2 結果與分析
2.1 有效性實驗結果
根據GB/T 38164—2019 的實驗方法,以3 號鼠的DNA 為模板,使用GBT 引物和探針進行PCR 擴增,擴增結果見圖1。從結果可知,GBT 引物和探針對目標基因無明顯的特異性擴增曲線,說明GB/T 38164—2019 標準中的引物探針不具有良好的物種特異性,不適用于小鼠物種的鑒別。
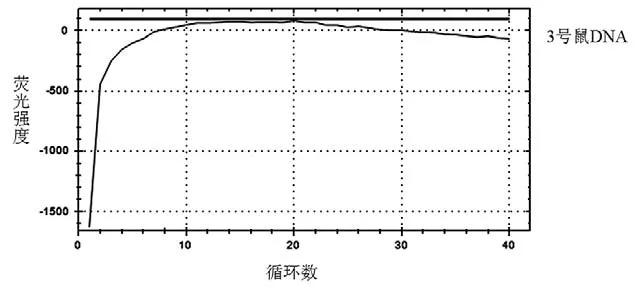
圖1 3 號鼠成分擴增曲線圖
2.2 對比實驗結果
分別用BJS 引物和探針及商品化的鼠源特異性PCR 試劑盒對3 號鼠DNA 進行熒光PCR 擴增反應,擴增結果見圖2、圖3。結果顯示,BJS 引物和探針以及商業化的試劑盒,均出現了特異性的擴增曲線,進一步確認了實驗室自提的3 號鼠樣本中存在鼠成分。由此說明,GB/T 38164—2019 標準中的鼠引物及探針,不具有良好的物種特異性,不適用于小鼠物種的鑒別。
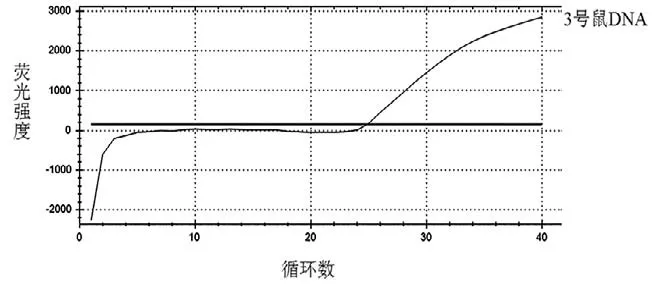
圖2 BJS 201904 方法檢測3 號鼠熒光PCR 的擴增曲線圖

圖3 商品化試劑盒檢測3 號鼠熒光PCR 的擴增曲線圖
2.3 溫度梯度實驗結果
根據GB/T 38164—2019 標準的實驗方法設置6 種退火溫度,分別為54、56、58、60、62、64 ℃,進行熒光PCR 擴增反應,擴增結果見圖4。從結果可知,退火溫度在54、56、58 ℃時,均有出現擴增曲線,高于58 ℃以后,就沒有明顯的擴增曲線。盡管如此,根據GB/T 38164—2019 標準要求,鼠的熒光PCR 退火溫度應為62 ℃。

圖4 不同退火溫度對PCR 結果的影響圖
2.4 適用性評估實驗
采用GBT 引物和探針,根據GB/T 38164—2019 標準規定的鼠退火溫度,對1 號鼠、2 號鼠和3 號鼠的DNA 進行熒光PCR 擴增反應,擴增結果如圖5 所示。分析結果表明,僅有1 號鼠表現出特異性擴增曲線,2 號鼠和3 號鼠的DNA 未出現特異性擴增曲線,說明GB/T 38164—2019 標準中的鼠引物探針不具有良好的物種特異性,僅對大鼠有特異性擴增,不適用于小鼠物種的鑒別。
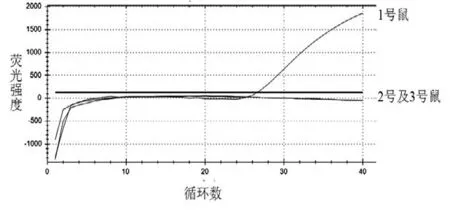
圖5 不同鼠源性樣本的熒光PCR 結果圖
3 結論
本研究旨在驗證GB/T 38164—2019《常見畜禽動物源性成分檢測方法 實時熒光PCR 法》,并評估其在肉類食品鼠源性成分檢測中的適用性。通過對不同來源的鼠樣品進行實時熒光PCR 檢測,并結合其他實驗方法,本研究證實了該方法能夠準確檢測肉類食品中的大鼠成分。但驗證結果亦表明,該方法在檢測不同鼠源性成分上存在局限性,僅能檢測大鼠成分,不適用小鼠成分的檢測,從而限制了其通用性。
此外,本研究也存在一定局限性。例如,鼠類樣本種類較少,未涉及豚鼠、竹鼠、海貍鼠等常見鼠類動物的驗證。因此,為提高鼠類成分實時熒光PCR 檢測方法的通用性,未來的研究應進一步擴大樣本量,分析不同鼠類間的基因多態性差異,設計適用于鼠類的通用引物和探針,并優化反應條件,以同時覆蓋其他常見鼠類品種的熒光PCR 檢測。
總之,本研究為相關檢測機構提供了驗證方法的借鑒,并為肉類食品中鼠源性成分的熒光PCR 檢測提供了有益參考。未來,隨著實驗方法的不斷完善和優化,實時熒光PCR 技術將在肉類食品中鼠源性成分檢測方面展現更加廣闊的應用前景。

