基于術前LCR及PNI的結直腸癌根治術后感染性并發癥預測模型的構建與評價
田 園 汪貫龍 李 瑞 徐 凱 李紅霞 何 磊
目前結直腸癌最主要的治療方法是外科手術,結直腸癌手術的特點是感染性并發癥的發生率相對較高[1]。相關研究指出,感染性并發癥會延遲輔助治療,降低結直腸癌根治術患者的長期生存率[2,3]。因此如何有效的預防和減少術后感染性并發癥是胃腸外科關注的焦點之一[4]。有研究報道,炎性反應、免疫狀況及營養情況等是惡性腫瘤患者術后感染性并發癥的重要影響因素[5,6]。如預后營養指數(prognostic nutritional index,PNI)已被證實是術后感染性并發癥的預測因子[7]。Okugawa等[8]研究發現,LCR是結直腸癌術后并發癥的預測指標。而目前有研究者通過聯合炎性指標和免疫指標來提高預測價值[9]。本研究聯合術前LCR及PNI評分,結合結直腸癌術后感染性并發癥的術前主要危險因素,在列線圖的基礎上建立一個預測術后感染性并發癥風險患者的新模型。
資料與方法
1.研究對象:以“結腸腫瘤”和“直腸腫瘤”為關鍵詞,檢索安徽醫科大學第三附屬醫院病案系統,回顧性收集2019年3月~2022年4月胃腸外科結直腸組診斷為結直腸癌惡性腫瘤,行根治性手術并經術后病理證實為結直腸癌患者的臨床資料。納入標準:①行結直腸癌根治術且術期病理明確診斷為結直腸癌;②術前無放化療病史,無遠處臟器轉移,術后病理分期為Ⅰ、Ⅱ和Ⅲ期;③無合并其他部位惡性腫瘤;④臨床病理資料完整。排除標準:①術前合并急性、慢性感染性疾病;②術后新發非手術相關疾病;③結直腸癌合并腸梗阻急診手術者;④非醫囑出院無法準確評估術后并發癥情況的患者。
2.資料收集:收集患者的性別,年齡,體重指數(body mass index,BMI),術前糖尿病,腫瘤位置,腫瘤分期,手術方式,術前7天內的(淋巴細胞、C-反應蛋白、血小板、血清白蛋白)結果,術中腫瘤位置、出血量,術后病理報告(含腫瘤直徑、病理類型、腫瘤分期、腫瘤分化程度、手術切緣、有無血管和神經侵犯等),術后感染性并發癥等資料。術后指標主要收集患者術后吻合口漏、切口感染、肺部感染、腹盆腔感染、泌尿系感染、中心靜脈感染等感染性并發癥的發生情況。將納入研究的患者按照7∶3的比例隨機分為訓練組和驗證組,其主要指標淋巴細胞絕對數與C反應蛋白比值(lymphocytes to C-reactive protein ratio,LCR)、PNI、年齡、BMI數據分布情況如圖1所示。

圖1 患者數據分布情況
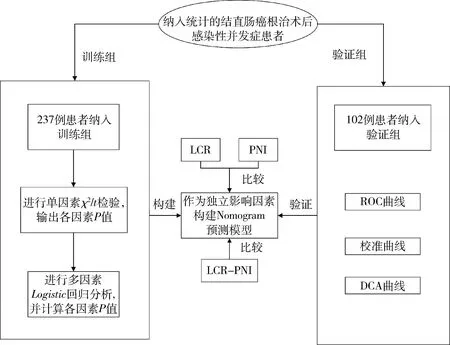
圖2 技術路線圖
結 果
1.一般臨床資料及感染性并發癥發生情況:2019年3月~2022年4月有351例患者在安徽醫科大學第三附屬醫院胃腸外科行結直腸癌根治術。進行排除和納入標準篩選后有339例患者納入研究,其中男性189例(56%);女性150例(44%);患者年齡35~93歲,平均年齡為69.43±11.33歲;平均BMI為22.65±2.88kg/m2;美國麻醉醫師協會(American Society of Anesthesiologists,ASA)分級:Ⅰ~Ⅱ級:262例(77%);Ⅲ級:77例(23%);手術出血量10~500ml,平均出血量為114.79±94.89ml;手術時間90~420min,平均手術時間為167.53±38.41min;納入的339例患者中術后并發癥共69例,感染性并發癥54例,發生率15.93%(54/339)。
2.LCR和PNI最佳截斷值:使用X-tile軟件計算LCR及PNI的最佳截斷值分別為0.48和45.65,結果詳見圖3。
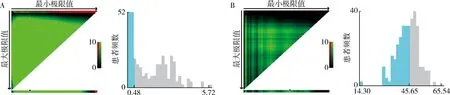
圖3 X-tile軟件計算LCR及PNI的最佳截斷值
3.感染性并發癥的單因素分析:結合LCR及PNI的截斷值,構建LCR-PNI評分:LCR>0.48且PNI>45.65記0分,LCR≤0.48且PNI>45.65和LCR>0.48且PNI≤45.65記1分,LCR≤0.48且PNI≤45.65記2分。將相關指標納入單因素分析后提示患者年齡、是否患有糖尿病、腫瘤分期情況、LCR-PNI評分等指標與結直腸癌根治術后感染性并發癥的發生有關(P<0.05),詳見表1。
表1 結直腸癌患者術后感染性并發癥單因素分析表
4.感染性并發癥的多因素分析:將上述與結直腸癌根治術后感染性并發癥有關的指標納入多因素分析后提示患有糖尿病、腫瘤分期(Ⅲ期vs Ⅰ~Ⅱ期)、LCR-PNI評分2分是術后感染性并發癥的獨立影響因素,詳見表2。
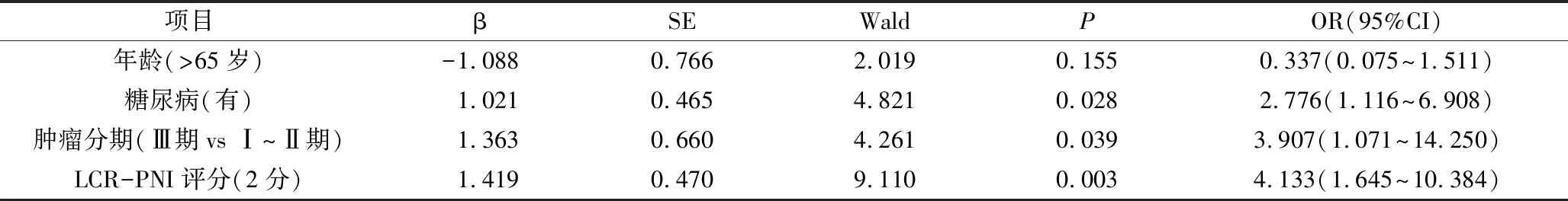
表2結直腸癌患者術后感染性并發癥多因素分析表
5.列線圖的建立:依據表2中多因素分析的結果,將差異有統計學意義的因素(糖尿病、腫瘤分期、LCR-PNI評分)引入R Studio軟件建立列線圖預測模型,詳見圖4。
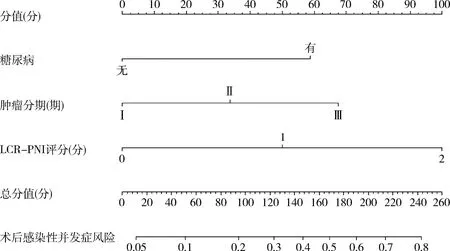
圖4 預測結直腸癌患者術后感染性并發癥的列線圖
6.測試列線圖的性能:訓練組和驗證組的AUC值分別為0.840(準確率為0.864,精確率為0.692)和0.814(準確率為0.831,精確率為0.621),ROC曲線如圖5所示,各模型AUC值如圖6所示。由驗證組和訓練組的校準曲線可看出預測值與實際值基本保持一致,校準曲線如圖7所示,表明列線圖對結直腸癌患者術后感染性并發癥有著很好的預測作用。
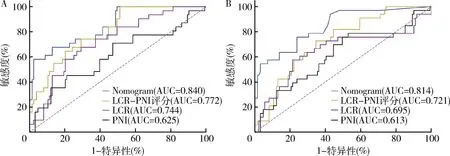
圖5 兩組列線圖的ROC曲線分析
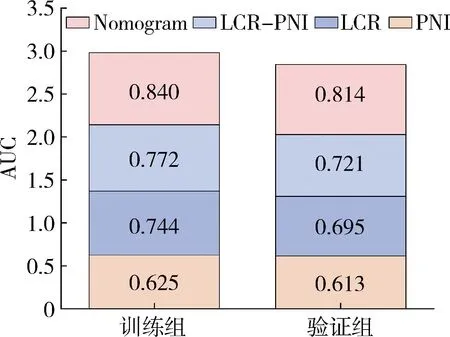
圖6 兩組AUC面積堆積柱狀圖
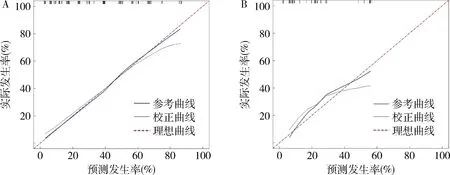
圖7 兩組列線圖的校準曲線
7.臨床應用:為進一步對模型臨床應用價值進行評估,繪制訓練組和驗證組DCA曲線,可見當閾值大于5%時,隨著閾值的增加,模型的凈獲益水平更高,詳見圖8。
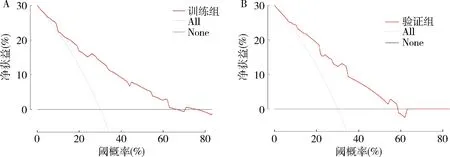
圖8 兩組列線圖的DCA曲線
討 論
C反應蛋白與導致結直腸癌患者淋巴細胞減少和T細胞受損相關,而淋巴細胞在宿主對腫瘤的細胞毒性免疫反應中起著關鍵作用,使得結直腸癌患者細胞介導的免疫力受損[12]。因此LCR可反映惡性腫瘤患者在不同炎性應激條件下的免疫狀態。目前LCR對惡性腫瘤患者術后短期及長期預后表現出優異的預測能力[13]。Okugawa等[8]的研究中LCR是結直腸癌患者術后并發癥和手術部位感染的獨立預測指標。此外他們還納入其他炎性指標進行對比預測,結果表明LCR與結直腸癌復發的相關性最高,是更可靠的生物學標志物。本研究中術前LCR降低時,可能提示患者出現免疫受損或全身炎性反應增強,從而出現術后感染性并發癥風險較高。目前大量研究已證明PNI是惡性腫瘤術后感染性并發癥及預后方面的重要預測指標[7, 14]。淋巴細胞是一類具有免疫識別功能的細胞系,血清白蛋白則反映個體的營養狀況,因此PNI可對患者的機體營養情況和免疫狀態予以綜合評估。Okita 等[15]研究指出,低PNI是潰瘍性結腸炎患者行直腸切除回腸袋-肛門吻合術后感染性并發癥的重要預測因素。Matsuda等[16]針對肝切除手術的研究也得出了相同的結論。本研究結果表明,低PNI組患者營養狀況和免疫力較差,術后發生感染性并發癥風險較高。
癌癥狀態通常會激活全身炎性反應,同時侵入性手術會觸發異常增強的炎性反應,炎性反過來會降低免疫力[17]。同時營養不良也可導致癌癥患者免疫功能下降[5]。LCR和PNI分別作為炎性指標和營養指標,兩者聯合可以更全面地對術后感染進行預測。Zhang等[18]研究將PNI與FPR聯合評分來預測胃癌根治術后老年患者的預后,FPR和PNI的AUC值分別為0.664和0.613,而FPR-PNI評分的AUC為0.672,結果表明兩者聯合的預測效率優于任何單一指標。有研究同樣表明PLR與PNI兩者的聯合是有利于判斷肝癌患者肝切除術的預后[19]。因此本研究進一步引入LCR-PNI評分,這項基于炎性指標和營養指標的研究有以下主要貢獻:首先多因素Logistic回歸分析顯示,LCR-PNI評分是結直腸癌術后感染性并發癥發生的獨立危險因素(P<0.05),LCR-PNI評分越高患者術后發生感染性并發癥概率越高;其次LCR-PNI評分的AUC為0.840,高于LCR和PNI的AUC,說明預測性生物學標志物的指標聯合將會改進現有常規預測模型建立的方法,在未來臨床預測模型應用中有巨大潛力。目前對于PNI和LCR的分界值,國內外的相關研究尚無統一的標準。PNI分界數值為45~52,LCR分界數值為0.3~0.7,與本研究結果一致[13, 20~22]。
列線圖具有分析結果可視化的特點,醫生可通過圖形快速計算出各種危險因素各狀態下的風險概率,并預測個體結直腸癌術后并發癥的發生率,目前在臨床領域得到廣泛應用[23, 24]。本研究通過多因素分析確定了其他的相關術前危險因素,如合并糖尿病、腫瘤分期,與之前相關研究結果一致[25,26]。本研究選擇評估術前因素,可以在早期幫助臨床醫生評估患者風險,若患者術后感染性并發癥發生率過高,可以暫緩手術,給予積極的保守治療。如對存在營養不良的患者應先及時予以積極的營養支持。術后感染性并發癥是可積極采取預防或治療措施的,因此該模型可以降低結直腸癌患者的手術風險,為腫瘤的預后提供關鍵信息。
本研究屬于回顧性研究,由于樣本量納入的嚴格性和數量有限,因此,需要進行多中心、大樣本量的臨床研究,以獲得更準確的LCR和PNI值。其次,由于不同的樣本量和患者選擇標準,最佳LCR和PNI值在不同的研究中有所不同,從而導致了值的偏差,所獲得LCR及PNI截斷值可能不適用于其他同類研究;今后該預測模型將進一步擴大樣本量、引入更多指標等來驗證其準確性并進行優化。
綜上所述,與單獨LCR、PNI指標比較,LCR-PNI聯合評分可作為結直腸癌患者術后感染性并發癥更好的預測指標。同時結合術前糖尿病、腫瘤分期和LCR-PNI評分建立的列線圖模型具有準確的個體化預測能力及前景廣闊的臨床應用價值。
利益沖突聲明:所有作者均聲明不存在利益沖突。

