延遲亞低溫對新生幼鼠腦白質損傷的改善作用
梁穗新 提運幸 黃駿榮 李秀紅 周雯嘉
腦白質損傷是嬰幼兒手術后常見的并發癥,及早產兒出生時易發的一類腦損傷[1]。先天性心臟病是人類最常見的先天性異常,約有25%患兒需要在生命的第1年進行密集的外科干預[2]。然而,對腦白質尚處于發育過程的新生兒,心臟外科手術后極易誘發腦白質損傷[3]。研究顯示,手術中體外循環和深低溫停循環仍是腦白質損傷的重要危因[4,5]。在前期研究中,為模擬先天性心臟病患兒大腦在經歷心臟手術中體外循環/深低溫停循環的過程,筆者構建了離體新生幼鼠的腦切片灌流及氧糖剝奪(oxygen glucose deprivation, OGD)模型,結果發現,腦部中的小膠質細胞呈過度活化狀態和出現了腦損傷[6]。亞低溫在新生兒缺氧缺血性腦病治療的安全性及遠期療效已得到證實[7]。然而,亞低溫在復溫階段適當延遲是否更具有腦損傷保護效果,目前國內外相關報道仍鮮少。基于此,本研究率先探討延遲亞低溫對OGD-復氧復糖誘導新生幼鼠腦白質損傷的改善作用及其可能機制。現報道如下。
材料與方法
1.主要儀器試劑:主要儀器:-80℃冰箱 (Thermo 700 SERIES,美國Thermo公司)、熒光倒置顯微鏡 (Nikon IX7,日本Nikon公司)、電子分析天平 (Kern770,德國Kern公司)、pH計 (Satorius PB-10,德國Satorius公司)、超凈臺(Thermo d-63415,美國Thermo公司)、實時熒光定量PCR儀(Biorad CFX96 Touch,美國Biorad公司);主要試劑:Hoechst 33342活細胞染色液(碧云天 C1028,中國碧云天公司)、MBP Antibody(Santa Cruz sc-271524,美國Santa Cruz公司)、O4 Antibody(Merk MAB345,美國Merk公司)、山羊抗小鼠IgG H&L(Abcam ab175473,英國Abcam公司);引物序列由上海生工合成,CD32正向引物:5′-AGGCCTGGTTTGCAGCTTT-3′,反向引物:5′-CTGCCTCGCAGGGTCTTG-3′;iNOS正向引物:5′-TCACGCTTGGGTCTTGTTCA-3′,反向引物:5′-CCTTTTCC TCTTTCAGGTCACTT-3′; CD206正向引物:5′-TGTATTCTTTGCCTTTCCCAGTCTC-3′,反向引物:5′-CCTCAAAACAGACTTACCCAATAGCTG-3′;IL-10正向引物:5′-CCCAGAAATCAAGGAGCATTTG-3′,反向引物:5′-CAGCTGTATCCAGAGGGTCTTCA-3′。
2.實驗動物:7天齡SD大鼠40只,雌雄不拘,選取體質量在10~16g之間[實驗動物使用許可證號:SYXK(粵)2022-0002],由廣東省醫學實驗動物中心提供[實驗動物生產許可證號:SCXK(粵)2022-0002],本研究方案已由該動物中心動物倫理委員會審批通過(審批號:B202008-13)。
3.全腦灌流和OGD模型建立:該模型建立方法參照前期研究,具體操作步驟為:將全部7天齡SD大鼠麻醉,無菌條件下迅速解剖大腦,并馬上放入人工腦脊液(section artificial cerebrospinal fluid, SaCSF)內[6]。以400μm厚沿冠狀將大腦制成腦切片。馬上將腦切片放于氧合SaCSF培養皿中,培養條件為:37℃,95% 濕度,5% CO2,培養時間不少于1h。然后將腦切片轉入有灌流用人工腦脊液(perfusion artificial cerebrospinal fluid, PaCSF)的定制培養皿中。用管道將定制培養皿連接起來,構建成一個灌流系統。整個定制培養皿放于溫度可調的培養箱內,用以模擬體外循環灌注。通過改變溶液,模擬OGD,如用10mmol/L的蔗糖替換PaCSF中的葡萄糖,用95% N2/5% CO2進行氣體混合。當OGD結束時,灌流液重新用PaCSF溶液和繼續行24h灌流。
4.亞低溫干預及分組:OGD完成后,用灌流溶液換成PaCSF溶液,將40個腦片隨機均分為4組,即對照組、24h組、48h組和72h組,即復溫至亞低溫(32℃)階段進行持續灌流,維持不同時長(0、24、48和72h)。亞低溫維持結束后再繼續復溫至36℃,并繼續維持灌注24h。對照組保持在36℃和維持同樣階段繼續灌流氧合PaCSF。
5.免疫熒光鑒定:灌注流程走完,馬上拿出腦切片,加入4%多聚甲醛(paraformaldehyde, PFA)在室溫下固定1h,用磷酸鹽緩沖生理鹽水(phosphate buffered saline, PBS)洗3遍。再加30%蔗糖溶液,放4℃冰箱一夜。第2天將其完全脫水,用OCT包埋劑將腦切片包埋;再用冰凍切片機將其制成20μm厚并放于載玻片上。室溫下用含10%山羊血清(goat serum,GS)及5%牛血清白蛋白(bovine serum albumin,BSA)的封閉液封閉1h。按說明書稀釋好少突膠質前體細胞(oligodendrocyte precursor cell,O4)、髓鞘堿性蛋白(myelin basic protein, MBP)的一抗,對切片進行孵育,放濕盒后在4℃冰箱一夜。第2天,用PBS洗玻片3次,再聯有熒光的二抗,孵育玻片的步驟與一抗相同,室溫避光1.0~1.5h。取出來用PBS沖洗3遍。再用防淬滅封片劑進行封片,鏡下觀察。其中,定性觀察比較MBP蛋白熒光強度;定量分析O4陽性細胞數量,每張切片隨機取3個視野,計數陽性細胞數量后求均值。
6.實時熒光定量PCR測定:切取腦切片部分組織,選取出其中的腦白質,用TRI Reagent提取各組織中的總RNA,用反轉錄試劑盒合成cDNA。按SYBR Green PCR kit說明書建立PCR反應體系,實時熒光定量PCR反應在CFX96 Touch實時熒光定量PCR儀。內參基因選用β-actin,采用2-△△Ct法計算CD32、一氧化氮合酶(inducible nitric oxide synthase,iNOS)、CD206和白細胞介素-10(interleukin-10,IL-10)基因的相對表達量。
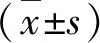
結 果
1.延遲亞低溫減輕腦白質損傷:用免疫熒光定性分析不同延遲時間下亞低溫對MBP表達的影響,結果表明在亞低溫32℃延遲24、48和72h組MBP蛋白熒光強度均高于對照組,并且MBP蛋白熒光強度隨著延遲亞低溫時長的增加而呈遞增的趨勢,詳見圖1。

圖1 各組離體腦切片MBP免疫熒光鑒定
2.延遲亞低溫增加O4陽性細胞數量:用免疫熒光分析不同延遲時間下亞低溫對O4陽性細胞數量的影響,結果表明在亞低溫32℃延遲24、48和72h組O4陽性細胞數量均高于對照組(F=314.907,P<0.001),且發現O4陽性細胞數量的增加與延遲亞低溫時長呈顯著正相關(r=0.968,P<0.001),詳見圖2和表1。

表1 各組離體腦切片O4陽性細胞數量、M1和M2型小膠質細胞的變化比較

圖2 各組離體腦切片O4陽性細胞數量
3.延遲亞低溫降低M1型小膠質細胞的極化并促進M2型的極化:用實時熒光定量PCR分析不同延遲時間下亞低溫對小膠質細胞極化的影響,結果表明在亞低溫32℃延遲24、48和72h組M1型小膠質細胞的CD32、iNOS表達均低于對照組(F分別為41.451、92.912,P均<0.001),且CD32、iNOS表達均與延遲亞低溫時長呈顯著負相關(r分別為-0.868、-0.916,P均<0.001);M2型小膠質細胞的CD206、IL-10表達均高于對照組(F分別為79.699、63.839,P均<0.001),且CD206、IL-10表達均與延遲亞低溫時長呈顯著負相關(r分別為0.862、0.910,P均<0.001),詳見表1。
討 論
先天性心臟病是一類十分常見的出生缺陷性疾病[8]。在英國,嬰兒先天性心臟病的發生率為0.9%;而我國則高達2.4%~10.4%[9]。隨著醫學外科技術、體外循環和重癥監護技術等發展,先天性心臟病的致死率也隨之降低[10]。然而,據統計顯示,高達67%的患兒術后發生腦損傷[11]。目前,對手術中體外循環和深低溫停循環誘發的腦白質損傷的研究主要集中于改進體外循環和主動脈阻斷方式,對于術后復溫至亞低溫的研究仍為空白。
MBP是中樞神經的髓鞘膜蛋白,是少突膠質髓鞘最豐富的結構蛋白。當缺血缺氧性腦病發生后,腦白質脫髓鞘致使神經轉導受累,損害機體行為認知功能[12]。當腦損傷發生時,MBP水平會明顯變高[13]。MBP表達的改變可作為腦白質損傷程度的指標。本研究發現在亞低溫32℃延遲24、48和72h組MBP蛋白熒光強度均高于對照組,且MBP蛋白熒光強度隨著延遲亞低溫時長的增加而呈遞增的趨勢,提示延遲亞低溫能有效減輕腦白質損傷。亞低溫治療在缺血缺氧神經元中的積極作用已經得到證實[14]。據研究表明,適當的體溫下降有助于維持腦皮質的正常生理功能、降低腦部氧的代謝、保障血-腦脊液屏障功能、控制神經遞質大量分泌、減輕炎性反應、加快神經干的增殖和增加神經元數量,從而起到保護中樞神經的作用,以上研究結論與本研究基本一致[15]。
少突膠質細胞是腦部白質膠質細胞群中最為重要的成員[16]。O4是少突膠質細胞的前體,在胚胎成長和嬰幼兒期的中樞神經系統完善進程中起著重要作用[17]。本研究發現,在亞低溫32℃延遲24、48和72h組O4陽性細胞數量均高于對照組,且發現O4陽性細胞數量的增加與延遲亞低溫時長呈顯著正相關,提示延遲亞低溫發揮腦白質損傷的作用,其機制可能與增加O4陽性細胞數量有關。未發育完善的少突膠質細胞易損性特征如下:30周胎齡中的腦白質最主要細胞是O4,一旦發生缺氧缺血時,炎性細胞因子、興奮性氨基酸和氧自由基等將對O4造成嚴重損傷。早期MBP的表達減少是少突膠質細胞功能障礙所致,持續的MBP表達受抑制則是反映了少突膠質細胞數量的損傷。有研究表明,新生大鼠腦白質損傷的改善與O4細胞存活量呈相關性,通過移植O4細胞能有效發揮腦白質損傷的保護作用,該發現與本研究結果基本一致[18]。
腦白質損傷后一般可激活小膠質細胞,而活化態的小膠質細胞主要分為兩類,即促炎M1型和抗炎M2型[18]。本研究結果發現,在亞低溫32℃延遲24、48和72h組M1型小膠質細胞的CD32、iNOS表達均低于對照組,且CD32、iNOS表達均與延遲亞低溫時長呈顯著負相關;M2型小膠質細胞的CD206、IL-10表達均高于對照組,且CD206、IL-10表達均與延遲亞低溫時長呈顯著負相關,提示延遲亞低溫發揮腦白質損傷的作用,其機制可能也與降低小膠質細胞M1型的極化和促進M2型極化有關。其可能的原因是延遲亞低溫促進小膠質細胞的M2型極化,進而減緩了炎性反應的加劇和改善神經功能修復,從而保護神經系統[19]。在體內外實驗中均發現,低溫可明顯抑制小膠質細胞OGD-復糖復氧時向M1型極化,并促進M2型極化[20]。從而誘導少突膠質細胞的分化成熟,抑制炎性反應,發揮對腦缺血后腦白質損傷的保護作用。以上結論與本研究基本一致。故在腦部早期抗炎防治過程中,除控制小膠質細胞過度活化外,平衡小膠質細胞M1/M2活化的比例,也是一種神經炎癥的治療策略。然而,本研究并無使用干預手段,少突膠質前體細胞、小膠質細胞是否確切參與治療作用,仍有待于進一步探究。
綜上所述,延遲亞低溫能有效改善OGD-復氧復糖誘導的新生幼鼠腦白質損傷,其機制可能與增加O4數量和促進小膠質細胞向M2型極化有關。該研究有望為制訂新生兒和嬰幼兒心臟外科術后腦保護策略提供重要線索和思路。然而,本研究仍存在一定的局限性,目前只用離體新生幼鼠的腦切片灌流及OGD模型體外模擬大腦在經歷手術中體外循環/深低溫停循環的過程,仍需進一步開展體內研究予以證實。
利益沖突聲明:所有作者均聲明不存在利益沖突。

