超聲靶向微泡破壞聯合溶瘤腺病毒治療胰腺癌的實驗研究
張婷婷 楊陳 胡巧洪 王世兵 范小明
胰腺癌患者通常發現時已處于晚期,手術是目前最有效的治療方法,然而大多數患者確診時已不具備手術條件[1]。對于無法切除且化療不敏感的患者,溶瘤病毒的免疫激活和腫瘤內選擇性復制等特點為臨床提供了新的診療思路。重組人5 型腺病毒藥物在2005 年時已被我國批準用于鼻咽癌治療[2]。溶瘤病毒通過增強抗原釋放、識別和免疫激活來增強腫瘤組織周圍促炎環境形成,以抵消腫瘤細胞的免疫逃避[3-4]。然而,胰腺腫瘤周圍結締組織增生和免疫抑制性微環境(tumor micro-environment,TME)限制了病毒與腫瘤細胞接觸以及免疫細胞在腫瘤周圍浸潤,使溶瘤病毒抑制腫瘤的效果大打折扣[5]。在低頻超聲條件下,誘導微泡破裂引起的空化效應能改變細胞膜通透性,從而提高藥物或基因傳送,該技術被稱為超聲靶向微泡破壞(ultrasound targeted microbubble destruction,UTMD)[6]。超聲和微泡因具有安全、無毒、廉價等優點,使UTMD 產生的空化作用在藥物運輸、血管破壞等領域被廣泛關注[7]。本研究通過將UTMD 與溶瘤腺病毒(oncolytic adenovirus, oAd)聯合使用,探索UTMD 是否能促進oAd 對胰腺腫瘤的抑制作用,及其相關作用機制。
1 材料和方法
1.1 材料 C57BL/6 SPF 級雌性小鼠55 只(6~8 周,體重18~20 g)購自上海斯萊克實驗動物有限責任公司,均飼養在浙江省人民醫院動物實驗研究中心,溫度20~26 ℃,空氣濕度40%~70%,12 h 晝夜光照交替。鼠源胰腺癌細胞(Panc-02 細胞)、人胚胎腎細胞293(HEK293 細胞)和oAd 均由浙江省人民醫院臨床科研所提供。DMEM 培養基(批號:C11995500BT)、FBS(批號:C0235)均購自美國Gibco公司,PBS(批號:PB180327)購自武漢普諾賽生命科技有限公司,無水乙醇(批號:10009228)、氯化銫(批號:20014213)、檸檬酸(批號:10007108)、二甲苯(批號:10023418)、中性樹膠(批號:10004160)購自國藥集團化學試劑有限公司,聚乙二醇8000(批號:60304ES76)購自上海翌圣生物科技有限公司。青/鏈霉素雙抗溶液(批號:C0222)、Annexin V-FITC 細胞凋亡檢測試劑盒(批號:C1062S)、過氧化物酶顯色試劑(propidium iodide,DAPI;批號:C1002)、HE 染色試劑盒(批號:C0105S)、辣根過氧化物酶標記的山羊抗鼠二抗(批號:A0216)、透析袋(批號:FDM303-5m)、多聚甲醛(批號:P0099)均購自上海碧云天生物技術股份有限公司,oAd-5 E1A 單克隆抗體(sc-58658)購自美國Santa Cruz Biotechnology 公司,CD3 抗體(ab16669)抗體購自美國Abcam 公司,Tunel染色試劑盒(批號:11684817910)購自瑞士Roche 公司,抗熒光淬滅封片劑(批號:0100-01)購自美國SouthernBiotech 公司,膠原酶Ⅱ(批號:C8150)購自北京索萊寶科技有限公司。小鼠血清(批號:SBJ-SEM004)購自南京森貝伽生物科技有限公司。超聲治療儀(型號:VINNO M86)購自中國飛依諾科技股份有限公司。微泡為醫用Sono Vue 對比劑,購自意大利Brocco 公司。超聲醫用耦合墊購自深圳市全立好實業有限公司,倒置顯微鏡(型號:DM750P)購自德國Leica 公司,高速低溫離心機(型號:Optima XPN-10)購自美國Beckman 公司,流式細胞儀(型號:NovoCyteAdanteon V6B5R3)購自美國Agilent Technologies 公司。本研究經浙江省人民醫院實驗動物福利倫理委員會審查通過(批準文號:20231016192616359566)。
1.2 微泡oAd 混合液制備 oAd 病毒擴增:將HEK293細胞放在含有10%FBS、1%青/鏈霉素雙抗(100 U/mL)的DMEM 培養基中培養至40 皿。待HEK293 細胞長滿至80%~90%時將培養基換成含有5%FBS、1%青/鏈霉素雙抗(100 U/mL)的DMEM 培養基,加入50 μL濃度為106PFU/mL病毒感染HEK293 細胞。觀察培養皿,當全部布滿病毒空斑時收集所有培養液和細胞,將培養液和細胞反復凍融3 次以上,放置在-80 ℃冰箱保存。
氯化銫梯度超速離心法病毒提純:將凍融后的培養液和細胞在4 ℃高速離心機12 000 r/min離心10 min,收集上清液。將上清液和聚乙二醇8 000 溶液以2∶1 的比例混勻,置4 ℃冰箱內過夜。次日將溶液放在4 ℃高速離心機12 000 r/min 離心20 min,棄上清液,收集沉淀。在沉淀中加2 mL 密度為1.1 g/mL 的氯化銫溶液并重懸沉淀,移至4 ℃高速離心機12 000 r/min 離心10 min,收集上清液。先在離心管加入2 mL 密度為1.4 g/mL 的氯化銫溶液,再用滴管加入3 mL 密度為1.3 g/mL 的氯化銫溶液,最上層加入5 mL 含病毒的上清液,置4 ℃高速離心機20 000 r/min 離心2 h。離心結束后用移液槍收集密度在1.3~1.4 g/mL 氯化銫溶液之間的病毒條帶,轉移至透析袋中封存。將透析袋放在透析緩沖液中,置4 ℃冰箱內過夜,8 h 換1 次透析緩沖液。收集透析袋內的病毒溶液,置-80 ℃冰箱保存。通過TCID50 法測定病毒的滴度。
將微泡按產品說明書注入0.9%氯化鈉溶液5 mL用力振蕩30 s 形成微泡懸液,用剛配制的微泡懸液將1010PFU/mL oAd 稀釋至108PFU/mL,冰上孵育30 min,制成微泡oAd 混合液[8]。
1.3 小鼠體內腫瘤模型建立和分組 在C57BL/6 小鼠右前肢皮下注射Panc-02 細胞2×106個/只,選擇腫瘤體積在100~150 mm3的小鼠55只。將小鼠隨機分為NC組(注射PBS 溶液100 μL)、UTMD 組(注射微泡溶液100 μL,并行超聲微泡破壞處理5 min)、oAd 組(注射108PFU/mL oAd 溶液100 μL)、oAd+微泡組(注射108PFU/mL 微泡oAd混合液100 μL)、oAd+UTMD組(注射108PFU/mL微泡oAd混合液100 μL,并行超聲微泡破壞處理5 min),每組11 只。2 d 給予1 次瘤內注射治療及超聲微泡破壞處理,共處理5 次。2 d 記錄1 次小鼠腫瘤體積。當有小鼠腫瘤體積超過2 000 mm3時終止實驗,所有小鼠均在實驗第14 天采用頸椎脫臼法處死,所有數據記錄終止在第12 天。第3 次給藥結束后24 h 每組隨機取6 只小鼠處死,剝離小鼠皮下腫瘤組織,隨后PBS 沖洗干凈置于冰上,其中3 只用于流式分析,3 只用于切片染色分析。腫瘤體積計算公式:腫瘤體積=長度(mm)×寬度(mm)×寬度(mm)×0.5。
1.4 UTMD 處理及超聲儀器參數設置 UTMD 組和oAd+UTMD 組小鼠在瘤內注射微泡溶液或微泡oAd混合液后,立即給予持續異氟烷吸入麻醉(氣體流量為300 mL/min,濃度為1.5%),隨后在小鼠皮下腫瘤處涂滿滅菌耦合劑,放置超聲醫用耦合墊(厚約5 mm),探頭緊貼耦合墊垂直于皮下瘤照射。超聲選用X4-12L探頭下CBI 造影模式,設置發射頻率4 MHz,脈沖重復頻率為1 000 Hz,脈沖長度18.0 cycle,聲功率40%,脈沖時間1 s,間隔時間1 s,持續時間300 s,占空比0.2%[9]。
1.5 腫瘤組織壞死區域的觀察 采用HE 染色。將每組3 只小鼠的腫瘤組織放至多聚甲醛中固定、石蠟包埋,切片厚約5 μm,二甲苯溶液浸泡,然后用無水乙醇沖洗脫蠟,再進行HE 染色,中性樹膠封片。倒置顯微鏡觀察切片并拍照,采用Image J 軟件圈取切片中粉色壞死區域計算壞死面積,比較各組小鼠壞死面積(以與NC 組比值表示)的差異。
1.6 腫瘤組織E1A 蛋白/CD3+T 細胞的檢測 制作切片步驟同HE 染色步驟,切片脫蠟后,用1×檸檬酸(pH 6.0)修復液進行抗原修復。將切片放于3%H2O2溶液中,室溫孵育20 min 進行內源性酶阻斷。然后在切片組織上滴加小鼠血清,室溫孵育30 min 進行血清封閉。加入一抗(E1A抗體、CD3抗體)室溫孵育30 min,PBS 洗滌后加入辣根過氧化物酶標記的山羊抗鼠二抗孵育30 min。將DAPI 染液滴加到組織上,玻片放在倒置顯微鏡下觀察,待出現E1A 抗體/CD3 抗體棕色染色后清水沖洗干凈,風干并用中性樹膠封片,倒置顯微鏡對切片拍照。E1A 抗體表達為細胞內蛋白染色,觀察各組切片上E1A 蛋白棕色染色分布及染色深淺情況。CD3 抗體表達為細胞膜染色,采用Image J 軟件計數切片中棕色CD3+T 細胞數。
1.7 觀察腫瘤組織凋亡染色情況 采用Tunel 染色。血清封閉之前的步驟同E1A 蛋白染色,按產品說明書配置Tunel 反應液,血清封閉后在切片組織上滴加Tunel 反應液,4 ℃孵育過夜。PBS 洗滌,甩干后在切片組織內滴加DAPI 染液,避光室溫孵育10 min。PBS 洗滌,甩干后用抗熒光淬滅封片劑封片。使用熒光顯微鏡對切片拍照(委托武漢市皮諾飛生物有限公司拍攝),觀察各組小鼠切片中熒光情況。
1.8 腫瘤細胞總凋亡率的檢測 采用流式細胞術。每組3 只小鼠的腫瘤組織用剪刀剪碎,加入300 μL Ⅱ型膠原酶(200 U/mL),37 ℃持續振蕩培養箱中孵育6 h 后,PBS 洗滌,用濾網過濾去大塊細胞團,留下細胞懸液。細胞懸液加入Annexin V-FITC 細胞凋亡檢測試劑,室溫避光孵育30 min,PBS 洗去多余染料,流式細胞儀檢測細胞發光情況,NovoExpress 軟件分析流式圖,流式圖右下象限表示早期凋亡,右上象限表示晚期凋亡,兩象限值相加即為總凋亡率。
1.9 統計學處理 采用SPSS 26.0 統計軟件。計量資料以表示,多組間比較采用單因素方差分析,兩兩比較采用LSD-t檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 第12 天各組小鼠腫瘤組織體積的比較 在第12天時oAd 組、oAd+微泡組和oAd+UTMD 組腫瘤體積比NC 組均明顯降低(均P<0.05),其中oAd+UTMD 組腫瘤增長減緩效果最強。oAd+UTMD 組的腫瘤組織體積小于oAd 組(P<0.05),oAd 組和oAd+微泡組腫瘤體積差異無統計學意義(P>0.05),UTMD 與NC 組腫瘤體積比較差異無統計學意義(P>0.05),見表1。

表1 第12 天各組小鼠腫瘤組織體積比較(mm3)
2.2 各組小鼠腫瘤組織E1A 蛋白表達情況 NC 組和UTMD 組切片中未見E1A 蛋白表達,oAd 組、oAd+微泡組和oAd+UTMD 組均見到E1A 蛋白表達,oAd+UTMD組細胞質內E1A 蛋白染色最深,oAd 組染色最淺,見圖1(插頁)。

圖1 各組小鼠腫瘤組織E1A 蛋白表達情況
2.3 各組小鼠腫瘤組織切片壞死面積的比較 含oAd的3 組小鼠腫瘤壞死面積均大于UTMD 組(均P<0.05),其中oAd+UTMD 組壞死最大。oAd+UTMD 組壞死面積又較oAd 組明顯增加(P<0.05),oAd 組和而oAd+微泡組之間的比較差異無統計學意義(P>0.05),見圖2(插頁)、表2。

圖2 各組小鼠腫瘤組織切片病理檢查所見

表2 各組小鼠腫瘤組織切片壞死面積的比較
2.4 各組小鼠腫瘤組織CD3+T 細胞數比較 相比于NC 組和UTMD 組,含oAd 的3 組小鼠腫瘤組織內CD3+T細胞數均增加(均P<0.05)。oAd+UTMD 組腫瘤組織中CD3+T 細胞數較oAd 組和oAd+微泡組均增多(均P<0.05),UTMD 組與NC 組比較差異無統計學意義(P>0.05),見圖3(插頁)、表3。

圖3 各組小鼠腫瘤組織CD3+T 細胞分布
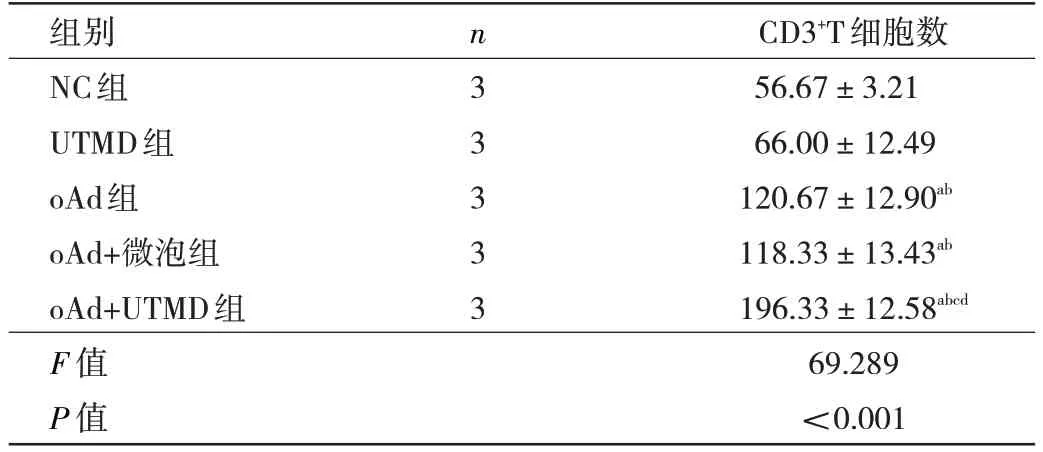
表3 各組小鼠腫瘤組織CD3+T 細胞數比較(個)
2.5 各組小鼠腫瘤組織凋亡情況比較 oAd 組、oAd+微泡組和oAd+UTMD 組的總凋亡率均高于NC 組(均P<0.05),oAd+UTMD 組比oAd 明顯增多(P<0.05)。oAd 組和oAd+微泡組比較差異無統計學意義(P>0.05),UTMD 組和NC 組之間差異無統計學意義(P>0.05),見圖4(插頁)、表4。同樣的趨勢,在腫瘤組織Tunel 染色中也觀察到,oAd+UTMD 組綠色熒光分布最多,見圖4(插頁)。
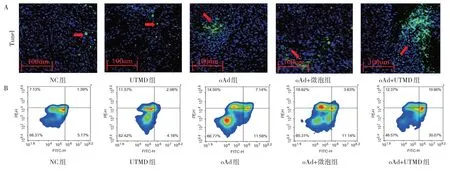
圖4 各組小鼠腫瘤組織凋亡分析(A:凋亡的腫瘤組織染色結果,Tunel 染色,×20;B:腫瘤細胞凋亡流式分析圖)

表4 各組小鼠腫瘤總凋亡率比較(%)
3 討論
腫瘤細胞與正常細胞相比,胞內抑制病毒的細胞信號轉導通路表達異常,使溶瘤病毒可以選擇性的在腫瘤細胞內轉染[10]。Zhang 等[11]研究發現單純皰疹病毒通過下調腫瘤相關巨噬細胞,增加腫瘤浸潤淋巴細胞百分比來減緩胰腺腫瘤細胞增長。Koujima 等[12]發現胰腺癌細胞的侵襲性與磷酸化細胞外信號調節激酶1 和2 的表達有關,端粒酶特異性oAd 可以破壞細胞外調節蛋白激酶信號傳導,抑制胰腺癌細胞遷移和侵襲。本研究建立小鼠胰腺癌腫瘤模型中,給予包含oAd 的3 組小鼠腫瘤體積增長都有所減緩,符合oAd 對腫瘤有殺傷作用。胰腺腫瘤結締組織增生和腫瘤TME 限制病毒的進入復制以及效應T 細胞和自然殺傷細胞等免疫細胞的腫瘤浸潤[13]。將藥物溶解在微泡殼內的脂質中,或附著在微泡殼表面[14-15],當載藥的微泡到達目標位置后,用低強度超聲刺激微泡破裂,產生的液體流動增加了細胞的剪切應力,使細胞膜通透性增加,促進分子、納米顆粒等治療劑在細胞內遞送而不造成不可逆的細胞損傷[16-17]。為了探尋UTMD 是否能增強oAd 對胰腺癌的溶瘤作用,筆者對小鼠瘤體進行測量并進一步行腫瘤組織HE 染色和Tunel 染色及腫瘤細胞凋亡分析,結果顯示oAd+UTMD 組小鼠腫瘤體積增長比oAd 組顯著減緩,腫瘤組織腫瘤壞死和凋亡均為最多。為進一步研究UTMD 是否提高oAd 在腫瘤內轉染,對腫瘤組織進行oAd 獨特表達的E1A 染色,結果顯示在給予相同病毒量的情況下oAd+UTMD組E1A 蛋白染色最深,這提示UTMD 通過提高oAd 在體內利用率來增強其抗腫瘤作用。oAd 組和oAd+微泡組無論是在抑制腫瘤生長還是富集CD3+T 細胞等方面差異均無統計學意義,這提示單純的微泡對oAd溶瘤效果幫助不大,微泡破裂產生的空化作用才是溶瘤的關鍵因素。
實體腫瘤內促血管生成因子過表達,使腫瘤內血管生成畸形和血液灌注少,血液內抗腫瘤因子無法進入[18]。有相關研究表明,UTMD 可以促進前列腺素和一氧化氮的產生,使腫瘤血管正常化,增加腫瘤局部的血流灌注[19]。Lin 等[20]研究發現UTMD 的空化將腫瘤相關巨噬細胞從M2 巨噬細胞重新定向到抑制腫瘤的M1 巨噬細胞,使腫瘤內血管正常化,促進藥物向腫瘤內滲透。這也解釋了在實驗中UTMD 組的腫瘤體積增長比NC 組略緩,UTMD 組在富集CD3+T 細胞和誘導腫瘤凋亡等方面比NC 組略強。Zhang 等[21]在探尋如何以低成本的方式將核酸轉染進乳腺癌細胞中時,發現UTMD 處理后細胞立即出現孔隙,并在30 min 內細胞形態恢復正常。UTMD 不僅使細胞產生空隙增加藥物運輸,同時刺激細胞內吞作用增加。Jin 等[22]用微泡運輸腺相關病毒,對Hela 細胞超聲照射后發現病毒不完全通過超聲形成的空隙運輸,由網格蛋白介導的腫瘤細胞內吞作用增加,細胞通過內吞來攝取溶瘤病毒,同時恢復細胞膜結構。
溶瘤病毒將腫瘤細胞溶解后釋放的腫瘤相關抗原和腫瘤新抗原可被樹突狀細胞呈現在細胞表面,刺激免疫細胞啟動先天性和適應性免疫反應[23]。溶瘤病毒介導的免疫治療在實體腫瘤治療中療效差的原因主要考慮:一是腫瘤細胞外基質中纖維增生多,使病毒無法滲透進腫瘤內部;二是腫瘤周圍有免疫抑制微環境,其中調節性T 細胞和骨髓源性抑制細胞增多,而免疫細胞處于耗竭狀態,進而無法響應溶瘤病毒引發的抗腫瘤免疫[24]。本研究中注射oAd 的3 組小鼠腫瘤切片中CD3+T 細胞均有所增加,其中以oAd+UTMD 組增加最明顯且與oAd 組比較差異有統計學意義。這提示UTMD 和oAd 聯合使用可以提升oAd 引的抗腫瘤免疫能力。
綜上所述,UTMD 和oAd 聯合使用時,UTMD 可以促進oAd 在腫瘤內的轉染,協助oAd 在腫瘤內富集更多的免疫細胞,增加腫瘤內壞死和凋亡從而抑制腫瘤增長。

