表現為支氣管內黑色素腫塊的原發性肺惡性黑色素瘤1例
王建坤 王漢生 任濤 劉巖 周妍卉 王梅芳
惡性黑色素瘤(malignant melanoma,MM)是一種起源于黑色素細胞的惡性腫瘤,占所有惡性腫瘤的 1%~3%,通常起源于皮膚或粘膜。原發性肺惡性黑色素瘤(primary malignant melanoma of the lung, PMML)極為罕見,占所有肺部腫瘤的 0.01%[1]。在此,我們報告1例72 歲的女性PMML患者在支氣管鏡檢查中發現支氣管內色素腫塊。術中行經支氣管鏡鉗夾活檢和EBUS-TBNA 檢查時,快速現場評估(rapid on-site evaluation, ROSE)初步診斷為MM,后經組織病理學證實為PMML。
病例資料
患者,女性,72歲,因咳嗽、咳痰兩周就診于十堰市太和醫院。患者否認既往有皮膚、 耳部或眼部黑色素痣病變史;同時否認家族惡性腫瘤病史及遺傳病史。體格檢查顯示右上肺可聞及濕羅音;皮膚、眼睛、 肛周、外生殖器未見痣及色素沉著。實驗室結果顯示,患者CEA、 CYFRA、 NSE 和 SCC 水平分別為 1.79 μg/L(正常:0~5.0 μg/L)、 1.31 ng/mL(正常:0~3.3 ng/mL)、 10.8 ng/mL(正常:0~16.3 ng/mL)和 0.58 ng/mL (正常:0~2.7 ng/mL)。胸部X線示右肺上葉不規則腫塊,邊緣粗糙;胸部 CT 示右肺上葉一實性腫塊,大小 2.1 cm× 3.9 cm× 3 cm;縱隔可見多處腫大淋巴結,短徑 1.4 cm;此外,發現雙側胸腔積液,如(圖1A)所示。
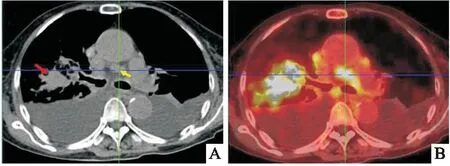
圖1 胸部CT以及PET-CT圖像 A:胸部CT顯示右上肺葉腫塊(紅色箭頭),伴縱隔淋巴結腫大(黃色箭頭); B:PET-CT掃描顯示肺腫塊,18F-FDG最大標準化攝取值為24.7;縱隔淋巴結腫大,18F-FDG最大標準化攝取值為15.9
胸腔穿刺細胞學檢查顯示淋巴細胞和間皮細胞為主,未見惡性依據。纖維支氣管鏡檢查示右主支氣管內腫物(圖2A),右上葉遠端支氣管局部黏膜粗糙、肥厚、呈灰黑色(圖2B),經支氣管鏡鉗夾活檢腫塊, ROSE 初步診斷為惡性黑色素瘤(圖 3A、B)。
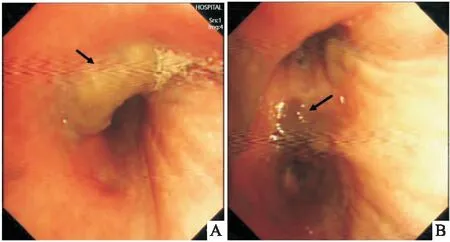
圖2 纖維支氣管鏡鏡下圖像 A:支氣管鏡檢查示右主支氣管支氣管內腫塊;B:右上葉遠端支氣管局部黏膜粗糙、肥厚、呈灰黑色

圖3 原發性肺惡性黑色素瘤的ROSE與組織病理特征 A、B:黑色素瘤細胞為漿細胞樣,細胞核偏位,細胞質向細胞核一側或另一側移位,細胞核周圍可見胞質,胞質內可見不透明的色素團塊和顆粒(Diff-Quik染色, 放大倍數×100、×400);C、D:腫瘤細胞呈片狀分布,浸潤性生長,間質內伴少量炎性細胞。腫瘤細胞呈上皮樣或組織細胞樣改變,胞質豐富,細胞核圓形、卵圓形或不規則。部分細胞可見核仁或細胞內色素顆粒 (HE染色,放大倍數×200、×400)
根據ROSE的初步診斷,行經超聲支氣管鏡引導下針吸活檢(EBUS-TBNA, endobronchial ultra-sound-guided transbronchial needle aspiration) 進行肺惡性腫瘤分期。 組織病理學蘇木精-伊紅(H&E, Hematoxylin-Eosin )染色顯示腫瘤細胞呈片狀分布,浸潤性生長,伴有間質內少量炎性細胞浸潤;瘤細胞上皮樣或組織細胞樣改變,胞漿豐富、核圓形、卵圓形或者不規則形,部分細胞可見核仁,部分細胞的胞質內見色素顆粒(圖 3C、D)。
免疫組織化學染色顯示黑色素沉著以及惡性細胞中HMB-45、 Melan-A、 SOX-10、 S-100 和 Ki-67(20%+)呈陽性,而CKAE1/AE3、 CK5/6、TTF-1、CD-45和synaptophysin陰性(圖4),免疫組織化學染色結果支持惡性黑色素瘤診斷。全身正電子發射斷層掃描CT(PET-CT)顯示右上肺腫塊密度異常,伴氟代脫氧葡萄糖(18F-FDG)代謝升高,最大標準化攝取值(SUVmax)為 24.7,肺門/縱隔淋巴結18F-FDG代謝升高,SUVmax 值為15.9(圖 1B)。

圖4 免疫組織化學染色 A:惡性黑色素瘤細胞細胞質對HMB-45抗體強陽性反應,呈棕色顆粒(放大倍數×400);B:惡性黑色素瘤細胞細胞質中Melan-A蛋白陽性,呈棕黃色顆粒(放大倍數×400);C:惡性黑色素瘤細胞的細胞核和細胞質對S-100抗體均呈陽性,呈棕黃色顆粒(放大倍數×400);D:惡性黑色素瘤細胞核中SOX-10蛋白呈陽性,呈棕色顆粒(放大倍數×400)
考慮患者入院時已存在多發轉移,無手術指征。
入院第10天于我院臨床分子診斷中心對活檢標本行惡性黑色素瘤相關遺傳分子檢測,包括NRAS、KIT 和 BRAF 基因。結果顯示BRAF V600E突變。隨后給予達拉非尼聯合曲美替尼靶向藥物治療,具體用藥如下:達拉非尼口服150mg,每日兩次;曲美替尼口服2mg,每日1次。治療2個月后,胸部增強CT掃描顯示右肺惡性黑色素瘤腫塊尺寸明顯減小(圖5 A、B)。患者已隨訪15個月,健康狀況良好,無復發跡象。
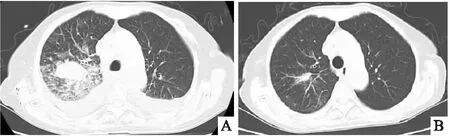
圖5 治療前后的胸部增強CT掃描結果 A:胸部增強CT掃描顯示右上肺葉腫塊;B:胸部CT增強掃描顯示治療后右上肺葉腫塊幾乎消失
討 論
黑色素瘤通常發生在皮膚、粘膜和眼眶上,但很少發生在皮膚外。 在肺部 MM 的病例中,大多數情況是來自皮膚病變的轉移性MM,而 PMML 極為罕見,僅占肺部腫瘤的 0.01%[1]。因此,在診斷肺部原發性黑色素瘤之前,我們必須證明在更常見的部位沒有原發性病變[2]。本病例患者在詳細體格檢查及病史采集期間,在皮膚、粘膜、眼球、陰道未見明確的黑色素痣及色素沉積。然而PMML的發病機制尚不明確[3, 4],目前有 3 種假說: (1) 機體內存在的黑色素細胞在胚胎形成期向表皮或真皮層遷移的同時也可向機體內臟器官遷移,導致食管、 咽喉、腦、肺等處同樣存在黑色素細胞,位于氣管支氣管、咽喉和食管殘存的原始成黑色素細胞則均可以進一步分化為原發性肺惡性黑色素瘤。(2) 黏膜下支氣管腺的黑色素細胞化生。(3) 起源于下呼吸道中的多潛能干細胞向黑色素細胞分化。
PMML發病率在性別上無顯著差異,文獻報道的平均診斷年齡為51歲(45~71歲)[1]。臨床癥狀無特異性,以咳嗽、咳痰、胸痛等局部癥狀以及體重減輕、盜汗、發熱等全身癥狀為特征。在本病例中,患者為老年女性、無明確家族史,因咳嗽兩周而入院;患者胸部CT表現為右肺上葉不規則分葉狀腫塊,與肺癌影像難以區分。組織學上而言,腫瘤細胞部分呈腺泡狀排列,部分呈團塊狀排列,細胞呈上皮樣,異型性明顯,胞質豐富,細胞核呈空泡狀,常可見核仁。有絲分裂象常見,腫瘤細胞內常可見黑色素顆粒[1]。通常HMB45、S-100、vimentin、Melan-A免疫組化染色呈陽性。HMB45是惡性黑色素瘤的特異性抗原,HMB45陽性可以確定診斷[5, 6]。然而,一部分MM病例HMB45呈陰性,主要是在轉移性情況下,并且該標記物并不完全特異性[7]。Melan-A和vimentin敏感度高,但特異性低于HMB45。到目前為止,這是唯一一個由ROSE實時診斷的病例。惡性黑色素瘤的細胞形態表現為高度多形性細胞的分散或固體聚集體,具有大核仁,通常含有黑色素[8];Ronchi等人指出,當出現在適當的形態學背景下,黑色素沉著是診斷MM的重要細胞形態學線索[9],本病例ROSE所呈現的黑色素瘤細胞形態符合以上特征。此外,組織病理學具有上皮樣細胞形態的MM占所有病例的70%以上,其特征是細胞呈多邊形形狀,中等至豐富的顆粒狀或透明的細胞質,細胞質邊界不明顯,輕度或中度深染的大細胞核具有顆粒狀和團塊的染色質[7, 10]。
Kamposioras 等人[3]的綜述研究顯示,約3.2% 惡性黑色素瘤在發生轉移后未找到原發灶。因此,原發肺惡性黑色素瘤的診斷必須建立在臨床、影像及病理綜合考慮。根據Wilson等人提出的PMML的5項診斷標準[1]:孤立的肺腫塊;免疫組織化學(S-100、HMB-45、Melan-A)和/或電子顯微鏡證實惡性黑色素瘤;無皮膚、粘膜或眼部黑色素瘤病史;黑色素瘤細胞侵襲支氣管上皮;診斷期間未見其他腫瘤。以及Allen 和Jensen等人[5, 11]提出肺原發惡性黑色素瘤的診斷標準: 影像學提示單個肺實性結節或腫塊; 典型的病理學改變,并經免疫組化( S-100、HMB-45、Melan-A) 或電鏡證實存在腫瘤細胞內黑色素顆粒; 無皮膚、黏膜等處的黑色素瘤切除病史; 發病前無明顯的黑色素痣; 支氣管黏膜上皮下有散在或成巢的黑色素瘤細胞; 黑色素瘤細胞浸潤的支氣管黏膜無潰瘍形成; 支氣管黏膜下有明顯的腫瘤細胞巢浸潤。本病例符合上述學者所提出的診斷標準,因此建立了PMML的診斷。由于這種疾病的罕見性,它很容易被臨床醫生、放射科醫生和病理學家所忽視。另外,顯微鏡下病理檢查可能找不到細胞質中的黑色素顆粒,容易誤診為小細胞肺癌、低分化鱗狀細胞癌或低分化腺癌。PMML需與肺惡性淋巴瘤、未分化癌、間質肉瘤、漿細胞肉瘤等鑒別。在臨床實踐中,對于一些疾病進展迅速且缺乏典型特征的患者,應常規進行免疫組化檢測,以防止漏診和誤診[10]。
PMML患者的最佳治療方法仍有待確定。對于病變局限于肺的患者,肺葉切除術或肺切除術合并淋巴結清掃仍然是PMML患者的首選治療方法[4]。在病人不可能或不希望手術的情況下,可以考慮化療、放療和免疫治療。化療藥物是達卡巴嗪,通常與免疫療法如白細胞介素-2或干擾素聯合使用[12]。Robert 等人[13]進行了一項隨機試驗,發現在約三分之一的BRAF V600E或V600K突變的不可切除或轉移性黑色素瘤患者中,達拉非尼聯合曲美替尼可帶來長期獲益。此外,兩項獨立的3期臨床試驗(COMBI-d和COMBI-v)表明,BRAF抑制劑達拉非尼(150 mg, 2次/d)和MEK抑制劑曲美替尼(2 mg, 1次/d)治療改善了BRAF V600E或V600K突變的不可切除或轉移性黑色素瘤患者的總生存率[14, 15]。在我們的病例中,患者在診斷時已出現縱隔淋巴結轉移,無手術指征。因此,在獲得患者的書面知情同意后,給予口服達拉非尼和曲美替尼。經過兩個月的治療,患者右肺上葉腫物和縱隔淋巴結病變幾乎消失,達拉非尼聯合曲美替尼的治療效果令人驚訝。PMML極為罕見,臨床表現和影像學特征不明確,易誤診為肺癌。基于其形態學和免疫表型的可變性,PMML的診斷仍然具有挑戰性。靶向藥物治療,比如達拉非尼聯合曲美替尼對于BRAF V600E突變的晚期PMML患者是一個很好的選擇。

