用泡沫銅與濃、稀硝酸反應的實驗改進
羅敏 劉茜 楊麗君
摘要:? 為解決銅與稀硝酸反應時裝置中氧氣對實驗的影響及氮氧化物易泄露等問題,利用注射器、三通閥和具支U型管等儀器設計簡易的實驗裝置,并選用泡沫銅與濃、稀硝酸進行反應。改進后的實驗具有取材方便、操作簡單、安全環保、現象明顯等特點,非常適合課堂演示以及學生分組實驗。
關鍵詞: 銅與濃、稀硝酸反應; 實驗裝置改進; 泡沫銅
文章編號: 10056629(2024)04007703
中圖分類號: G633.8
文獻標識碼: B
1? 問題的提出
硝酸的性質是學生在高中化學學習中必須掌握的重要內容。《普通高中化學課程標準(2017年版2020年修訂)》在“教學提示”欄目中將“濃、稀硝酸的性質”作為實驗及探究活動[1]。人教版教材以銅絲、硝酸和NaOH溶液為實驗試劑,具支試管和燒杯為實驗儀器,裝置簡單、操作方便,但仍存在以下不足:(1)銅與濃硝酸反應產生大量NO2來不及吸收,逸散到空氣中,與沒有處理的具支試管中殘留的NO2,都會污染環境;(2)銅與稀硝酸反應時,具支試管中的空氣會將生成的NO瞬間氧化為NO2,觀察不到無色氣體NO的生成;(3)若驗證NO與氧氣反應生成NO2,或進行尾氣處理時將NO氧化為NO2,都需取下橡膠塞,此時會有氮氧化物逸出,污染環境;(4)無防倒吸裝置,可能導致NaOH溶液被吸入具支試管,使實驗失敗。為了解決上述問題,筆者提出了新的想法,從實驗試劑和裝置兩個方面對銅與濃、稀硝酸反應進行改進。
2? 相關文獻簡評
查閱大量的文獻,發現研究主要集中在以下幾個方面:(1)銅與稀硝酸反應時排除氧氣的干擾[2,3],利用CO2、在反應儀器中裝滿稀硝酸或者壓縮反應裝置排出空氣;(2)銅與濃硝酸反應的一體化設計[4,5],但實驗儀器不常見;(3)銅與濃、稀硝酸反應實驗的連續化設計[6,7],即把銅和濃、稀硝酸兩個反應整合在一起,對比鮮明,但操作復雜;(4)實驗微型化、綠色化設計[8,9],實驗裝置常見易得,但功能比較單一。
基于文獻,本文對“硝酸的性質”實驗進行了改進,利用多孔泡沫銅和注射器,設計了操作簡單、現象明顯的簡易實驗裝置。銅與稀硝酸反應時,利用注射器壓縮多孔泡沫銅,排除裝置中的空氣。吸入稀硝酸后,觀察到溶液變成藍色的同時,注射器活塞向上移動明顯,說明有NO無色氣體生成。產物NO氧化為NO2及NaOH吸收尾氣都在密閉裝置中進行,不會污染教學環境;銅與濃硝酸反應生成NO2, NO2與水反應生成硝酸和NO,以及硝酸的檢驗和廢液處理整合為一體,無需拆卸裝置,整個過程沒有任何氣體逸出。改進后的實驗有利于學生理解不同濃度的硝酸與銅反應的產物也不同,并進一步鞏固氮氧化物之間的轉化。
3? 實驗部分
3.1? 實驗儀器及試劑
實驗儀器:不同規格注射器(5mL 3個,20mL 2個)、三通閥、具支U型管(15×150mm)1個、氣球、橡膠塞
實驗藥品:泡沫銅、15mol/L濃硝酸、5mol/L稀硝酸、氧氣,飽和NaOH溶液、紫色石蕊溶液、蒸餾水
3.2? 銅與稀硝酸反應實驗
將泡沫銅放入注射器進行壓縮,不僅可以排除空氣,其多孔性也會增加與稀硝酸的接觸面積加快反應。借助三通閥,將一氧化氮的制取、氧化、尾氣吸收等實驗集于一體。
3.2.1? 實驗裝置
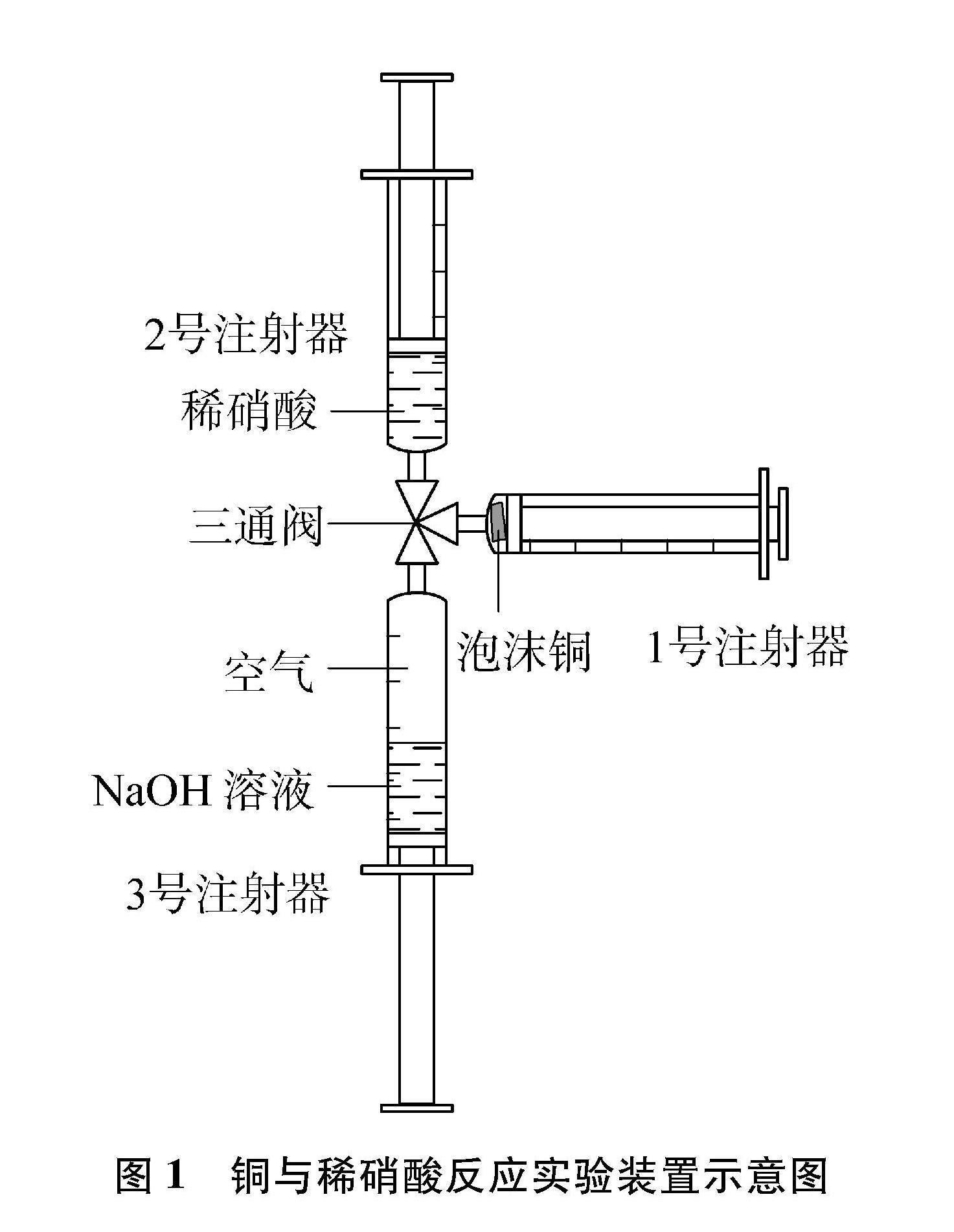
實驗裝置如圖1所示。
3.2.2? 實驗步驟及現象
(1) 按圖1組裝實驗儀器并檢查其氣密性,3個注射器均為5mL。
(2) 剪取一小塊泡沫銅置于1號注射器,并將注射器活塞推至最底部以完全擠出空氣;然后取5mol/L稀硝酸2mL于2號注射器;2mL飽和NaOH溶液于3號注射器,并吸入3mL空氣;最后將3只注射器用三通閥連接并固定起來。
(3) 旋轉三通閥,使1、 2號注射器連通,緩慢向外拉1號注射器活塞,2號注射器里的稀硝酸進入1號注射器與泡沫銅發生反應,觀察到無色溶液變成藍色[3Cu+8HNO3(稀)2NO↑+3Cu(NO3)2+4H2O]。同時,1號注射器活塞向外移動明顯,說明產生了無色氣體。反應前后溶液顏色對比鮮明,學生可在較短時間內觀察到實驗現象。
(4) 再次旋轉三通閥,使1、 3號注射器連通,緩慢向外拉1號注射器,
緩慢推進3號注射器,1號注射器內
無色氣體立即變成紅棕色(2NO+O22NO2)。然后擠入飽和NaOH溶液處理尾氣和廢液,紅棕色消失(2NO2+2NaOHNaNO3+NaNO2+H2O),有藍色沉淀產生[Cu(NO3)2+2NaOHCu(OH)2↓+2NaNO3]。
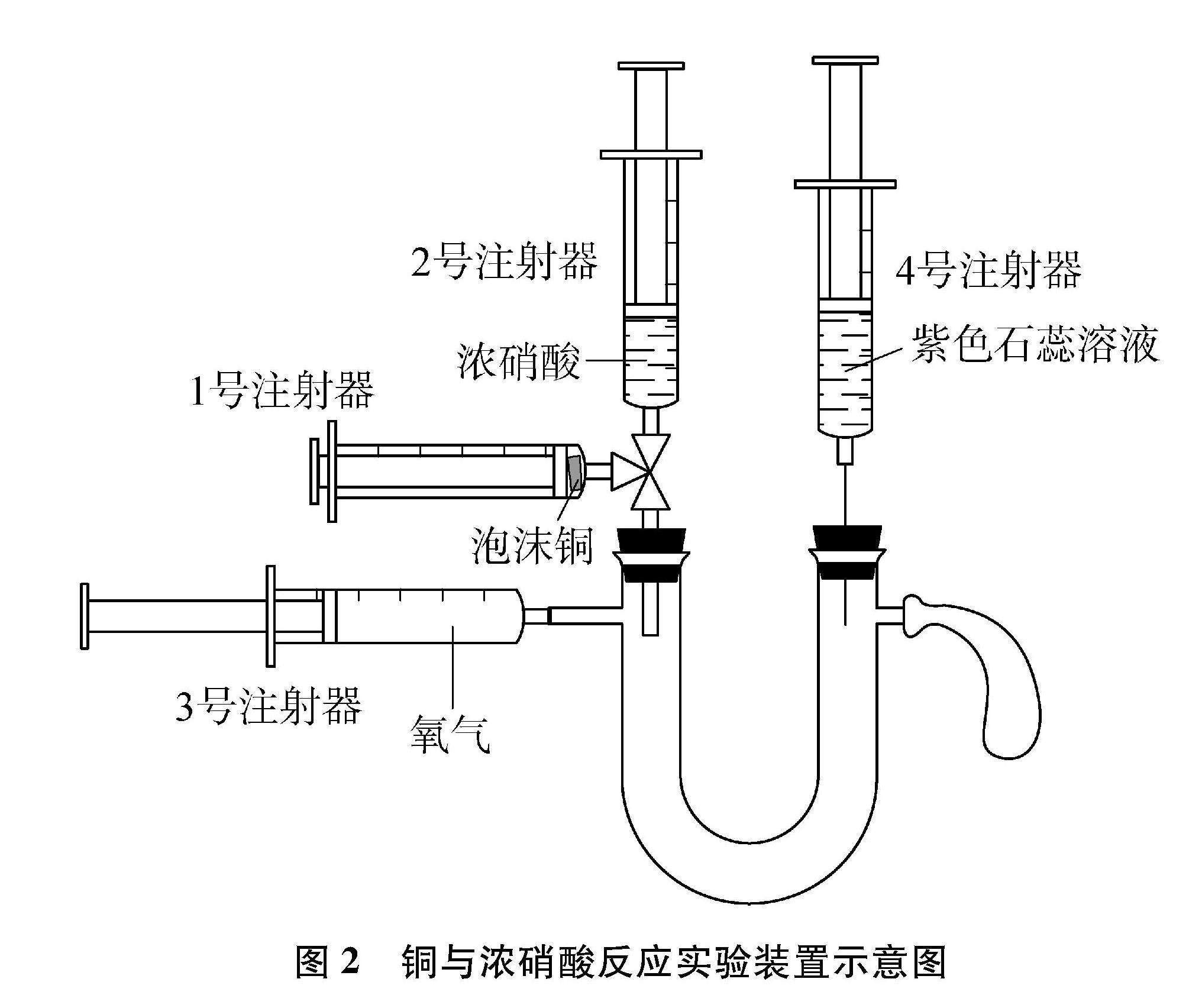
利用上述實驗裝置完成銅與稀硝酸的反應,通過吸入空氣,注射器中出現紅棕色,證明前產物是NO,也說明稀硝酸具有氧化性。為進一步說明銅與濃、稀硝酸反應的不同,設計了泡沫銅與濃硝酸反應的實驗裝置如圖2所示。利用該裝置可以完成銅與濃硝酸的反應,并借助具支U型管,完成NO2與水反應的實驗探究,實現該裝置的多功能性。
3.3? 銅與濃硝酸反應實驗
3.3.1? 實驗裝置
在圖1實驗裝置基礎上,無氧條件下,利用注射器探究銅與濃硝酸的反應;借助三通閥將產物硝酸銅和NO2分離,并將NO2擠入具支U型管,探究NO2與水反應的產物以及NO和NO2之間的轉換。
3.3.2? 實驗步驟及現象
(1) 按圖2組裝實驗儀器并檢查其氣密性。1號和3號注射器為20mL,2號和4號注射器為5mL。
(2) 1號注射器中放入泡沫銅并壓縮,取2mL濃硝酸置于2號注射器,連接三通閥。3號注射器吸入事先制備的氧氣約20mL,4號注射器吸取3mL紫色石蕊溶液,連接在具支U型管上。接著將氣球套在具支U型管的支管口處,平衡氣壓。
(3) 旋轉三通閥,連通1號、2號注射器,緩慢向外拉1號注射器吸入濃硝酸。在無氧條件下吸入的濃硝酸與泡沫銅立即發生反應,活塞向外移動,注射器中出現紅棕色,證明產生了NO2,并觀察到無色溶液變成綠色[Cu+4HNO3(濃)2NO2↑+Cu(NO3)2+2H2O]。
(4) 將綠色溶液壓回2號注射器后,旋轉三通閥,使1號注射器與具支U型管相通,將1號注射器中的紅棕色氣體壓入具支U型管。將4號注射器中的紫色石蕊溶液滴入具支U型管中,溶液變紅,紅棕色消失,說明NO2與水發生反應生成HNO3和NO(3NO2+H2O2HNO3+NO)。利用3號注射器向具支U型管中注入約10mL氧氣,具支U型管中紅棕色復現,說明NO與O2反應重新生成NO2(2NO+O22NO2)。
(5) 最后注入過量氧氣,使生成的NO全部氧化為NO2。并將2號注射器里的綠色溶液全部注入具支U型管,再通過2號注射器加入適量飽和NaOH溶液,紅棕色消失(2NO2+2NaOHNaNO3+NaNO2+H2O),出現藍色沉淀[Cu(NO3)2+2NaOHCu(OH)2↓+2NaNO3],紅色石蕊重新變成紫色,完成尾氣吸收和廢液處理。
3.4? 注意事項
(1) 實驗前要進行裝置的氣密性檢查,防止銅與濃、稀硝酸反應產物氮氧化物的泄漏,對環境造成污染。銅與稀硝酸反應實驗還要防止空氣對實驗造成干擾。
(2) 濃硝酸具有腐蝕性和揮發性,實驗過程中戴好手套和口罩。
3.5? 實驗總結
(1) 選擇注射器、三通閥搭建實驗裝置,使操作簡單快速。泡沫銅代替銅絲或銅片,增大稀硝酸與銅的接觸面積,無需預熱也能加快反應速率。
(2) 銅與濃、稀硝酸各步反應的實驗都整合為一體,在密閉體系中進行,無需拆卸裝置,沒有氣體泄漏危險,體現了環保理念。
(3) 在短時間內既能完成硝酸的氧化性實驗,探究銅與濃、稀硝酸反應產物的不同,又能鞏固氮氧化物之間的轉化:NO氧化為NO2, NO2與水反應生成硝酸和NO。用紫色石蕊溶液檢驗硝酸的生成、NaOH溶液進行尾氣吸收和廢液處理,有利于培養學生良好的科學探究核心素養。
(4) 可改變注射器大小以適應各類實驗的需要,可用于教師演示實驗,又可用于學生分組實驗。
(5) 實驗裝置簡單,泡沫銅也易于購置,儀器和未反應完的泡沫銅都可以重復使用。操作步驟合理簡潔,現象明顯,重現性好,顏色變化鮮明,有利于激發學生興趣。
參考文獻:
[1]中華人民共和國教育部制定. 普通高中化學課程標準(2017年版2020年修訂)[S]. 北京: 人民教育出版社, 2020: 16.
[2]李德前, 魏海, 張羿. “銅與稀硝酸反應”一體化實驗設計[J]. 化學教學, 2020, (9): 70~72.
[3]魏海, 李德前. “雙注射器組合裝置”的制作與應用——以銅與硝酸反應的系列實驗為例[J]. 化學教學, 2020, (11): 69~71.
[4]賀紫檸, 李忠恒. 銅與濃硝酸反應實驗裝置的新設計[J]. 化學教學, 2023, (8): 67~69, 76.
[5]楊頔, 靳紅旗, 于善亮. 銅與濃硝酸反應的裝置設計及現象研究[J]. 化學教育, 2014, 35(11): 77~78.
[6]劉江, 趙寧東, 劉俊等. 基于智能手機的銅和硝酸反應實驗過程可視化設計[J]. 化學教學, 2020, (6): 72~74.
[7]楊香濤, 阮方來. 銅與濃、稀硝酸反應實驗的整合設計[J]. 化學教學, 2019, (10): 70~72.
[8]譚文生. 銅與濃、稀硝酸反應實驗的綠色化設計[J]. 化學教學, 2012, (11): 45~46.
[9]張正飛, 柏書梅. 利用膠頭滴管演示銅與硝酸的反應[J]. 化學教學, 2010, (2): 8.

