東紫蘇精油對間充質干細胞C3H10T1/2成脂分化的影響及機制
張夢媛,徐芳,柏樺,鄒偉,劉曉穎,王琦
(昆明醫科大學公共衛生學院,云南昆明 650500)
肥胖癥(obesity)是由于能量攝取與消耗之間的不平衡而導致的可損害健康的異常或過多的脂肪積累,脂質代謝障礙可導致肥胖[1]。脂質代謝異常也與某些疾病密切相關,如動脈硬化、糖尿病、肥胖、老年癡呆癥(Alzheimer′s disease,AD)以及腫瘤的發生和發展[2]。越來越多的證據表明,天然植物中提取的活性成分如茶葉中多酚類化合物[3]、小粒咖啡中咖啡因[4]、苦蕎黃酮[5]、槲皮素[6]等都有減脂功效,其成為減脂功能食品開發的重要研究方向。
東紫蘇(ElsholtizabodinieriVaniot),屬于唇形科(Lamiaceae)香薷屬(Elsholtzia)植物[7],別名鳳尾茶、小山茶、云松茶、牙刷草、野山茶等,是源自云南的特色藥食兩用資源,滇南地區居民常將東紫蘇泡水作為一種日常飲用的茶類飲料,認為其可以祛除火氣。東紫蘇含精油、黃酮類、三萜類、酚類等成分[8],具有抗氧化、抗癌、抗炎、抗病原微生物、解熱、鎮痛、解痙攣、增強免疫力等功效[9]。東紫蘇精油作為其中的主要活性物質之一,生物活性研究報道較少。課題組前期優化提取條件并確定東紫蘇精油成分后,以秀麗隱桿線蟲為模式生物,通過轉錄組學研究發現,秀麗隱桿線蟲參與脂肪酸代謝的9 個基因發生了變化,其中D2063-1、acs-2、sodh-1、sodh-2、alh-5、acdh-76 個基因表達上調,acdh-1、F25C8-1、acox-533 個基因表達下調,改變的基因隸屬于NHR49 脂肪酸分解代謝通路[10]。為進一步證明東紫蘇精油的減脂效果,本研究以C3H10T1/2 成脂細胞為研究對象,初步探討東紫蘇精油對細胞內脂質代謝的影響和作用機理,以期為東紫蘇的食物開發和藥用研究提供參考依據。
1 材料與方法
1.1 材料與試劑
小鼠間充質干細胞C3H10T1/2:中國科學院細胞庫。干燥東紫蘇:云南省紅河州建水縣。東紫蘇精油由本實驗室提取[東紫蘇全草打碎,過100 目篩,提取條件:料液比1∶6(g/mL)、浸泡2 h、600 W 微波無溶劑提取1 h]。
奧利司他:北京索萊寶科技有限公司;四季青無支原體優級胎牛血清、蛋白酶抑制劑、RIPA 裂解液、0.25%胰酶:大連美侖生物技術有限公司;3-異丁基-1-甲基黃嘌呤(3-isobutyl-1-methylxanthine,IBMX)、牛胰島素、地塞米松、羅格列酮、3,3′,5 三碘代-L-甲狀腺原氨酸(3,3′,5-triido-L-thyronine,T3)、吲哚美辛、谷氨酸酰胺、丙酮酸鈉溶液、非必需氨基酸:美國Sigma 公司;油紅O、MTT、最低必須培養基(minimum essentiamedium,MEM)培養液:武漢賽維爾生物科技有限公司;總膽固醇(total cholesterol,TC)、甘油三酯(triacylglyceride,TG)檢測試劑盒、總RNA 抽提試劑(total RNA extraction reagent,TRizol):南京建成生物工程研究所;SYBRPremixEXTaqⅡ:美國MCE 公司;cDNA 第1 鏈合成試劑盒:天根生化科技(北京)有限公司;過氧化物酶體增殖物激活受體γ(peroxideproliferator-activated receptorγ,PPARγ)兔抗、CCAAT 增強子結合蛋白α(CCAAT/enhancer-bindingproteinsα,C/EBPα)兔抗、脂肪酸結合蛋白4(fattyacid-bindingprotein4,FABP4)兔抗、辣根過氧化物酶(horseradish peroxidase,HRP)標記的羊抗兔IgG 二抗:山東華安科技生物有限公司。聚合酶鏈式反應(polymerase chain reaction,PCR)上游引物及下游引物:生工生物工程(上海)股份有限公司。
1.2 儀器與設備
Nikon TS2R 研究級熒光倒置顯微鏡:日本尼康公司;Amersham GE 超靈敏多功能成像儀:美國GE 公司;LC96 實時熒光定量PCR 儀:瑞士Roche 公司;Synergy H1 多功能酶標儀:美國寶特公司;DryDIST 植物精油提取儀:意大利milestone 公司;5% CO2細胞培養箱:賽默飛世爾科技有限公司。
1.3 方法
1.3.1 細胞培養、誘導
1)C3H10T1/2 細胞培養:將含有10%胎牛血清及谷氨酸酰胺、丙酮酸鈉100 mmol/L 溶液、非必需氨基酸的MEM 培養基置于37 ℃的5% CO2細胞培養箱中培養,用0.25%胰酶消化傳代。
2)C3H10T1/2 細胞成脂分化誘導:取對數生長期的C3H10T1/2 細胞于6 孔板培養,5×104個/mL 接種,分為空白對照組、高脂模型組、精油處理組、陽性對照奧利司他組,生長5 d 中間不換液,第6 天空白對照組換培養液,剩余組加入誘導液I 液(含0.5 mol/L IBMX、2.5 mmol/L 地塞米松、344.38 μmol/L 胰島素、1mmol/L羅格列酮、30.72 μmol/L T3、125 μmol/L 吲哚美辛)培養2 d,第8 天空白對照組換培養液,剩余組換誘導液II 液(含344.38 μmol/L 胰島素、1 mmol/L 羅格列酮、30.72 μmol/L T3),繼續培養2 d,第10 天空白對照組換培養液,剩余組再次換誘導液II 液培養2 d,第12 天空白對照組、高脂模型組換培養液,精油處理組加含不同濃度精油的培養液,陽性對照組加含奧利司他的培養液,均處理48 h(成脂誘導劑包括誘導I、II液,參照文獻[11]進行配制)。
1.3.2 指標檢測
1)東紫蘇精油、奧利司他對細胞增殖的影響:C3H10T1/2 細胞以1×104/mL 的密度、200 μL/孔接種于96 孔板,在37 ℃培養箱中培養24 h 后加入不同濃度(0、100、200、400、800、1 600 μg/mL)的東紫蘇精油和不同濃度(0、1、5、25、125、625 μg/mL)的奧利司他繼續培養,各組3 個復孔,48 h 后棄培養液,每孔加入20 μL MTT 孵育4 h,棄MTT,加入150 μL 二甲基亞砜(methyl sulfoxide,DMSO)低速振蕩10 min,在570 nm 波長處用酶標儀測量吸光度,細胞存活率(X,%)計算公式如下。
式中:A1為實驗孔吸光度;A0為對照孔吸光度。
2)油紅O 染色分析:細胞經上述方法誘導處理后棄上清,預冷磷酸鹽緩沖溶液(phosphate buffer saline,PBS)洗2~3 次,用4% 多聚甲醛固定液室溫下固定15 min,PBS 洗2~3 次。60%異丙醇通透30~60 s,PBS洗2~3 次,加油紅O 染液于室溫下避光染色30 min,PBS 洗2~3 次,拍照記錄分析。
3)甘油三酯(TG)、總膽固醇(TC)測定:對數生長期兩種細胞按5×104個/mL 接種于6 孔板,成脂誘導后加精油、奧利司他處理48 h,棄培養液后用PBS 洗2~3 次,每孔加入200 μL 裂解液并將細胞從培養板上刮下(以上操作在冰上進行),超聲破碎勻漿后以2 000 r/min 離心10 min,將上清液轉移至新的1.5 mL的微量離心管(eppendorf micro test tubes,EP)中待測。按試劑盒說明書測定甘油三酯、總膽固醇含量。
4)熒光定量PCR 檢測mRNA 表達:培養方法同3),按照試劑盒說明書步驟抽提總RNA,并逆轉錄合成cDNA。參照試劑盒說明書要求,反應體系:上游引物1 μL、下游引物1 μL、cDNA 模板2 μL、ddH2O 6 μL、SYBRPremixEXTaqⅡ10 μL。94 ℃預變性30 s,95 ℃變性5 s,50~60 ℃退火15 s,72 ℃延伸15 s,共40 個循環。每組樣本設3 個復孔,2-ΔΔCt計算各基因轉錄水平差異。引物序列如表1 所示。
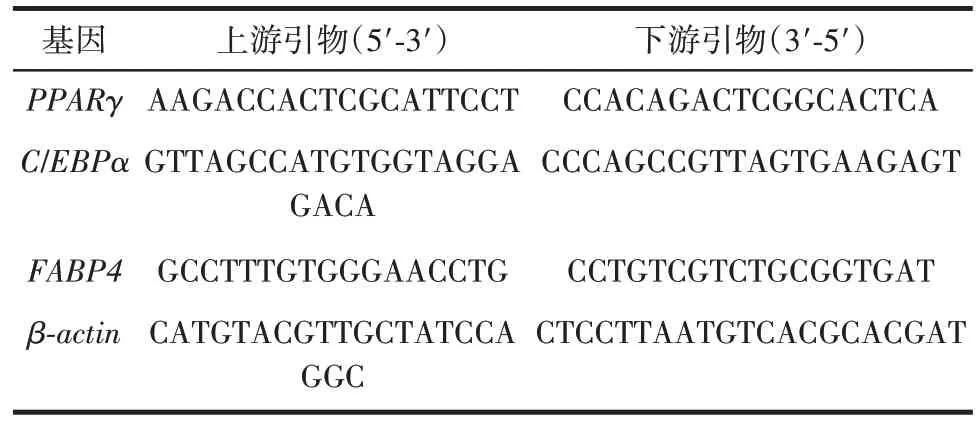
表1 引物序列Table 1 Primer sequence
5)Western blot 檢測蛋白表達:細胞培養處理一定時間后,加入含有1%蛋白酶抑制劑的RIPA 裂解液裂解細胞,采用二喹啉甲酸法(bicinchoninic acid assay,BCA)法檢測總蛋白濃度。蛋白上樣十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(sodium dodecyl sulfate-polyacrylamidegel electrophoresis,SDS-PAGE)后,以濕轉法轉移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,無蛋白酶快速封閉液封閉,一抗4 ℃孵育過夜,洗膜后加入HRP 標記的二抗室溫孵育2 h,化學發光液顯影,掃描成像保存分析。
1.4 數據處理
統計分析采用GraphPadPrism5.0 和SPSS17.0 兩種軟件,采用單因素方差分析組間差異,以P<0.05 表示差異具有統計學意義。
2 結果與分析
2.1 東紫蘇精油對C3H10T1/2 細胞存活率的影響
MTT 實驗測不同濃度精油、奧利司他對C3H10T1/2細胞存活率的影響,結果如圖1 所示。
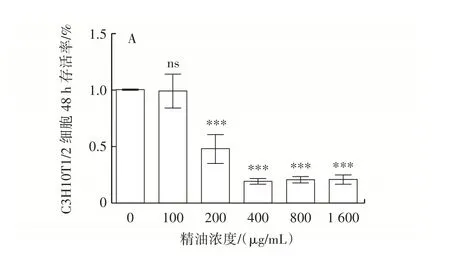
圖1 東紫蘇精油、奧利司他對C3H10T1/2 細胞存活率的影響Fig.1 Effect of essential oil from Elsholtiza bodinieri Vaniot and orlista on survival of C3H10T1/2 cells
由圖1 可知,精油及奧利司他濃度分別小于100 μg/mL 和25 μg/mL 時,對C3H10T1/2 細胞的增殖活性與空白對照組相比幾乎沒有影響(P>0.05);但濃度為200~1 600 μg/mL 的精油,125~625 μg/mL 奧利司他能降低C3H10T1/2 細胞的存活率且呈現一定的劑量依賴性。因此,選擇25、50、100 μg/mL 精油,25 μg/mL奧利司他進行后續C3H10T1/2 細胞減脂試驗研究。
2.2 東紫蘇精油對C3H10T1/2 細胞脂滴變化的影響
精油和奧利司他作用于C3H10T1/2 細胞后,觀察其成脂分化后發現,成脂誘導劑會使C3H10T1/2 細胞的形態和體積發生不同程度的改變,脂滴增多,脂肪細胞增多。經過不同濃度的精油、奧利司他處理并進行油紅O 染色,結果如圖2 所示。
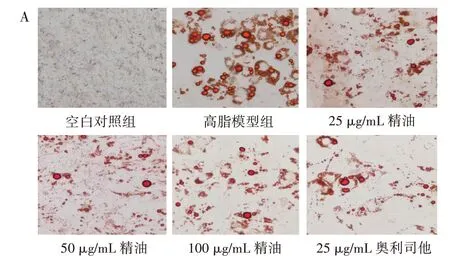
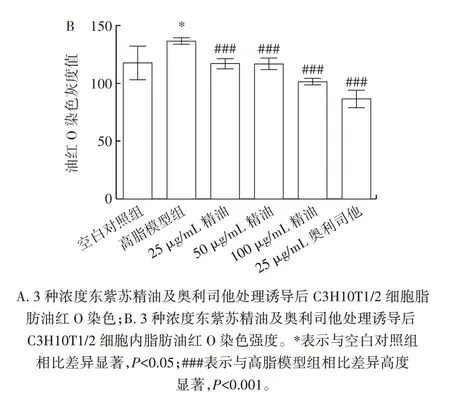
圖2 東紫蘇精油對C3H10T1/2 細胞脂滴變化的影響Fig.2 Effect of essential oil from Elsholtiza bodinieri Vaniot on lipid droplet of C3H10T1/2 cells
由圖2 可知,空白對照組未觀察到脂滴或脂肪細胞;高脂模型組經油紅O 染色后,視野下呈現出深紅色的即為脂肪細胞;與高脂模型組相比,低濃度(25 μg/mL)精油對C3H10T1/2 細胞的成脂分化作用并不明顯,在中濃度(50 μg/mL)精油的作用下,油紅O 深染的脂肪細胞和脂滴依然可見,但脂肪細胞的體積在縮小,而高濃度(100 μg/mL)精油和陽性對照奧利司他組與高脂模型組相比脂滴減少,脂肪細胞縮小。
2.3 東紫蘇精油對C3H10T1/2 細胞TC、TG 的影響
精油和奧利司他對C3H10T1/2 細胞成脂分化后甘油三酯和總膽固醇含量的影響如圖3 所示。
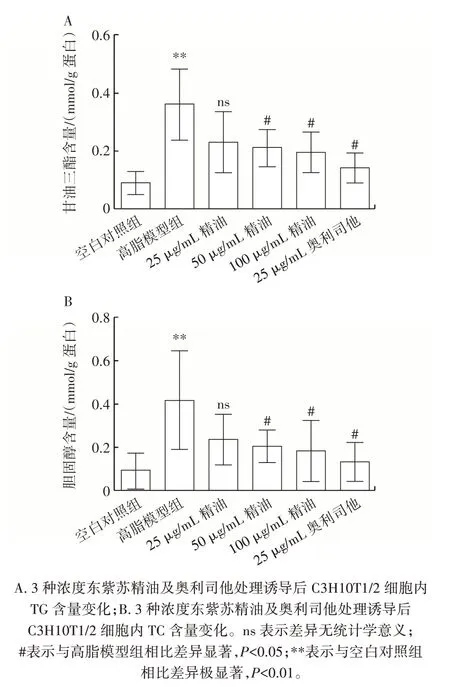
圖3 東紫蘇精油對C3H10T1/2 細胞甘油三酯、膽固醇含量的影響Fig.3 Effect of essential oil from Elsholtiza bodinieri Vaniot on triglyceride and cholesterols in C3H10T1/2 cells
由圖3 可知,高脂模型組甘油三酯、膽固醇含量較空白對照組極顯著增加(P<0.01);精油、奧利司他處理組與高脂模型組相比,C3H10T1/2 細胞中甘油三酯和總膽固醇的含量可以明顯降低,其中25 μg/mL 精油處理組沒有統計學上的差異。
2.4 東紫蘇精油調節C3H10T1/2 細胞的成脂分化標志因子和關鍵轉錄因子基因表達
精油和奧利司他對C3H10T1/2 細胞成脂分化標志因子和關鍵轉錄因子mRNA 表達的影響如圖4 所示。
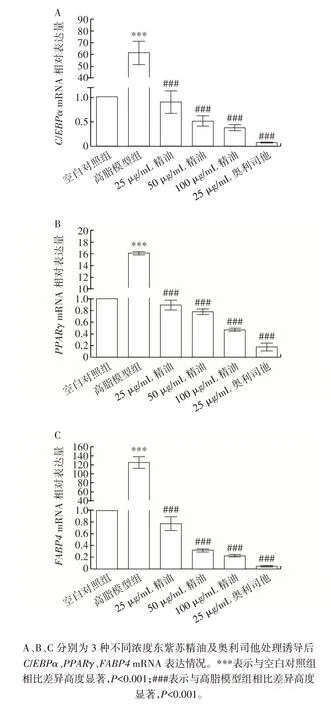
圖4 東紫蘇精油對C3H10T1/2 細胞脂質代謝相關基因表達的影響Fig.4 Effect of essential oil from Elsholtiza bodinieri Vaniot on expression of genes related to lipid metabolism in C3H10T1/2 cells
由圖4 可知,與空白對照組相比,高脂模型組PPARγ、C/EBPα和FABP4mRNA 表達高度顯著增加(P<0.001),精油、奧利司他處理組與高脂模型組相比,成脂分化標志因子和關鍵轉錄因子的表達均有高度顯著降低(P<0.001),且呈現一定劑量依賴的作用。
2.5 東紫蘇精油調節C3H10T1/2 細胞的成脂分化標志因子和關鍵轉錄因子蛋白表達
精油和奧利司他對C3H10T1/2 細胞的成脂分化標志因子和關鍵轉錄因子蛋白表達的影響如圖5所示。
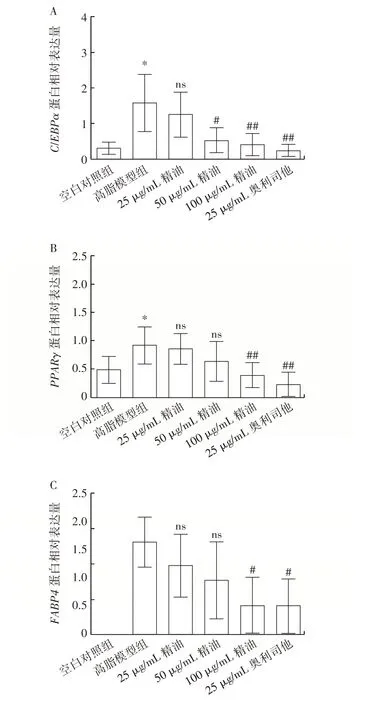
圖5 東紫蘇精油對C3H10T1/2 細胞脂質代謝相關蛋白表達的影響Fig.5 Effect of essential oil from Elsholtiza bodinieri Vaniot on expression of proteins related to lipid metabolism in C3H10T1/2 cells
由圖5 可知,與空白對照組相比,高脂模型組的成脂關鍵轉錄因子PPARγ和C/EBPα表達均有所上升,精油、奧利司他處理組與高脂模型組相比可明顯降低PPARγ、C/EBPα和FABP4蛋白的表達,其中在25 μg/mL 精油處理組中并無統計學上的差異。
3 討論與結論
植物精油(essential oil)是由植物天然合成的、具有揮發性的化合物所構成的混合油狀成分。植物精油具有抗氧化、抗腫瘤、殺蟲、抗炎、降血脂等作用[12-14]。課題組前期采用微波無溶劑萃取方法提取東紫蘇精油,氣相色譜-質譜(gas chromatography-mass spectrometry,GC-MS)檢測化學成分,結果顯示:主要成分為乙酸松油酯(56.25%)、β-氧化石竹烯(4.41%)、α-松油醇(2.91%)、1,8-桉葉油醇(0.51%)等。本實驗中發現東紫蘇精油通過降低C3H10T1/2 細胞中成脂基因和成脂蛋白的表達來減少脂滴的積累,表明東紫蘇精油能夠抑制C3H10T1/2 細胞的成脂分化。結合其化學成分,推測東紫蘇精油的降脂功能可能是其中一些活性成分共同作用的結果。有研究發現α-松油醇改善了高脂飲食大鼠的營養參數,重建胰島素敏感性,并降低血清促炎細胞因子TNF-α 和IL-1β 水平[12]。此外,α-松油醇還有抗氧化、抗高血壓、抗炎、抗肥胖和抗病毒活性[13-14]。石竹烯為雙環倍半萜型天然產物,主要包括α-石竹烯和β-石竹烯。β-石竹烯及其氧化物具有抗炎、抗癌、抑菌、抗氧化、止痛及降脂等生物活性;可抑制高糖環境下大腸癌細胞CT26 的增殖并促進其凋亡;在預防和治療非酒精性脂肪肝及其相關代謝紊亂方面具有潛在的功效[15-16]。1,8-桉葉油醇是東紫蘇精油的主要成分之一,具有抗炎、抑菌、抗氧化作用,桉葉油醇能減弱活性氧誘導的脂質過氧化,同時提高超氧化物歧化酶和過氧化氫酶等抗氧化酶的表達[17-19]。
間充質干細胞(mesenchymstemcells,MSCs)主要來自發育早期的中胚層。最初發現于骨髓中,在體內或體外特定的誘導條件下,可分化為脂肪、骨、軟骨、肌肉和肝細胞[20],成脂分化是MSCs 的一個重要分化方向,也是成體脂肪細胞更新的主要來源。間充質干細胞的成脂分化機制研究,可以幫助了解與脂肪代謝異常有關的疾病。
過氧化物酶體增殖物激活受體PPARs是配體激活的轉錄因子核受體超家族成員之一,包括氧化物酶體增殖物激活受體α(peroxideproliferator-activatedreceptor,PPARα)、氧化物酶體增殖物激活受體β/σ(peroxideproliferator-activatedreceptorβ/σ,PPARβ/σ)和PPARγ,是脂質代謝密切相關的轉錄因子,對脂肪酸和葡萄糖代謝、骨穩態、炎癥反應和其他過程有不同的影響。PPARγ能夠調控脂蛋白酯酶、激素敏感脂肪酶、乙酰輔酶A 合成酶等基因的表達,進一步調控脂代謝和脂肪酸氧化過程。在MSCs 分化過程中,PPARγ刺激脂肪細胞分化,抑制成骨細胞分化[21-23],被認為是脂肪細胞分化過程中必需的轉錄因子,PPARγ在脂肪細胞內脂滴積累中起關鍵作用。C/EBPα是堿性亮氨酸拉鏈蛋白家族的一個亞家族,是增強子結合蛋白家族中最早被發現的成員。有研究報道當C/EBPα的表達量增加時,可使前脂肪細胞向成熟脂肪細胞的分化速度加快,反之亦然。FABP4在脂肪細胞分化的后期表現極高,是細胞成脂分化的標志物之一[24-27]。
在脂肪細胞分化初期,C/EBPβ因子通過激活C/EBPα、PPARγ等因子,進入細胞分化期[28-30],C/EBPα結合并激活特異基因啟動子,脂肪細胞進入終末分化階段[31]。C/EBPα、PPARγ、FABP4的較高轉錄促使前脂肪細胞分化為成熟脂肪細胞,最終促使脂肪細胞增生。東紫蘇精油處理后在細胞分化初期C/EBPβ 激活并下調C/EBPα、PPARγ等因子,在進入脂肪細胞終末分化階段時下調FABP4,抑制前脂肪細胞分化為成熟脂肪細胞,最終抑制脂肪細胞生長,達到降脂目的。
本研究以C3H10T1/2 細胞建立高脂模型,從基因和蛋白質水平初步探討東紫蘇精油降脂機理。結果表明高脂模型組PPARγ、C/EBPα、FABP4mRNA 及蛋白表達與空白對照組相比均明顯升高,東紫蘇精油、奧利司他作用后與高脂模型組相比則降低。不同濃度東紫蘇精油均可抑制C3H10T1/2 細胞的成脂分化,且高濃度的抑制效果更好;東紫蘇精油可能通過調節PPARγ/C/EBPα信號通路發揮作用,但其具體機理及是否可以通過其他方式來達到降低脂肪的目的還需要后續深入系統的研究。

