糖類與甜味劑的腸-腦軸效應研究進展及評估方法分析
史清照,劉富強,張啟東,范 武,柴國璧,毛 健,2,王煥麗,姬凌波,馮偉華,宗國浩,曹培健,盧 鵬,謝劍平,2,*
(1.中國煙草總公司鄭州煙草研究院,河南 鄭州 450001;2.北京生命科技研究院,北京 102299)
喜愛甜味是人類的本能,人類在嬰兒時期就表現出明顯的甜味偏好[1],而甜味引發(fā)的大腦獎賞區(qū)域神經活動和多巴胺(dopamine,DA)的釋放則闡釋了這一現象的深層生物學機制[2-3]。人類文明初期,甜味主要源于鮮果、蜂蜜和其他植物中的天然小分子糖類。隨著農業(yè)和手工業(yè)的發(fā)展,世界各地先后以谷物、甘蔗、甜菜等為原料,創(chuàng)造性地開發(fā)出含有較高麥芽糖(飴)、蔗糖等糖類的甜食。《詩經》中有“周原膴膴,堇荼如飴”的詩句,以甜美的飴糖贊美周人的故土,可見早在周代飴糖已是生活中常見的食品。
隨著工業(yè)革命的發(fā)生,尤其是二戰(zhàn)后工業(yè)與農業(yè)、畜牧業(yè)的結合,全球越來越多的經濟體呈現食物和營養(yǎng)供給日益過剩的趨勢;由于對甜味的本能喜愛,高糖高甜度食品備受消費者青睞,但同時也帶來了諸如糖尿病、肥胖等健康問題。國際糖尿病聯盟(International Diabetes Federation,IDF)2021年統計數據顯示,全球糖尿病患病率持續(xù)增長,相比于2019年,2021年全球成年糖尿病患者人數增加了16%,約占全球成年人口的10.5%[4-5]。
在這一全球健康風險背景下,許多國家開始實施政策以降低本國居民的糖類攝入量[6]。我國各級政府機構已出臺多項政策或計劃,呼吁人們控制日常糖分攝入、倡導減糖生活。在各方倡導下,利用甜味劑代替糖類提供甜味感受的產品在食品產業(yè)界和消費者群體中受到更多關注。甜味劑通常以更少的劑量提供與糖類同等強度的甜味,同時不影響血糖水平,也不會導致肥胖、齲齒等健康問題,滿足了消費者獲取甜味享受和降低健康風險的雙重需求。目前全球范圍內無糖或低糖類產品數量迅速增加,這些產品都應用了不同類型的甜味劑。
甜味劑根據來源分為人工甜味劑和天然甜味劑兩種類型。1879年,美國約翰·霍普金斯大學研究人員偶然品嘗了所合成的產物,發(fā)現其具有強烈的甜味并將其命名為“糖精”,這是首個被發(fā)現并獲得大規(guī)模應用的人工甜味劑[7]。隨后甜蜜素、安賽蜜、阿斯巴甜和三氯蔗糖等不同類型的人工甜味劑陸續(xù)被開發(fā)出來,且無一例外出于實驗偶然。1979年,輝瑞公司投資開發(fā)出阿力甜,人工甜味劑進入更為理性的研發(fā)時代,且甜度獲得更大幅度的提升。1993年紐特公司開發(fā)出紐甜,2008年日本味之素公司開發(fā)出愛德萬甜,甜度分別達到了蔗糖的8 000 倍和20 000 倍[8-9]。伴隨各類人工甜味劑的廣泛應用,其在消化系統、神經系統、免疫系統和生殖系統等方面的安全性爭議不斷[10-12],近期國際癌癥研究機構將阿斯巴甜列為“可能對人類致癌的物質”,這一報道引起了人們對甜味劑安全性的廣泛關注。另一方面,環(huán)保主義和綠色消費理念則驅動著以糖苷類、糖醇類為代表的天然甜味劑快速發(fā)展。然而,天然甜味劑甜度相對偏低,又因原料產能限制導致生產成本相對較高,因此常與人工甜味劑搭配使用,改良產品風味。目前,人工甜味劑市場占有率仍顯著高于天然甜味劑。
盡管現有甜味劑能夠提供類似于糖類的風味感受和遠高于糖類的甜味強度,但仍舊不能完全替代食用糖類所帶來的滿足感。研究發(fā)現,甜味劑的攝入可能會讓人更想吃含糖的甜食[13],孕期攝入大量的甜味劑甚至會導致胎兒出生后對糖類食物產生更強烈的偏好,從而間接性地導致肥胖[14]。近二十年來,在動物行為學表現、大腦獎賞系統活動和關鍵神經通路激活模式等不同層面的研究中均發(fā)現人類或動物對糖類和甜味劑的行為偏好和腸-腦軸神經反應存在顯著差異,明確該現象及其深層生物學機制,對于完善甜味劑的功能評估體系和指導甜味劑的創(chuàng)新發(fā)展都具有十分重要的意義。本文綜述了糖類和甜味劑引發(fā)動物行為偏好差異及其生物學機制方面的研究進展;在此基礎上,從動物行為學特征、腦區(qū)神經活動模式和關鍵受體激活能力3 個角度提出了完善當前甜味劑功能評估體系的方法學建議,旨在為甜味劑的功能研究與創(chuàng)新發(fā)展提供參考。
1 糖類與甜味劑的腸-腦軸效應差異研究
1.1 糖類與甜味劑引發(fā)的動物行為偏好差異
大多數動物都會被甜味吸引,然而面對糖類和甜味劑,動物卻展現出明顯的選擇傾向性。在甜味受體發(fā)現之前,研究者認為味覺系統可能是導致動物對糖類和甜味劑產生偏好差異的主要原因[15-16]。然而,在針對小鼠的味覺測試中發(fā)現,蔗糖和非糖類甜味成分(甘氨酸或L-絲氨酸)同時存在時小鼠表現出對蔗糖的明顯偏好[17]。48 h雙瓶偏好實驗結果也顯示,實驗過程中小鼠消耗的葡萄糖比L-絲氨酸多[18]。在對蔗糖和三氯蔗糖的對比研究中也發(fā)現了小鼠對蔗糖的偏好,經過饑餓訓練的小鼠隨著時間推移,取食蔗糖的次數明顯增加[2]。雖然8%蔗糖溶液、0.3%甜菊糖苷溶液、10 mmol/L安賽蜜溶液、10 mmol/L三氯蔗糖溶液和10 mmol/L阿斯巴甜溶液均能引起小鼠明顯的甜味偏好,但是面對甜度相同的蔗糖和安賽蜜溶液時,相同時間內小鼠對蔗糖的消耗量顯著高于安賽蜜[19]。這種對糖和甜味劑的顯著偏好差異在24 h內即可出現,而48 h后小鼠幾乎只選擇糖溶液,從而出現完全的選擇傾向性[20]。
進而有研究者推斷,這種對糖類和非糖類甜味物質的行為偏好差異有可能來自不同成分與甜味受體結合能力的差異[17]。然而,甜味受體的發(fā)現以及甜味感知機制的相關研究成果推翻了這一假設[21-25]。人類感知甜味的能力由異源二聚體——味覺受體第一家族成員(taste receptor family 1 member,T1R)2/T1R3介導,敲除T1R3能夠去除小鼠感知甜味的能力[23,26-27]。Tan等[20]發(fā)現盡管T1R3敲除小鼠無法嘗到糖和安賽蜜的甜味,但它們卻依然能夠在糖和安賽蜜之間傾向性地選擇糖。分別將可引起野生小鼠最大偏好濃度的蔗糖、D-葡萄糖和3 種人工甜味劑(三氯蔗糖、安賽蜜和SC45647)溶液供給T1R3敲除小鼠時,48 h內小鼠對各溶液的行為偏好均消失;進一步將各溶液濃度提高到最大偏好濃度的5~10 倍時,T1R3敲除小鼠出現對蔗糖和D-葡萄糖的偏好,而對3 種人工甜味劑依然沒有產生偏好;此外,在胃內輸注蔗糖的同時,通過口腔供給小鼠風味溶液能使小鼠對風味溶液產生偏好,而將蔗糖替換為三氯蔗糖后,偏好則不能產生[28]。
瞬時受體電位離子通道蛋白5(transient receptor potential melastatin 5,TRPM5)、鈣穩(wěn)態(tài)調節(jié)蛋白(calcium homeostasis modulator,Calhm1)均是甜味信號的重要轉導元素,敲除TRPM5、Calhm1基因同樣可以阻斷甜味信號的轉導[29]。Zhang Yifeng等[30]發(fā)現敲除TRPM5小鼠對安賽蜜的偏好完全消失,而對于蔗糖和葡萄糖的舔舐次數雖有所降低,但仍然表現出行為偏好。類似的研究發(fā)現,TRPM5基因敲除小鼠保留了對蔗糖的偏好,但對三氯蔗糖的偏好消失[31]。Calhm1敲除小鼠每天消耗的蔗糖總量降低了一半,但依然形成了對蔗糖的偏好[32]。此外,以胃部灌注的方式對野生小鼠和TRPM5敲除小鼠分別進行蔗糖或三氯蔗糖刺激后,小鼠均僅對蔗糖產生偏好[2](圖1)。

圖1 糖和甜味劑的小鼠行為學差異Fig.1 Behavioral differences between sugars and sweeteners in mice
以上行為學實驗結果表明,糖類和甜味劑均可使正常小鼠產生甜味偏好,但是相比于甜味劑,小鼠更偏愛糖;敲除小鼠的甜味受體基因或甜味信號轉導基因均能阻斷人工甜味劑誘發(fā)的行為偏好,但不能阻斷其對糖的行為偏好。這些現象說明糖類和甜味劑使小鼠產生偏好的機制并不完全相同,存在一種不需要甜味受體參與、獨立于味覺系統的神經機制調控糖偏好的形成。
1.2 糖類與甜味劑引發(fā)的動物腦區(qū)活動差異
早先人們認為腸道和大腦僅通過激素進行信號傳遞,激素信號可以獨立于甜味感受刺激動物對糖的消費和偏好[33]。然而后來的研究表明,對膽囊收縮素A(小腸黏膜I細胞釋放的一種肽類激素)受體的藥理學抑制不會影響糖在胃內輸注引發(fā)的偏好[34]。生長激素釋放肽也曾被認為參與食物獎賞的過程,而Sclafani等[35]研究發(fā)現,生長激素釋放肽受體敲除同樣不會影響小鼠對糖的偏好,進而推翻了這一假設。
多項研究證明,大腦中DA釋放引發(fā)的獎賞效應參與了糖類攝入的中樞反應[36-37]。在攝入糖后,能夠監(jiān)測到伏隔核區(qū)域DA的釋放[38-40]。DA受體(D1和D2型受體)的藥理學抑制也能抑制糖的攝入或消除胃內輸注葡萄糖引發(fā)的條件性風味偏好[41-46]。DA信號也參與調節(jié)糖或其他營養(yǎng)物質如脂肪產生條件風味偏好的能力[47-49]。因此,糖引起DA獎賞環(huán)路響應是糖偏好的重要研究切入點。隨著相關研究的深入,糖激活大腦釋放DA的神經環(huán)路機制逐漸明晰。Mark等[50]發(fā)現胃內輸注聚糖溶液可以誘發(fā)腹側紋狀體和背側紋狀體釋放DA。口服和腸內輸注蔗糖的研究結果均顯示出中腦邊緣系統和黑質紋狀體系統神經元活性的增加和DA的釋放[51]。研究表明,敲除TRPM5基因小鼠依然對胃內注射D-葡萄糖產生了強烈的偏好,并且30 min內檢測到腹側紋狀體和背側紋狀體DA釋放量增多;在胃部注射機體不可代謝的葡萄糖類似物同樣能檢測到DA的釋放(雖然釋放量有所降低),這種特異性偏好證明D-葡萄糖可以獨立于味覺系統和能量產生行為偏好,并具有刺激腹側紋狀體和背側紋狀體釋放DA的能力[52]。以上研究揭示了與糖信號有關的兩條DA釋放環(huán)路:第一條是中腦邊緣系統,從腹側被蓋區(qū)(ventral tegmental area,VTA)投射到腹側紋狀體;第二條是黑質紋狀體系統,從黑質致密部投射到背側紋狀體。口服和胃內輸注蔗糖溶液均可激活上述兩個環(huán)路神經元,促進DA釋放[53]。
Tellez等[3]針對糖信號引起DA釋放的進一步研究發(fā)現,這兩條神經環(huán)路在感知糖和甜味劑的反應上存在差異:小鼠口腔攝入三氯蔗糖同時胃內輸注三氯蔗糖或葡萄糖均可引起腹側紋狀體釋放DA,然而只有胃內輸注葡萄糖時才能引起背側紋狀體釋放DA,這表明投射至背側紋狀體的DA神經元對糖具有選擇敏感性;摻入苦味劑的三氯蔗糖溶液同時胃內輸注葡萄糖能夠抑制腹側紋狀體釋放DA,而背側紋狀體仍有高水平的DA釋放量,這也間接說明了黑質紋狀體系統可能負責對糖產生獎賞反應,而中腦邊緣系統可能負責對糖和甜味劑引發(fā)的甜味產生獎賞反應(圖2)。Fernandes等[2]利用深腦鈣成像技術監(jiān)測胃內VTA多巴胺能神經元的活性,與胃內輸注三氯蔗糖相比,胃內輸注蔗糖可以在1~2 min內快速誘導VTA的DA神經元出現持續(xù)正向上調活性,這說明蔗糖胃內輸注引發(fā)的感覺信號從腸道到大腦的傳遞是十分迅速的,腸-腦之間可能存在一條“信息高速公路”支撐糖引發(fā)的感覺信號傳遞。
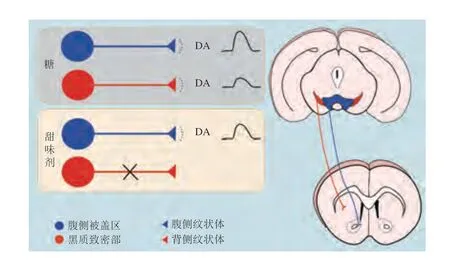
圖2 糖和甜味劑感知的多巴胺能獎賞環(huán)路Fig.2 Dopaminergic reward circuits for sugar and sweetener perception
1.3 糖類與甜味劑引發(fā)的腸-腦軸神經激活模式差異
Bohórquez等[54]通過激光掃描共聚焦顯微鏡觀察腸道內分泌細胞的神經纖維亞群時發(fā)現,一種特殊細胞亞群基部具有類似于神經元軸突的胞質突起,這些神經纖維亞群既可以作為吸收營養(yǎng)的平臺,也可以作為分泌激素的啟動平臺。這些腸道內分泌細胞的發(fā)現為解釋腸道和大腦的信號傳導機制開辟了新的研究路徑。該團隊進一步研究發(fā)現腸道內分泌細胞與神經元之間的突觸存在連接,這種突觸之間的信號傳遞可能比血液中的激素釋放信號更為直接,這些含有突起的腸道內分泌細胞被稱為neuropod細胞;進一步追蹤neuropod細胞的觸體發(fā)現,這些細胞十分接近小腸和大腸的個別神經纖維,同時60%的neuropod細胞會接觸感覺神經元,因此,推測這些neuropod細胞可能參與了腸道感覺信號的傳遞;狂犬病病毒通常被用作神經元單突觸連接的可視化工具,狂犬病病毒示蹤結果表明,結腸內的neuropod細胞能夠被狂犬病毒成功感染,說明該病毒可以從腸道內腔到達神經系統,因此neuropod細胞和腸道神經元之間的確存在聯系[55]。Kaelberer等[56]對neuropod細胞進一步研究發(fā)現,該細胞與迷走神經元之間形成的突觸可以傳遞蔗糖或葡萄糖引發(fā)的信號:葡萄糖能夠誘發(fā)neuropod細胞釋放谷氨酸,并且可以引發(fā)迷走神經元的興奮性突觸后電流;沉默neuropod細胞后,葡萄糖輸注誘導迷走神經在幾毫秒內的快速放電則被完全消除。這些研究結果表明,大腦在幾毫秒內接受來自腸道輸入的糖刺激取決于neuropod細胞的谷氨酸能信號傳遞,然而這群細胞在糖偏好中的作用及機制至此仍未明確。
腸道中最主要的葡萄糖轉運體是鈉-葡萄糖共轉運蛋白1(sodium-glucose cotransporter 1,SGLT1),在腸上皮細胞和腸內分泌表面均有表達。Kaelberer等[56]的研究證明SGLT1參與了葡萄糖或蔗糖刺激neuropod細胞釋放神經遞質谷氨酸的過程,抑制SGLT1會阻斷谷氨酸的釋放,而SGLT1對葡萄糖具有選擇性,人工甜味劑并不能激活SGLT1。Tan等[20]從神經元活動的角度證明了SGLT1的激活能夠激活對葡萄糖攝入響應的神經元,抑制SGLT1能夠阻斷對葡萄糖攝入偏好的形成。這些研究表明糖類攝入信號的腸-腦軸信號傳遞需要SGLT1參與。
Buchanan等[57]基于neuropod細胞和SGLT1受體深入研究了糖和人工甜味劑的偏好行為:近端小腸注入蔗糖、葡萄糖類似物和人工甜味劑均會快速引發(fā)迷走神經反應,沉默neuropod細胞后迷走神經反應相應消失,這表明3 類甜味物質引發(fā)的迷走神經反應均依賴于neuropod細胞。阻斷SGLT1可消除蔗糖和葡萄糖類似物誘發(fā)的迷走神經反應,而阻斷T1R3僅能消除人工甜味劑誘發(fā)的迷走神經反應;利用活體雙光子成像和受體抑制實驗確定了neuropod細胞分別通過釋放谷氨酸和腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)兩種不同的神經遞質將蔗糖和人工甜味劑的腸道刺激傳遞到迷走神經的不同神經元亞群;分別提供給小鼠含有三氯蔗糖溶液和同等甜度的蔗糖溶液,小鼠表現出對蔗糖的偏好,抑制neuropod細胞或谷氨酸受體均會導致小鼠對蔗糖的偏好消失。以上研究表明,小鼠的糖偏好取決于neuropod細胞,neuropod細胞分別依賴SGLT1和甜味受體T1R3分辨出糖和人工甜味劑信號。糖類和人工甜味劑會刺激neuropod細胞分別釋放谷氨酸和ATP作為神經遞質,通過釋放不同的神經遞質激活迷走神經的不同神經元亞群,進而讓大腦分辨糖和人工甜味劑。
孤束尾核(caudal portion of solitary tract nucleus,cNTS)是機體內部感知信號向大腦傳遞的中繼器。研究表明,不同的cNTS神經元亞群可被十二指腸或胃內的葡萄糖或甲基-α-D-吡喃葡萄糖苷激活,而糖精則無法激活cNTS[58-59]。利用腺病毒攜帶的破傷風毒素阻斷被糖激活的cNTS神經元突觸傳遞功能后,小鼠對于糖的偏好消失,因此可以認為cNTS是小鼠對葡萄糖產生偏好的重要中繼。切斷雙側迷走神經可阻斷cNTS神經元被激活,這表明糖攝入信號的傳遞需要通過迷走神經,進而通過迷走神經結狀神經元傳遞信號并激活cNTS神經元[20]。
至此,糖類攝入信號在腸-腦軸傳遞的神經通路基本明晰,口腔攝入的糖類和甜味劑均能激活位于口腔的甜味受體細胞,將信息傳遞至中腦邊緣DA系統刺激腹側紋狀體DA的釋放。但進入胃和近端小腸(十二指腸)后,糖類和人工甜味劑則出現了明顯差異。蔗糖或葡萄糖等能夠與腸道內neuropod細胞表面SGLT1受體結合,neuropod細胞軸突釋放谷氨酸激活迷走神經,迷走神經的結狀神經元亞群通過單突觸繼續(xù)將糖攝入的信息傳遞到腦干cNTS神經元,進一步激活黑質紋狀體系統背側紋狀體DA的釋放。而人工甜味劑則與neuropod細胞表面的甜味受體T1R3結合,使neuropod細胞軸突釋放神經遞質ATP將信息傳遞到迷走神經,但并不引發(fā)腦干cNTS神經元的響應(圖3)。因此,大腦可以辨別糖和甜味劑從而使個體表現出行為偏好的差異。
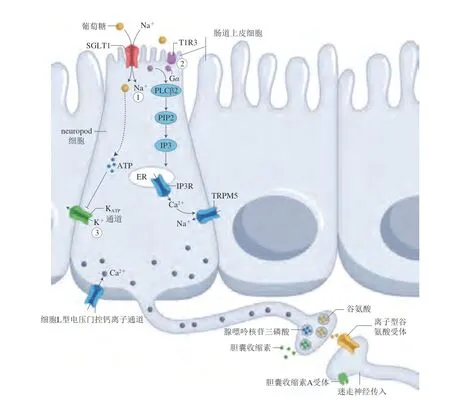
圖3 腸道neuropod細胞識別糖和甜味劑的分子機制[53]Fig.3 Molecular mechanisms of discrimination between sugars and sweeteners by gut neuropod cells[53]
2 基于腸腦軸效應的甜味劑功能評估和創(chuàng)新研發(fā)的新方法
甜味劑和糖類的腸-腦軸效應差異是決定甜味劑能否產生長時程行為偏好的根本原因,這對于甜味劑的功能評估和創(chuàng)新研發(fā)意義重大。目前對是否所有的甜味劑都不能引發(fā)腸-腦軸效應尚未明確,同時新一代甜味劑研發(fā)更應該將引發(fā)腸-腦軸效應作為重要功能指標。因此,本文從3 個層面分別總結了甜味成分腸-腦軸效應相關的研究手段,提出了3 種可用于甜味劑腸-腦軸效應評估的方式,旨在為相關產業(yè)界開展甜味劑創(chuàng)新研發(fā)提供參考。
2.1 利用動物行為學表現的評估方式
行為學方法能夠簡便且直觀地表征動物行為偏好。雙瓶偏好實驗是行為學研究中面對類似問題最常用的實驗手段。例如利用野生小鼠、T1R3或TRPM5等基因敲除小鼠模型,并使用小鼠糖水偏好裝置,通過監(jiān)控相同時間內小鼠對含甜味劑溶液和糖溶液的消耗量或計算動物偏好指數(分析前100 次和后100 次動物舔舐甜味劑占總舔舐次數的百分比),即可有效量化小鼠對甜味劑的行為偏好。
行為學實驗可以設計兩種實施策略:一種是以野生小鼠為動物模型,監(jiān)測野生小鼠在葡萄糖和甜味劑之間的偏好選擇,如果小鼠在葡萄糖和甜味劑之間沒有行為偏好,則反映甜味劑和葡萄糖同樣具有激活腸-腦軸的能力(圖4)。另一種是以T1R3或TRPM5等基因敲除小鼠為動物模型,監(jiān)測小鼠在水和甜味劑之間的偏好選擇。T1R3和TRPM5基因的敲除分別阻斷了甜味感知和甜味信號傳導的通路,小鼠依然能夠形成對糖的偏好。因此,如果基因敲除小鼠形成了對甜味劑的偏好,即可反映該甜味劑具有激活腸-腦軸的能力。
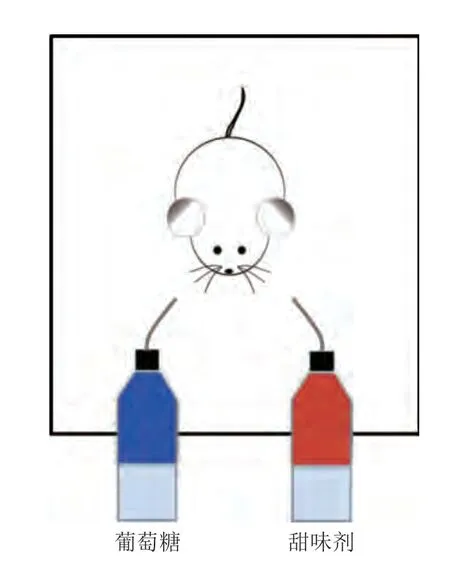
圖4 雙瓶偏好實驗[18]Fig.4 Two-bottle preference experiment[18]
結合野生小鼠、T1R3敲除小鼠或TRPM5敲除小鼠等動物模型,利用雙瓶偏好等行為學研究方法,能夠從功能層面有效評估新型甜味劑激活腸-腦軸的能力。行為學實驗具有設備要求低、實驗操作簡單、實驗周期短等優(yōu)勢,是一種低成本高效率的甜味劑腸-腦軸激活能力評估方式。
2.2 利用腦區(qū)神經活動檢測的評估方式
糖類可通過腸-腦軸激活中腦邊緣系統和黑質紋狀體系統釋放DA產生獎賞效應;而人工甜味劑如三氯蔗糖等僅能通過口腔甜味受體激活中腦邊緣系統產生獎賞效應。因此,可以通過黑質紋狀體系統多巴胺能神經元的激活或DA的釋放特征評估甜味劑是否具有激活腸-腦軸的能力。目前針對DA獎賞環(huán)路的研究較多,技術路線已經較為成熟。
DA神經元激活的研究方法常以DA受體標記(DATCre)的轉基因小鼠為動物模型,結合立體定位儀和微量注射裝置將能表征神經元活動的鈣熒光指示劑注射到黑質致密部,將鈣熒光蛋白特異性地表達在黑質致密部多巴胺能神經元上,利用光纖記錄或雙光子鈣成像等技術手段監(jiān)控胃內輸注甜味劑后多巴胺能神經元(群體神經元或單個神經元)熒光強度的變化規(guī)律,從而反映甜味劑激活腸-腦軸的能力(圖5)。通過cNTS神經元的激活也可以表征甜味劑是否具有激活腸-腦軸的能力,但孤束核位于腦干,相比于黑質紋狀體系統實驗操作難度較大。
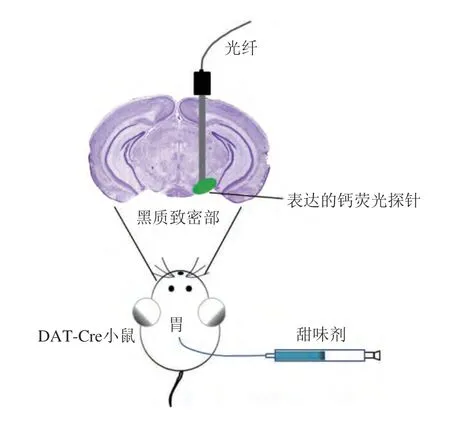
圖5 以DAT-Cre小鼠為動物模型利用光纖記錄甜味劑胃內輸注后DA神經元的活性[2]Fig.5 DAT-Cre mice as an animal model for fiber optic recording of DA neuron activity after intragastric infusion of sweeteners[2]
通過檢測黑質紋狀體系統背側紋狀體區(qū)域DA的釋放是獎賞環(huán)路研究另一個可選擇的技術。以C57BL/6小鼠(實驗室最常用的小鼠品系)為動物模型,將監(jiān)測神經遞質釋放的DA探針表達在背側紋狀體神經元上,利用光纖記錄手段,監(jiān)控胃內輸注甜味劑后代表性神經遞質DA釋放熒光強度的變化規(guī)律,進而反映甜味劑激活腸-腦軸的能力。
與行為學評估方法相比,利用腦區(qū)神經活動的評估方法能夠更為直觀地觀察到腦區(qū)神經活動,更加客觀地量化評價新型甜味劑腸-腦軸激活能力。但是,這些方法涉及到動物手術和腦區(qū)神經活動監(jiān)控技術,對其及設備要求相對較高;同時,所使用的生物探針表達時間周期較長,實驗的時間成本也相對較高。
2.3 利用關鍵受體激活能力的評估方式
SGLT1受體是糖類腸-腦軸信號產生的關鍵靶點,葡萄糖是SGLT1受體的特異性配體。葡萄糖通過與細胞表面的SGLT1受體結合可以引發(fā)胞內下游信號轉導和細胞活性的增加,導致胞內鈣離子濃度增高。近年來,受體蛋白的高效異源表達技術取得了巨大進步。異源表達細胞系統可以是人胚胎腎細胞(HEK-293)、幼倉鼠腎細胞(BHK)、綠猴腎細胞和中國倉鼠卵巢細胞(CHO)等[60-62]。當前已有研究成功構建了人胚胎腎細胞(HEK-293)SGLT家族中SGLT2基因異源表達體系[63]。因此,可以通過分子生物學技術構建SGLT1蛋白基因真核表達載體,向異源細胞系統插入表達SGLT1蛋白的基因,使細胞單一地表達SGLT1受體蛋白。進一步運用鈣離子成像技術檢測細胞內鈣離子濃度的變化,給予甜味劑刺激后通過激光掃描共聚焦顯微鏡觀察細胞熒光變化,從而評估甜味劑對SGLT1的激活能力。
此外,腸道neuropod細胞表達SGLT1蛋白,葡萄糖可特異性地結合SGLT1蛋白激活neuropod細胞釋放谷氨酸[55,64]。因此可以通過甜味劑是否激活neuropod細胞釋放谷氨酸評估甜味劑激活腸-腦軸的能力。例如將表達谷氨酸熒光探針(iGluSnFR)的細胞(如HEK-293、BHK細胞等)和neuropod細胞共培養(yǎng)后加入甜味劑,利用激光掃描共聚焦顯微鏡可以實時觀察表達iGluSnFR細胞的熒光變化,以量化反映谷氨酸的釋放情況,從而判斷甜味劑是否具有激活腸-腦軸的能力(圖6)。
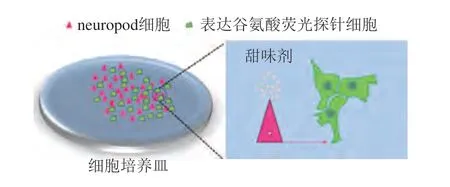
圖6 Neuropod細胞和表達谷氨酸熒光探針細胞共培養(yǎng)[55]Fig.6 The co-culture of neuropod cells and cells expressing iGluSnFR[55]
測定關鍵靶點蛋白激活能力能從更深層的角度(受體、分子)評估甜味劑激活腸-腦軸的能力,所涉及技術方法依賴于構建穩(wěn)定表達的異源SGLT1受體蛋白細胞株或從動物的腸道分離出neuropod細胞。細胞實驗環(huán)境需要細胞培養(yǎng)間,并配備熒光共聚焦顯微鏡、細胞培養(yǎng)箱等一系列設備,同時要求實驗人員具備專業(yè)的分子生物學技術背景和儀器操作技能。
3 結語
本文系統梳理了糖類與甜味劑引發(fā)的動物行為偏好差異、動物腦區(qū)活動差異和腸-腦軸神經激活模式差異3 個方面的研究進展,闡釋了大腦可以辨別糖和甜味劑使個體表現出行為偏好差異的根本原因。基于腸-腦軸效應的宏觀表現和內在機制,提出了利用動物行為學表現、腦區(qū)神經活動和關鍵受體激活能力3 種技術手段完善甜味劑功能評估體系的建議。關注甜味劑的腸-腦軸效應對于該領域的創(chuàng)新發(fā)展意義重大。

