聚焦鹽類水解 破解十大應用
王繁 黃玉梅


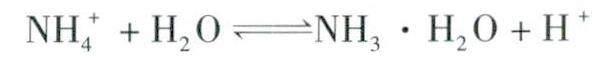
鹽類水解廣泛應用于生產、生活,總結如下。
一、熱的純堿溶液可去油污
油污屬于酯類,難溶于水,純堿在加熱條件下水解:
加熱促進CO32-的水解,溶液堿性越強,去污能力增強。因此,產生的OH -促進酯的水解,生成可溶于水的高級脂肪酸鈉和甘油。
二、鹽溶液的配制和保存
配制FeCl3溶液時,通常將FeCl3晶體溶于較濃的鹽酸中,然后再加水稀釋至所需的濃度,溶于鹽酸的日的是防止F3+發生水解反應;而配制FeSO4溶液時,將固體FeSO4溶于少量稀硫酸,目的也是增大H+濃度,從而抑制Fe2+的水解,再加入少量的鐵屑,防止Fe2+被氧化。
三、部分鹽可作凈水劑
鋁鹽、鐵鹽等部分鹽一定條件下水解生成膠體,因有較強的吸附性,可吸附水中的懸浮物而達到凈水效果。例如,明礬可作凈水劑,是因為明礬溶于水后電離產生的鋁離子水解:
牛成的Al(OH)3膠體粒子因帶正電,可吸附懸浮于水中的泥沙、固體顆粒物等,而從達到凈水的效果。
四、泡沫滅火器原理
泡沫滅火器內部有鋼瓶和塑料桶2部分構成,分別向鋼瓶和塑料桶中加入NaHCO3和Al2(SO4)3溶液,當遇到緊急情況,拔保險并倒立,Al2(SO4)3與NaHCO3溶液因接觸而充分反應,噴射出含有Al(OH)3的高壓CO2,實現將可燃物表面進行固體覆蓋和隔絕空氣的目的,從而達到滅火的效果。
五、部分鹽為溫和的酸堿
通常選用NH4Cl溶液除去鋼材表面的鐵銹,因NH4+在水溶液中發生水解:
產生的極少量H+和鐵銹反應,因酸性較弱不會腐蝕金屬材料本身,起到恰到好處的作用。
六、制備膠體
向沸水中滴加FeCl3飽和溶液,并繼續煮沸至溶液呈紅褐色,加熱的目的是為了增大Fe3+的水解程度,從而制備Fe(OH)3膠體。而不能選用Fe2(SO4)3溶液制備Fe(OH)3膠體,是因為水解產生的H2SO4是難揮發性的酸,無法和產生的Fe(OH)3膠體分離,制備不了Fe(OH)3膠體。
七、鹽溶液酸堿性的判斷
有弱才水解,無弱不水解,描述的是鹽類水解的條件,并不是所有的鹽溶于水都能發生水解反應,當含有弱離子的鹽溶于水時才能夠水解。NaCl溶液不能水解,NH4Cl溶液中NH4+是弱離子,故能發生水解。誰強顯誰性,指鹽類水解的結果,從反應的角度看,形成該鹽的酸和堿誰更強顯誰性。FeCl3溶液可看作Fe(OH)3與HCl反應制得,Fe3+對應的堿Fe(OH)3是弱堿,HCl是強酸,所以呈酸性。同理,CH3COONa溶液呈堿性。從鹽的形成方式可判斷能水解鹽的酸堿性,即強酸弱堿鹽呈酸性;強堿弱酸鹽呈堿性。
八、化肥的施用
例如,草木灰與銨態氮肥不能混合施用,否則導致肥效損耗。草木灰的主要成分為K2CO3,和銨態的氮肥混合后,這兩種鹽發生可逆的互促水解,雖程度不是很大,但是仍然有氨逸出從而導致肥效降低。同時,土壤的酸堿性直接影響農作物的生長,鹽堿地通常加石膏,酸性土壤加生石灰來調節,達到增產增收的效果。
九、鹽溶液加熱蒸干問題
1.氧化物型
對鹽溶液加熱、蒸干、灼燒后得到對應的氧化物。例如AlCl3溶液蒸干得Al(OH)3固體,灼燒最終得固體Al2O3。這是因為AlCl3溶液在加熱時促進Al3+水解得到Al(OH)3和HCl,HCl是易揮發性酸與Al(OH)3懸濁液分離,Al(OH)3固體沉降后受熱分解得到氧化鋁固體。Fe(NO3)3溶液、MgCl2溶液等易揮發性的強酸弱堿性,加熱、蒸干、灼燒都得到對應的氧化物。
2.自身型
對鹽溶液加熱、蒸干、灼燒后得到原物質。例如,將Na2CO3溶液蒸干得Na2CO3本身,在加熱Na2CO3溶液時,雖促進Na2CO3水解得到NaHCO3和NaOH,所得的NaOH溶液在溶液中難揮發,同時抑制HCO3-水解,蒸發到一定程度發生反應:
HCO3-+OH-=CO32-+H2O
所以蒸干后得到原物質Na2CO3。
再如,將CuSO4溶液加熱、蒸干、灼燒得到CuSO4本身。在加熱CuSO4溶液時,水解得到的H2SO4是難揮發性酸,不會產生和Cu(OH)2分離的情況。即便水解,產生的H2SO2與Cu(OH),反應,重新得到CuSO4固體本身。
所以難揮發性的強酸弱堿鹽或強堿弱酸鹽加熱,蒸干、灼燒后得到鹽溶質本身。
3.還原型
部分鹽溶液加熱蒸干時,溶質會被O2氧化,得不到原溶質。例如,Na2SO3溶液在加熱、蒸干后得到其氧化產物Na2SO4。將FeCl2溶液加熱、蒸干、灼燒的過程中,首先是溶質被氧化,然后水解產生的弱堿Fe(OH)3分解得到Fe2O3。所有具有易還原性的鹽溶質在加熱蒸干過程中,首先要考慮鹽溶質被氧化,然后再考慮其它的變化。
4.分解型
鹽溶液在加熱、蒸干、灼燒的過程中還要考慮鹽受熱時是否易分解,也就是考慮鹽溶質的熱穩定性。例如,Ca( HCO3)2溶液在加熱蒸干的過程中,溶質受熱分解得到CaCO3固體,灼燒后得到固體CaO。在加熱NaHCO3溶液、KMnO4溶液、NH4Cl溶液時,溶質受熱易分解,因此蒸干、灼燒時溶質都會發生熱分解。
十、物質的提純
怎樣除去Cu2+溶液中混有的少量Fe3+,因Cu(OH)2、Fe(OH)32種難溶物的溶解度不同,利用鹽類水解原理,可以向溶液中加入CuO或Cu(OH)2或CuCO2或Cu2(OH)2C01等固體,因消耗水解平衡體系的H+,溶液pH增大,使Fe3+轉化為Fe(OH)3沉淀而除去。除雜試劑本身是難溶物,即便過量也不會影響提純試劑的純度,從而達到除雜的日的。
綜上所述,分類厘清鹽類水解的應用,更有利于學生掌握和靈活運用,提高化學學科素養和分析問題、解決問題的能力。
(收稿日期:2023-12-09)

