不同基質配比下黃瓜根際細菌群落結構及多樣性分析
陳宏昊 唐小付 聶圣賢 林佳佳 魏西 劉婷 任昊奎

關鍵詞:黃瓜;高通量測序;細菌群落結構;功能預測
黃瓜(Cucumber sativus L.)是我國重要的設施蔬菜[1],作為城市居民“菜籃子”中最主要的種類之一,具有較高的食用及營養價值特性,市場需求量大,在全國范圍內廣泛栽培。為了實現周年生產和季節性均衡供應,生產上一般采用日光溫室、塑料拱棚、遮陽網等設施栽培,由于我國黃瓜設施栽培面積較大,復種指數高,常導致土壤板結,微生物群落平衡破壞[2-3]以及土傳病害的發生,對黃瓜產量和品質造成不可避免的負面影響。相比之下,基質栽培能夠有效預防和減少土傳病害的發生[4-5],還能夠一定程度上改善栽培作物的根系生長環境,提高產量和品質,因此是近年來新興的栽培模式。
微生物是生態系統中功能活躍,開發潛力最大、最寶貴、最豐富的生物資源[6]。根際微生物與植物的生長密切相關,主要表現在微生物菌落結構、物種及多樣性方面與植物的健康生長呈正向關聯關系[7-9],尤其是一些根際細菌類群,具有較高的固氮、解磷、解鉀和產植物生長素等[5]。大量研究表明,內生細菌及根際細菌種群可以定殖在植物根際或其他組織內[10],具有抑制病原菌生長,誘導植物增強抗病能力、促進生長等作用[11]。
無土基質栽培技術的實施與開展,改變了黃瓜在土壤中栽培的固定模式,越來越多的種植戶選擇其他基質進行栽培[12-13]。現階段,基質栽培已經應用于沃柑[14]、番茄[15]、辣椒[16]、萵苣[17]、蔬菜[18]、芍藥[19]等經濟作物及植物的生產和種植。生產中,常用的商品基質主要成分草炭為不可再生資源,受環境和濕地保護的制約,其采挖已經受到限制[20]。目前,常見的復配基質材料有菇渣、椰糠、鋸末、花生殼等,這些材料價格低廉,簡單易得,可以通過改變材料種類和配比以獲得不同作物的最佳配方。周方園等[5]研究發現,用基質栽培黃瓜可篩選出對黃瓜幼苗有顯著促進作用的有益微生物,而胡云等[21]證明,基質與生物炭可提升黃瓜根際速效磷、速效鉀、堿解氮等的質量比,從而提高黃瓜產量。
雖然前人對基質栽培黃瓜根際微生物多樣性做了相關研究,但目前關于菇渣、鋸末按不同比例復配對黃瓜根際菌落環境的影響方面研究鮮見報道。為此,本研究采用第三代測序技術比較分析了菇渣、鋸末不同比例的復配基質對黃瓜植株根際細菌群落的影響,為菇渣、鋸末復配的新型基質栽培模式應用提供依據。
1 材料與方法
1.1 材料
1.1.1 試驗地概況 試驗地位于廣西壯族自治區南寧市西鄉塘區廣西大學農學院蔬菜試驗基地(22°51.2′N,108°18′E)。
1.1.2 試驗材料 供試黃瓜品種為津優186 號,購買自天津科潤農業科技股份有限公司。
供試基質:菇渣(鳳尾菇菇渣),購買自南寧市五塘食用菌生產有限公司;鋸末(杉木鋸末),購買自南寧市五塘木材加工有限公司;商品基質(泥炭∶蛭石∶珍珠巖=3∶1∶1)購買自長春益農賽世泥炭開發有限公司。
試劑盒:DNA 抽提試劑盒E.Z.N.A.? SoilDNA Kit 購買自美國Omega Bio-Tek 公司,建庫試劑盒NEXTFLEX? Rapid DNA-Seq Kit 購買自美國Bioo Scientific 公司,測序試劑盒MiSeqReagent Kit v3 購買自美國Illumina 公司。
1.2 方法
1.2.1 黃瓜種植與產量測定 試驗于2021 年7月至2022 年2 月在實驗室和蔬菜基地進行。采用底袋直徑和袋高均為40 cm 的無紡布袋進行基質袋裝栽培。試驗基質均用50%的多菌靈1000 倍液噴施消毒,然后覆蓋塑料薄膜,在陽光下暴曬7 d。試驗采用單因素隨機區組試驗設計,共設4 種不同的栽培模式,每種栽培模式為一個試驗處理,共4 個處理,每個處理設3 個重復,共12 個試驗小區。各處理分別為:(1)CK 處理,商品基質對照;(2)T1 處理,復配基質(菇渣∶鋸末=1∶3);(3)T2 處理,復配基質(菇渣∶鋸末=1∶1);(4)T3 處理,復配基質(菇渣∶鋸末=3∶1)。上述除栽培基質配比不同外,其他田間管理均相同。每個處理栽植黃瓜30 株,株距60 cm,行距80 cm。于9 月下旬進行穴盤育苗播種,10 月中旬定植,其他管理同日常,整個栽植過程中黃瓜植株未出現病蟲害,12 月下旬在黃瓜進入收獲期,按照小區對各處理的黃瓜依次分批采收,用常規稱重法對黃瓜進行稱重測產并記錄。
1.2.2 樣品采集 在黃瓜進入盛果期,每個處理選擇10 株生長勢一致的植株,采用“斗根法”[22]采集樣品。取樣時,先用75%酒精對手套和鐵鏟消毒,然后挖取植株根部,抖落根系外部基質,收集附著在植株根部的基質,裝入無菌袋封裝,放入冰盒,帶回實驗室。
1.2.3 樣品總DNA 提取、PCR 擴增及高通量測序 使用E.Z.N.A.? Soil DNA Kit 試劑盒提取總DNA,使用NanoDrop 2000 超微量分光光度計(thermo fisher scientific, 美國)測定DNA 濃度和純度,使用1%瓊脂糖凝膠電泳檢測總DNA 提取質量。PCR 擴增引物為799F(5-AACMGGATTAGATAC CCKG-3))和1193R(5-ACGTCATCCCCACCTTCC-3)),對樣本細菌擴增V5-V7 可變區域進行PCR 擴增,其擴增參數為:95 ℃預變性3 min;95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸30 s,循環27 次;72 ℃延伸10 min,10 ℃保存直至反應結束。PCR 擴增體系為:0.4 μLTaKaRa Taq(5 U/μL),4.0 μL 5×FastPfu Buffer,2.0 μL dNTPs(各2.5 mmol/L),0.8 μL(5 μmol/L)引物,0.2 μL 的BSA,1 μL DNA 模板(10 ng/μL),加入ddH2O 補足20 μL。對PCR 產物進行鑒定:即每個樣本3 個PCR 重復,將3 個重復的PCR產物混合;使用2%瓊脂糖凝膠電泳檢測產物條帶大小。Illumina Miseq 測序:使用2%瓊脂糖凝膠回收PCR 產物,依次對回收產物進行純化,再用2%瓊脂糖凝膠進行電泳檢測,并使用QuantusTMFluorometer(Promega, USA)對回收產物進行檢測定量。使用NEXTFLEX? Rapid DNA-Seq Kit進行建庫,使用MiSeq PE300 平臺進行測序。
1.3 數據處理
試驗數據采用Excel 2019 和SPSS 25.0 軟件進行分析和處理, 用鄧肯法進行顯著性檢驗(P<0.05),平均數據以“平均數±標準差(SD)”表示。利用上海美吉生物醫藥科技有限公司I-Sanger 云數據分析平臺對測序數據進行在線處理,獲得樣本稀釋曲線圖、OUT 聚類分析表格、Alpha 數據表格、細菌群落占比圖、Venn 圖及PICRUSt 功能預測數據等。
2 結果與分析
2.1 不同基質配比對黃瓜產量的影響
由表1 可知,菇渣、鋸末按不同比例復配組成的復配基質(T1、T2、T3 處理)栽培黃瓜產量均顯著高于商品基質(CK)栽培,其中T2 處理黃瓜產量最高,達48 572.40 kg/hm2;CK 處理產量最低,為39 762.70 kg/hm2。產量表現為T2>T3>T1>CK 處理,說明較CK 處理栽培相比,通過菇渣、鋸末復配組成的基質栽培黃瓜可顯著提高黃瓜產量,其中T2 處理產量最高。
2.2 不同基質配比下黃瓜植株根際細菌OUT聚類分析
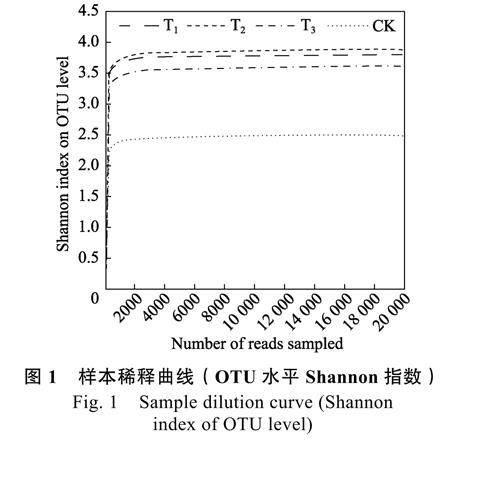
由圖1 可知,稀釋曲線隨著樣本測序數量的增大,逐漸變得平緩,當樣本測序數量達到20000時,曲線不再增長,表明測序結果可以真實反映黃瓜根際細菌群落結構。
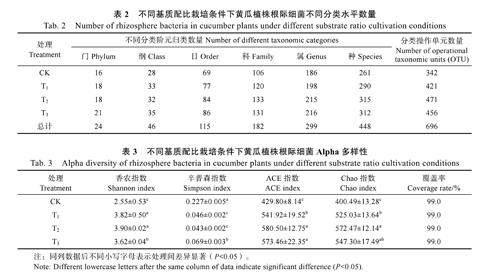
由表2 可知,不同栽培基質條件下黃瓜根際細菌菌落的組成存在較大差異,與CK 相比,T1、T2 和T3 處理均不同程度地提高了黃瓜根際細菌種群的多樣性。
2.3 不同基質配比下黃瓜植株根際細菌Alpha多樣性分析
在生物信息云平臺進一步分析不同基質配比下黃瓜根際細菌的多樣性指數和豐富度。由表3可知,各樣本分析測序覆蓋率均在99%以上,表明結果可以代表根際微生物種群的真實情況。T1、T2 和T3 處理的根際細菌Shannon 指數、ACE 指數和Chao 指數均顯著高于CK 處理,說明T1、T2 和T3 處理栽培條件下,黃瓜植株根際微生物多樣性和豐富度高于CK,且Simpson 指數均顯著低于CK,表明商品基質栽培條件下黃瓜植株根際微生物多樣性較低。
香農指數Shannon 和辛普森指數Simpson 是微生物多樣性指標。香農指數其值越大,物種多樣性越大,辛普森指數其值越大,物種越集中,多樣性越低;Chao[23]指數和ACE[24]指數是微生物物種豐富度指標,其值越大,物種越豐富[25]。
2.4 群落組成分析
2.4.1 不同處理黃瓜植株根際細菌優勢群落門分類水平 由圖2 可知,門分類水平,不同基質配比下黃瓜植株根際細菌中,相對豐度占比大于1%的為優勢細菌門,變形菌門(Proteobacteria)是4種栽培模式下共有的優勢細菌門類,其相對豐度在各處理中占比介于72.45%~96.35%之間。
在CK 處理中,黃瓜植株根系優勢細菌門的相對豐度占比大小依次為變形菌門(Proteobacteria,96.35%)、放線菌門(Actinobacteriota,1.43%),其他門類相對豐度總占比為1.49%。
在T1 處理中,黃瓜植株根系優勢細菌門的相對豐度占比大小依次為變形菌門(Proteobacteria,72.45%)、擬桿菌門(Bacteroidota,25.14%),其他門類相對豐度總占比為1.48%。
在T2 處理中,黃瓜植株根系優勢細菌門的相對豐度占比大小依次為變形菌門(Proteobacteria,80.78%)、擬桿菌門(Bacteroidota,16.51%),其他門類相對豐度總占比為1.73%。
在T3 處理中,黃瓜植株根系優勢細菌門的相對豐度占比大小依次為變形菌門(Proteobacteria,84.04%)、擬桿菌門(Bacteroidota,12.49%)、放線菌門(Actinobacteriota,1.25%),其他門類相對豐度總占比為2.22%。
與CK 相比,雖然不同的基質配比栽培條件下均不同程度地降低了變形菌門(Proteobacteria)細菌豐度占比,但亦不同程度地增加了擬桿菌門( Bacteroidota ) 細菌豐度占比, 且擬桿菌門(Bacteroidota)是有機基質栽培特有的優勢細菌門類。
2.4.2 不同處理黃瓜株根際細菌優勢菌落屬分類水平 如圖3 所示,屬分類水平,不同基質配比下黃瓜植株根際細菌中,相對豐度占比大于1%的為優勢細菌屬。其中在CK、T1、T2、T3 處理中,優勢細菌屬分類水平數量分別為12、15、15和14 個。
在CK 處理中,黃瓜植株根系優勢細菌屬的相對豐度占比大小順序依次為羅丹諾桿菌屬( Rhodanobacter , 46.40% )、不粘柄菌屬(Asticcacaulis,14.77%)、包特菌屬(Bordetella,12.02% )、伯克霍爾德氏菌屬( Burkholderia-Caballeronia-Paraburkholderia,2.60%)、卡斯特蘭尼氏菌屬(Castellaniella,2.17%)、利姆諾桿菌屬( Limnobacter , 1.87% )、( unclassified_c__Gammaproteobacteria,1.78%)、Noviherbaspirillu(1.63%)、申氏桿菌屬(Shinella,1.62%)、德沃斯氏菌屬( Devosia , 1.27% )、朱氏桿菌屬(Chujaibacter,1.16%)、(unclassified_f__Comamonadaceae,1.05%),其他相對豐度總占比為8.47%。
在T1 處理中,黃瓜植株根系優勢細菌屬的相對豐度占比大小順序依次為黃桿菌屬(Flavobacterium,24.90%)、不粘柄菌屬(Asticcacaulis,9.69% )、噬酸菌屬( Acidovorax , 8.74% )、(unclassified_f__Comamonadaceae,6.68%)、伯克霍爾德氏菌屬( Burkholderia-Caballeronia-Paraburkholderia , 4.63% )、羅丹諾桿菌屬(Rhodanobacter,4.54%)、包特菌屬(Bordetella,4.22%)、新鞘氨醇桿菌屬(Novosphingobium,4.17%)、異樣根瘤菌屬( Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium,3.95%)、申氏桿菌屬( Shinella , 3.67% )、慢生根瘤菌屬( Bradyrhizobium, 2.52%)、草螺菌屬(Herbaspirillum,2.23%)、德沃斯氏菌屬(Devosia,2.05% )、( Dokdonella , 1.47% )、短波單胞菌(Brevundimonas,1.07%),其他相對豐度總占比為12.89%。
在T2 處理中,黃瓜植株根系優勢細菌屬的豐度占比大小順序依次為黃桿菌屬(Flavobacterium,15.89%)、不粘柄菌屬(Asticcacaulis,14.74%)、伯克霍爾德氏菌屬(Burkholderia-Caballeronia-Paraburkholderia,8.56%)、申氏桿菌屬(Shinella,8.15%)、新鞘氨醇桿菌屬(Novosphingobium,7.24%)、羅丹諾桿菌屬(Rhodanobacter,6.5%)、噬酸菌屬(Acidovorax,4.54%)、異樣根瘤菌屬( Allorhizobium-Neorhizobium-Pararhizobium-Rhizobium,3.65%)、(unclassified_f__Comamonadaceae,3.20%)、包特菌屬(Bordetella,2.65%)、熱單胞菌屬( Thermomonas, 2.48%)、鞘氨醇盒菌屬(Sphingopyxis,2.34%)、草螺菌屬(Herbaspirillum,1.73%)、德沃斯氏菌屬(Devosia,1.71%)、卡斯特蘭尼氏菌屬(Castellaniella,1.02%),其他相對豐度總占比為13.24%。
在T3 處理中,黃瓜植株根系優勢細菌屬的豐度占比大小順序依次為羅丹諾桿菌屬(Rhodanobacter,16.49%)、不粘柄菌屬(Asticcacaulis,15.79%)、申氏桿菌屬(Shinella,15.40%)、黃桿菌屬(Flavobacterium,12.23%)、伯克霍爾德氏菌屬(Burkholderia-Caballeronia-Paraburkholderia,4.21%)、新鞘氨醇桿菌屬(Novosphingobium,3.89% )、異樣根瘤菌屬( Allorhizobium-NeorhizobiumPararhizobium-Rhizobium,3.37%)、噬酸菌屬(Acidovorax , 2.28%)、德沃斯氏菌屬(Devosia,2.11%)、草螺菌屬(Herbaspirillum,1.97%)、熱單胞菌屬(Thermomonas,1.97%)、(unclassified_f__ Comamonadaceae,1.89%)、鞘氨醇盒菌屬(Sphingopyxis,1.71%)、(Noviherbaspirillum,1.07%), 其他相對豐度總占比為12.14%。
其中,unclassified_c__Gammaproteobacteria、利姆諾桿菌屬( Limnobacter ) 和朱氏桿菌屬(Chujaibacter)是CK 處理條件下,黃瓜植株根系特有的優勢細菌屬;與CK 處理相比,黃桿菌屬( Flavobacterium )、新鞘氨醇桿菌屬(Novosphingobium)、異樣根瘤菌屬(Allorhizobium-NeorhizobiumPararhizobium-Rhizobium)、噬酸菌屬Acidovorax 和草螺菌屬(Herbaspirillum)是復配基質栽培(T1、T2、T3 處理)條件下,黃瓜植株根際特有的優勢細菌屬;伯克霍爾德氏菌屬(Burkholderia-Caballeronia-Paraburkholderia)、羅丹諾桿菌屬(Rhodanobacter)、不粘柄菌屬( Asticcacaulis )、申氏桿菌屬( Shinella ) 和unclassified_f__Comamonadaceae、德沃斯氏菌屬(Devosia)是商品基質栽培和菇渣、鋸末復配基質栽培條件下,黃瓜植株根際共有的優勢細菌屬。
綜上所述,不同的基質配比栽培黃瓜,在不同程度上改變黃瓜植株根際細菌屬分類水平的群落組成,同時也改變了優勢細菌菌落組成的豐度占比。與CK 相比,菇渣、鋸末復配基質栽培有利于黃瓜根際形成更為多樣與均衡的細菌群落結構。
2.5 物種Venn 分析
由圖4 分析結果可知,在屬分類水平,CK、T1、T2、T3 處理中,黃瓜植株根際細菌屬分類水平數量分別為165、192、198 和200 個;4 種栽培模式中,黃瓜植株根際細菌共有的菌屬為102個;T1、T2、T3 與CK 處理共有的優勢根際細菌屬數量分別為14、6 和7 個。而T1、T2、T3 和CK 處理黃瓜植株根際中,特有的根際細菌屬的數量分別為18、14、23 和14 個。
由圖5 分析結果可知,在種分類水平,CK、T1、T2、T3 處理中,黃瓜植株根際細菌種分類水平數量分別為226、279、294 和286 個;4 種栽培模式中,黃瓜植株根際細菌共有的菌種為130個;T1、T2、T3、CK 處理共有的優勢根際細菌種數量分別為14、10、7 個。而T1、T2、T3、CK處理黃瓜植株根際中,特有的根際細菌種的數量分別為35、27、34、28 個。
表明無論是屬或種分類水平,與CK 相比,通過菇渣、鋸末復配基質栽培均可以提高黃瓜根際細菌的數量水平,同時也有利于提升黃瓜植株根際特有的優勢細菌數量。
2.6 PICRUSt 功能預測
為了進一步研究不同基質配比栽培條件下黃瓜植株根際細菌的功能,本研究利用高通量測序技術和KEGG(kyoto encyclopedia of genes andgenomes)數據庫進行比對發現,黃瓜植株根際細菌在一級功能層共有6 類生物代謝通路(表4),分別為: 代謝(metabolism )、環境信息處理(environmental information processing)、遺傳信息處理(genetic information processing)、細胞過程(cellular processes)、人類疾病(human diseases)和有機系統(organismal systems)。其中,代謝、環境信息處理和遺傳信息處理為主要一級功能,占比分別為62.74%~64.24%、15.64%~17.43%和10.57%~11.07%。不同基質配比栽培條件下黃瓜植株根際細菌基因一級功能層預測基因種類無顯著差異,但基因拷貝數占比存在差異。
COG(clusters of orthologous groups)功能分類如圖6 所示,黃瓜植株根際細菌群落功能組成相對豐度占比前10 類別分別為:未知功能(S,11.06%~11.64%)、氨基酸轉運與代謝(E,7.99%~8.19%)、一般功能預測(R,7.92%~8.17%)、細胞壁/膜/包膜生物發生(M,6.80%~7.09%)、轉錄(K,6.61%~6.81%)、無機離子運輸與代謝(P,6.11%~6.61%)、能量生產和轉換(C, 6.32%~6.60%)、信號轉導機制(T,5.60%~6.45%)、碳水化合物運輸和代謝(G,5.24%~6.06%)以及翻譯、核糖體結構和生物發生(J,5.15%~5.43%)。各處理中,黃瓜植株根際細菌群落功能組成相似。與CK 相比,菇渣、鋸末復配基質栽培提高了一般功能預測、氨基酸轉運與代謝、轉錄、無機離子運輸與代謝、信號轉導機制、碳水化合物運輸和代謝功能豐度,降低了能量生產和轉換、細胞壁/膜/包膜生物發生、翻譯、核糖體結構和生物發生等功能豐度,但不同基質配比栽培條件下各處理間差異不顯著。表明不同基質配比對黃瓜植株根際細菌功能豐度占比影響較小。通過對KEGG數據庫和COG 數據庫檢測到大多數根際細菌顯示出有益的功能。
3 討論
本研究中,基于黃瓜植株根際細菌群落結構組成和產量而言,菇渣和鋸末復配基質可替代常規商品基質栽培黃瓜,T2 處理(菇渣∶鋸末=1∶1)表現最佳,為新型基質栽培模式的應用提供理論參考依據。
基質栽培相較于傳統的土壤栽培具有節水、保墑、增產及減輕環境污染,降低生產成本的作用,能夠有效改善作物生長的根際環境,提高作物的產量和品質。根際微生物群落的形成與作物、土壤有著密切的關系,而根際微生物在作物對養分的吸收、病原物的防衛,抗逆性等方面發揮著至關重要的作用[26]。生產上通過間作制度、生物化肥、基質栽培等方式改善作物根際微生物群落組成和功能,并通過對根際微生物群落的調控來增加農作物的產量。已有研究表明,作物根際微生物或內生微生物群落結構和多樣性越豐富時,植株對抗病原菌的綜合能力就越強[27-28]。本研究發現,菇渣、鋸末復配組成的基質栽培條件下Chao 指數和Shannon 指數均顯著高于商品基質栽培,在菇渣、鋸末復配基質栽培條件下,檢測到黃瓜植株根際富集一些有益功能菌屬如:黃桿菌屬( Flavobacterium )、新鞘氨醇桿菌屬(Novosphingobium)和草螺菌屬(Herbaspirillum)等共有優勢功能菌屬。有研究發現,黃桿菌屬(Flavobacterium)細菌具有脫氮除磷功能的好氧反硝化微生物[29] , 新鞘氨醇桿菌屬(Novosphingobium)是一種與碳循環相關的具有降解木質素功能的微生物[30-31] , 草螺菌屬(Herbaspirillum)是一種與根系相關的固氮細菌,可利用根系分泌物互利共生,其主要通過固氮、溶磷和分泌鐵載體等方式促進植物生長[32]。可見,這些特有優勢功能菌屬的富集改善了黃瓜植株根際微生態環境,幫助植株適應養分不足的脅迫環境。
前人研究發現,基質栽培中,不同的基質配比能不同程度地改變沃柑大苗根際細菌的多樣性和豐富度[14]。本研究亦發現,菇渣、鋸末不同的基質配比調節了黃瓜植株根際優勢細菌不同(門、屬)分類水平的組成比例,不同程度地改變了黃瓜植株根際細菌的多樣性和豐富度。楊海俊[33]研究發現,用粗砂、菇渣、鋸末等作為復配基質材料,理化特性及變化滿足作物生長需求,明顯改善了作物根區的環境,提高了作物產量和品質,與本研究結果有相似之處,本研究發現,擬桿菌門(Bacteroidota)是菇渣、鋸末復配基質栽培共有的優勢細菌門類,能夠有效降解有機物質,加快栽培基質中有機物料的分解與吸收,改善了黃瓜植株根區微生態環境,且產量也高于商品基質栽培。良好的栽培基質能為作物的生長提供良好的根際微生態環境,栽培基質原料與配比的不同不僅會影響基質理化性狀,也會影響基質微生物的數量、種類及酶活性,進而影響植物的生長[34]。因此,研究菇渣、鋸末不同的配比下黃瓜根際細菌群落結構的分析,對黃瓜生產及新的栽培模式具有重要意義。
近年來,利用高通量測序技術在細菌多樣性及豐富度方面研究較多[35-38]。對細菌功能研究相對較少,本研究在Mi Seq 高通量測序結果的基礎上,將KEGG 數據庫和COG 數據庫進行比對發現,不同的基質配比栽培黃瓜不僅改變了黃瓜植株根際細菌群落組成,而且影響植株根際細菌的代謝功能,但不同處理之間對黃瓜植株根際細菌群落整體功能影響甚微。今后關于細菌功能的研究及有益功能菌如何對作物的生長產生影響,有待進一步深入探究。

