淺議鍵角大小比較
鄭松華

鍵角是多原子分子中,2個相鄰共價鍵之間的夾角,是描述分子空間結構的重要參數,分子的許多性質都與鍵角有關。鍵角能夠通過光譜、衍射等實驗測定,也可以用量子力學近似方法計算。從價鍵理論角度講,共價鍵的本質是原子軌道的重疊,共用電子對其實是2個原子通過原子軌道的重疊達成的共用。所以鍵角就是2個成鍵電子對電子云對稱軸之間的夾角,鍵角大小比較是近年高考考查的熱點,現結合實例分析,就解答這類試題應把握的關鍵所在整理如下。
一、中心原子雜化方式不同,比較其雜化方式(見表1)
例題1 (2023年湖南高考題17節選)(7)比較分子中的C-Ga-C鍵角大小:Ga(CH3)3____Ga(CH3)3(Et2O)(填“>”“<”或“=”),其原因是____。
答案:分子中的C-Ga-C鍵角Ga(CH3)3>Ga(CH3)3(Et2O),其原因是Ga(CH3)3中Ga為sp2雜化,所以為平面結構,而Ca(CH3)3(Et2O)中Ga為sp3雜化,所以為四面體結構,故夾角較小。
例題2 (2022年湖南卷,題18節選)比較鍵角大小:氣態SeO3分子____SeO2-3離子(填“>”“<”或“=”),原因是____。
答案:> SeO3的空間結構為平面三角形,SeO2-3的空間結構為三角錐形。
二、中心原子雜化方式相同,比較電子對間的斥力
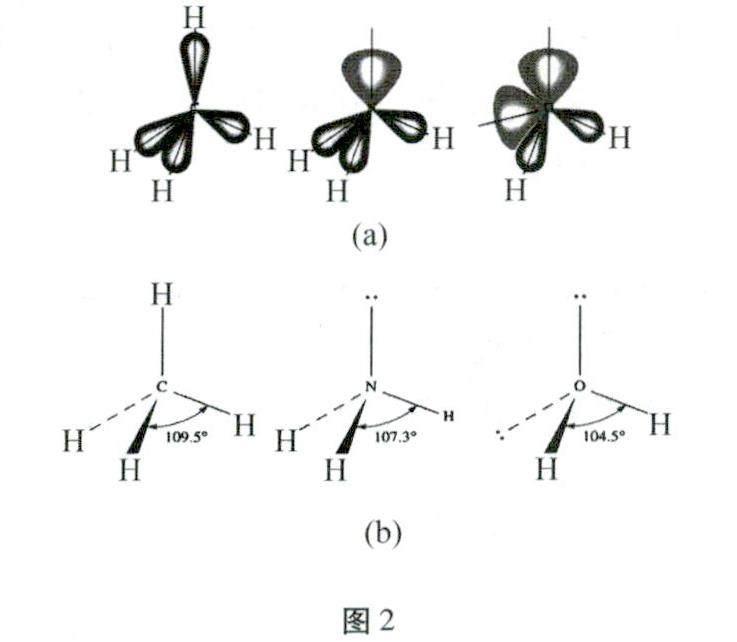
由于孤電子對只受中心原子的吸引,其電子云體積較大地堆積在中心原子附近,對體積被拉長的成鍵電子對就有很大的排斥作用,迫使成鍵電子對距中心原子遠,則成鍵電子對之間的夾角即鍵角減小。孤對電子對越多,鍵角越小,如圖2中(a)、(b)所示。
例題3 (2022年北京卷,題15節選)H2O中O和SO2-4中S均為sp3雜化,比較H2O中H-O-H鍵角和SO2-4中O-S-O鍵角的大小并解釋原因____。
答案:由于H2O中孤電子對有較大斥力,使H-O-H鍵角小于O-S-O鍵角。
三、雜化方式及孤電子對同,比較電負性
當雜化方式及孤電子對相同時,則比較對象空間結構相同,根據中心原子或配位原子電負性的不同比較鍵角大小。
1.中心原子不同,配位原子相同
中心原子的電負性越大,吸引電子的能力越強,成鍵電子對距中心原子越近,成鍵電子對之間距離近、斥力越大,鍵角越大。
如NH3、PH3、AsH3中,中心原子都有1個孤電子對,NH3分子的中心原子N的電負性大,成鍵電子對距離中心原子較近,鍵角越大,所以這3種物質鍵角由大到小的順序為NH3>PH3>AsH3。
2.中心原子相同,配位原子不同
配位原子的電負性越大,吸引電子的能力越強,成鍵電子對距離中心原子較遠,成鍵電子對之間距離遠,斥力越小,鍵角越小。
如比較NF3和NH3的鍵角,由于F的電負性比H大,NF3中成鍵電子對離中心原子較遠,斥力較小,因而鍵角也較小。
例題4 SO2Cl2和SO2F2分子中,S與O之間以雙鍵結合,S與Cl、S與F之間以單鍵結合。
請你預測SO2Cl2和SO2F2分子的空間結構:____,SO2Cl2分子中∠Cl-S-Cl____(選填“<”“>”或“=”)SOZF2分子中∠F-S-F。
答案:四面體 >
SO2Cl2和SO2F2中的硫原子是中心原子,沒有孤電子對,由于原子種類不同,是四面體形。根據Cl電負性比F弱,Cl-S形成的共用電子對的斥力強,鍵角大。
四、多重鍵影響
如甲醛H-C-H的中心原子為sp2雜化,鍵角本應該為120°,由于雙鍵的電子云密度大斥力大,故∠H-C-H鍵角小于120°,∠H-C-O鍵角大于120°。
綜上,多原子分子內鍵角首先由價層電子對的空間排布決定,然后在此基礎上因不同電子對電子云密度不同而調整。在共價分子中,中心原子周圍的所有電子對總是要處在斥力最小的位置,均勻分布保證相互之間距離最遠。一般來說,這個斥力最小的排布位置是以中心原子為中心的對稱構型。
基金項目:安慶市教學科學規劃2023年立項課題“基于核心素養的高中化學教學策略研究”(立項編號:AJKT2023-104)階段研究成果。
(收稿日期:2023-12-30)

