數字化實驗數據驅動學科核心素養的落實

摘要: 化學反應原理是化學學習中的重要組成。研究基于數字化實驗,結合IDEO模型以“水溶液中的離子平衡”為例進行教學實踐。通過數字化實驗數據實時采集與動態展示功能,將化學反應以可視化方式予以呈現,建立基于數字化實驗證據的推理以及實驗圖像的分析,發展學生的學科核心素養。
關鍵詞: 數字化實驗; 核心素養; IDEO模型; 水溶液中的離子平衡
文章編號: 1005-6629(2024)06-0035-06 中圖分類號: G633.8 文獻標識碼: B
《普通高中化學課程標準(2017年版2020年修訂)》(以下簡稱“課標”)指出:要重視開展“素養為本”的教學,倡導真實問題情境的創設,開展以化學實驗為主的多種探究活動[1];精心設計數字化實驗,讓學生在實驗探究活動中學習科學方法,認識科學探究過程,體會、認識技術手段的創新對化學科學的重要價值[2]。數字化實驗將化學反應的現象和本質轉換為可檢測的信號,利用其定量化、可視化的特點,通過實驗數據及圖像的分析幫助學生構建認知模型,更好地理解化學反應的原理及本質[3],培養學生的證據推理與模型認知素養,結合數字化實驗開展探究活動有利于培養學生的科學探究精神與創新意識。
國內數字化實驗自20世紀末引入化學教學領域后,數字化實驗的教學應用和實驗設計的相關案例不斷涌現,促進了化學教學的發展[4]。但數字化實驗高效的數據處理能力也限制了學生分析數據、發現規律的能力[5]。IDEO模型通過使學生參與到設計與發現的數字化實驗過程中,推進數字化實驗教學設計以發展學生的學科核心素養。
1 IDEO模型
IDEO模型聚焦于在實踐中創造性地解決問題,在真實情境中通過活動設計來解決復雜問題。該模型包含發現(Discovery)、解釋(Interpretation)、設想(Ideation)、實驗(Experimentation)、拓展(Evolution)五個階段,每個階段對應著不同的解決問題的策略方法[6]。
IDEO模型源于設計領域,后被應用于教育領域[7,8],胡小勇等對IDEO模型進行了總結,并介紹了其在課堂教學、課程設計中的路徑和啟示[9]。IDEO模型中程序化的流程為數字化實驗與課堂教學的有機融合提供了操作性框架,幫助教師合理優化課堂教學中數字化實驗的設計。IDEO模型為教師將數字化實驗圖像和數據轉化為課程的載體提供了理論支持,從而使數字化實驗數據轉化為教學實踐的工具而融入課堂。
2 教學內容分析
本文選取《化學反應原理》主題3“水溶液中的離子平衡”的復習課進行數字化實驗教學研究。“水溶液中的離子平衡”是溶液中平衡移動原理的延續與拓展,涵蓋了電解質相關概念、弱電解質的電離平衡、鹽類水解及其應用等,包含溶液中離子濃度大小比較、守恒關系和圖像分析等。“水溶液中的離子平衡”需要從微觀角度分析物質在水溶液中的存在狀態及行為,全面認識電解質溶液的性質與變化,發展學生的微粒觀、平衡觀和守恒觀。通過理論分析與實驗探究來發展學生的邏輯思維能力、類比遷移能力、綜合分析問題能力,結合宏觀現象和實驗數據等證據素材,引導學生形成認識水溶液中離子平衡的基本思路。
2.1 構建認知模型,促進核心素養落地
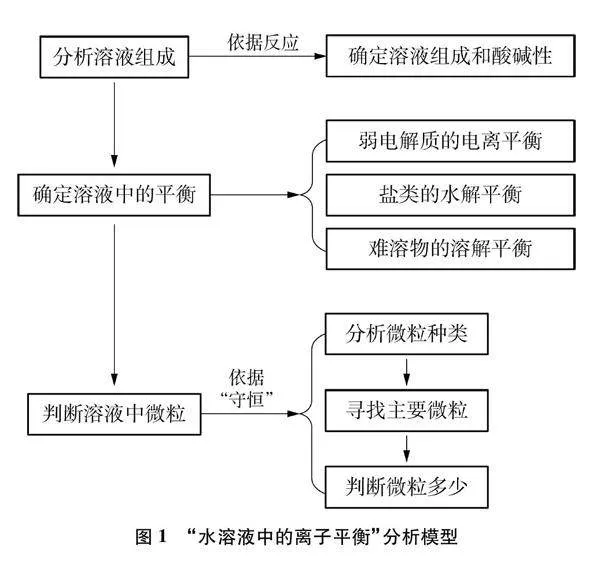
結構化和功能化的知識有可遷移性,更加具有素養價值。“水溶液中的離子平衡”是化學平衡理論在水溶液中的應用,學生在面對實際問題和復雜情境時不能提取相關平衡知識進行分析和判斷。通過構建“水溶液中的離子平衡”分析模型(見圖1),形成“分析溶液組成→確定溶液中的平衡→判斷溶液中微粒”的策略性模式,有助于知識遷移,發展化學思維,幫助學生解決新情境下的陌生問題,促進學科核心素養落地。
2.2 創設真實情境,搭建素養發展平臺
課標指出,真實、具體的問題情境是學生化學學科核心素養形成和發展的重要平臺[10]。水溶液中的離子平衡過于抽象,學生難以從微觀層面構建相應的認知模型。數字化實驗能將無明顯現象的離子反應轉為是可視化的實驗數據和圖像,幫助學生了解和認識水溶液反應的特點,培養學生“證據推理與模型認知”的核心素養。將數據和圖像作為真實問題情境來設計學生活動,結合實驗數據引導學生形成認識水溶液中離子平衡的分析模型。
本文設計了三個有代表性的數字化實驗來展示復雜情況下的水溶液中的離子平衡。
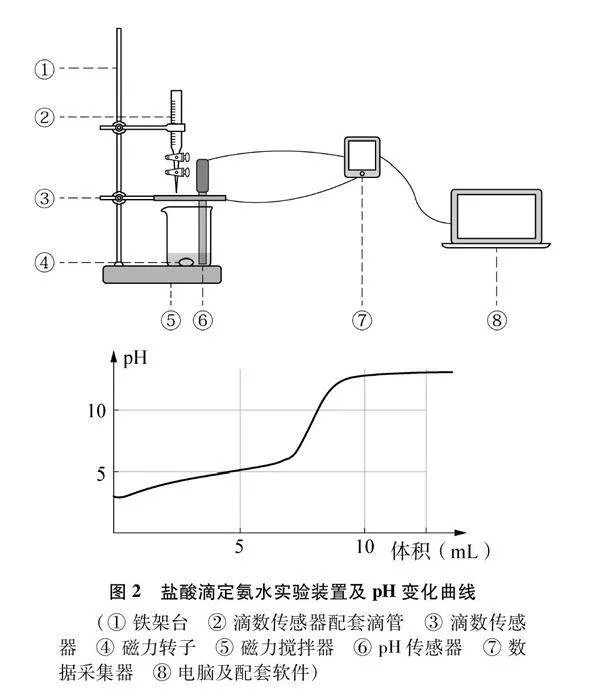
[實驗1]鹽酸滴定氨水:0.1000mol·L-1HCl溶液滴定20.00mL 0.1000mol·L-1 NH3·H2O溶液,采集溶液pH變化曲線如圖2所示。
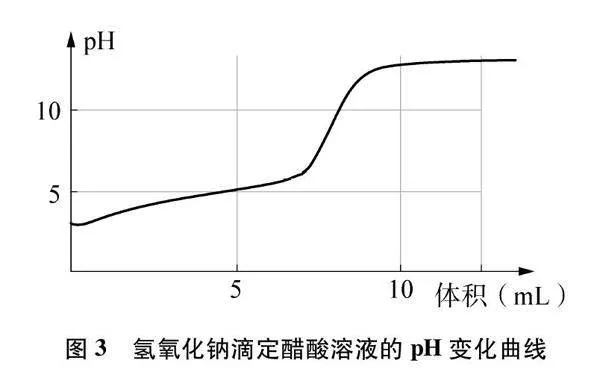
[實驗2]氫氧化鈉滴定醋酸:0.1000mol·L-1 NaOH溶液滴定20.00mL 0.1000mol·L-1CH3COOH溶液,采集溶液pH變化曲線如圖3所示(裝置同圖2)。
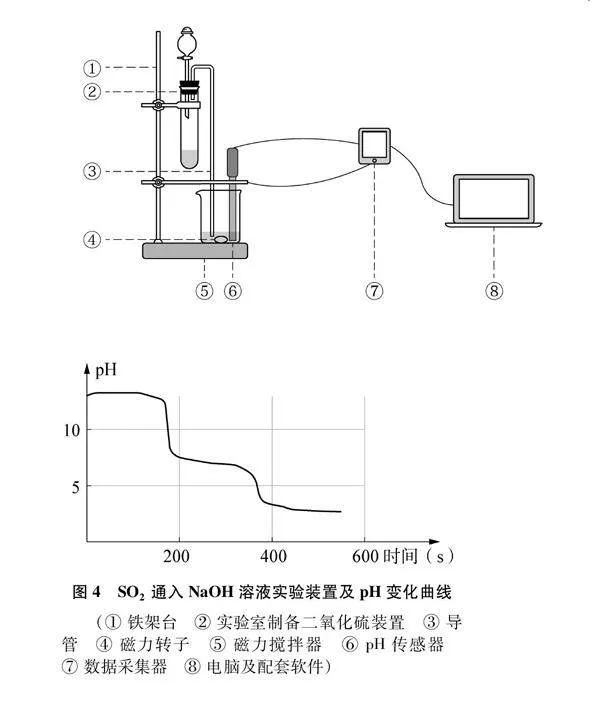
[實驗3]SO2通入氫氧化鈉:SO2氣流持續通入50.00mL 0.1000mol·L-1NaOH溶液中,采集溶液pH變化曲線如圖4所示。
基于實驗3實驗數據選取緩沖溶液,進行數據拓展與分析(裝置見圖4)。
三個實驗是在強酸滴定強堿的基礎上進一步提高難度,選擇了強酸滴定弱堿、強堿滴定弱酸中最具有代表性的兩個實驗以及二元弱酸與強堿反應的實驗。利用實驗1構建真實問題情境,進行知識梳理,使零散知識結構化,幫助學生構建思維模型。基于實驗圖像,對溶液中的微粒種類作微觀分析。通過實驗2的相似變式來診斷學生運用思維模型判斷變化體系中溶質種類與平衡種類的能力。結合實驗3的相異變式設計拓展應用環節。
3 學情分析
高中學生已經建立了初步的微粒觀和平衡觀,了解不同電解質溶液中微粒存在的形式,以及在水溶液中存在弱電解質的電離平衡、含有弱離子鹽類中存在水解平衡等。但是這種微粒觀和平衡觀只是對單一溶液的認識,尚未建立復雜情境下分析水溶液中離子平衡的思路,無法正確判斷混合溶液中存在的平衡是水解還是電離,還是多平衡共存,無法準確分辨“中和”與“中性”的概念。對判斷陌生情境下或較復雜的電解質溶液中粒子濃度關系、分析相關數據對應的意義時感到困難。
學生也形成了一定守恒觀,了解水溶液中的微粒存在物料守恒、電荷守恒和質子守恒。但是尚無法正確寫出相應的守恒式及無法熟練應用電荷守恒與物料守恒關系解決問題。
學生在必修及選擇性必修的學習過程中,曾做過如測定強弱電解質的導電性、測定氫氧化鋇與硫酸反應導電性變化以及測定中和反應pH變化等數字化實驗,對數字化實驗的操作、數據圖像的處理等都有所了解。
4 教學目標
(1) 通過歸納分析數字化滴定曲線,構建“分析溶液組成→確定溶液中的平衡→判斷溶液中微粒”的“水溶液中的離子平衡”分析模型,能識別溶液體系中的微粒種類、微粒濃度大小,發展學生微粒觀。
(2) 通過分析滴定過程溶質和溶液中的離子濃度大小,能應用溶液中的多種平衡來分析問題,診斷并發展學生對兩大守恒的理解和應用。
(3) 通過分析及繪制圖像,運用數字化實驗進行驗證,診斷并發展學生對溶液反應過程水溶液中微粒種類和濃度變化的理解。
5 教學流程
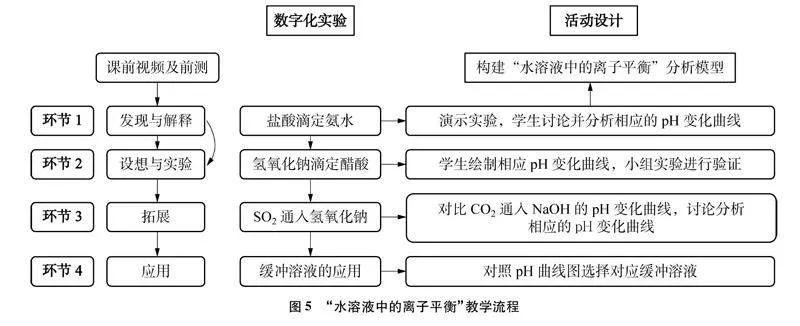
利用數字化實驗數據能直觀展示水溶液中離子的變化,在教學中利用數字化實驗數據的分析過程培養學生的核心素養。本文結合IDEO模型設計課前活動和課中四個活動環節,充分利用數字化實驗數據及圖像來構建“水溶液中的離子平衡”復習課,教學流程如圖5所示。
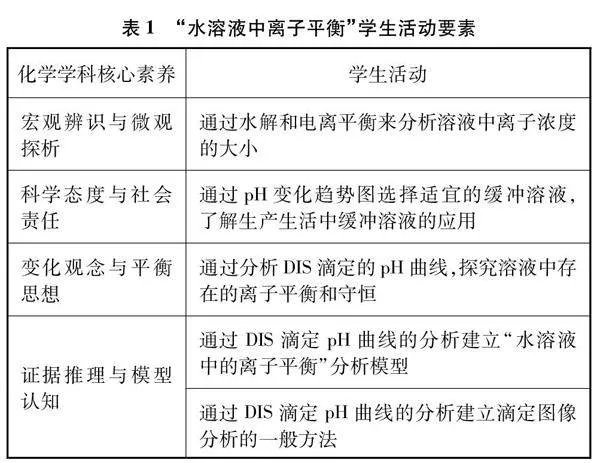
數字化實驗教學提供了化學反應原理課程的載體和實踐的工具,發展了學生宏觀辨識與微觀探析、科學態度與社會責任、證據推理與模型認知、科學探究與創新意識等核心素養,具體分析見表1。
6 教學過程
學生課前完成“水溶液中的離子平衡”微課視頻學習和相關練習。
6.1 環節1:發現與解釋
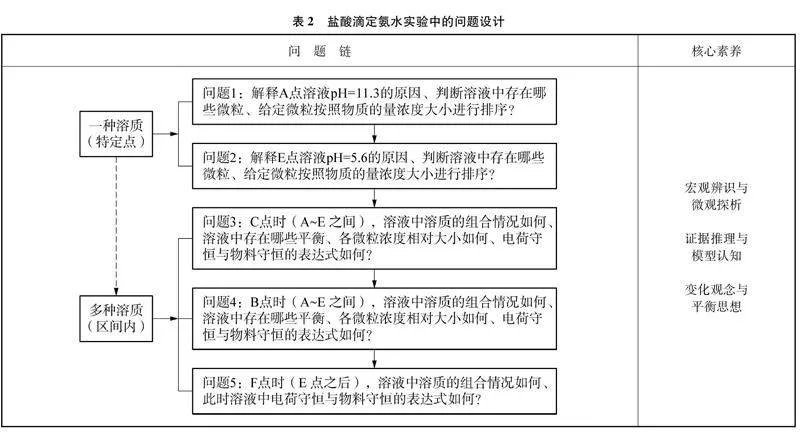
學生課堂完成數字化實驗:鹽酸滴定氨水溶液,觀察溶液pH曲線變化趨勢(圖2)。根據該實驗溶液pH變化的理論曲線(圖6),構建問題鏈幫助學生構建“水溶液中的離子平衡”分析模型,具體見表2。
設計意圖:分析曲線所代表的溶液酸堿性的走勢,讓學生感受反應過程中的“變化”。從特殊點A切入圖像的分析討論,依照由易到難、循序漸進的順序分析變化曲線中的四個重要節點(A、 C、 E、 F四點)與二個重要區間(AE、 EF區間)。
利用數字化實驗構建真實問題情境,基于實驗圖像對溶液中的微粒種類作微觀分析。由簡到繁鋪設臺階,幫助學生實現從對簡單溶液中平衡的自主分析,到對復雜溶液中多平衡體系的綜合分析的進階。教師通過問題鏈的設計,幫助學生理解溶液中粒子濃度的變化,建立復雜水溶液的“水溶液中的離子平衡”分析模型,提升用微粒觀的視角認識和解決化學問題的能力。
6.2 環節2:設想與實驗
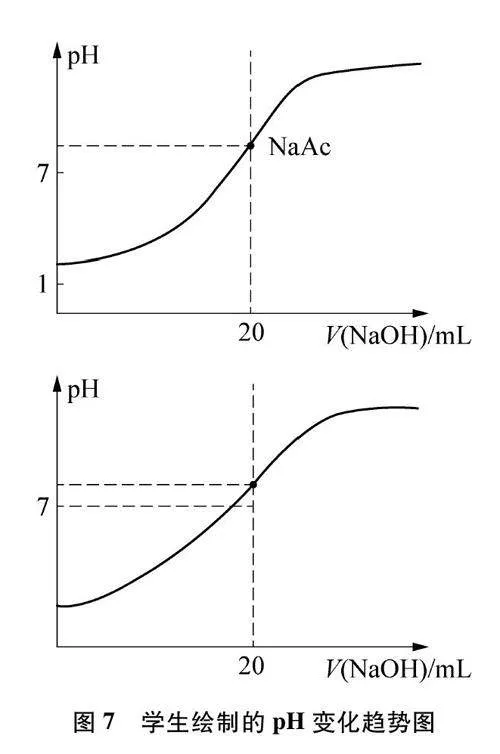
學生通過實驗繪制氫氧化鈉滴定醋酸溶液的pH變化圖(圖7),解釋氫氧化鈉滴定醋酸溶液的pH變化趨勢,對假設預測、實驗方案、實驗結論進行完整論證。
小組實驗完成氫氧化鈉滴定醋酸溶液的數字化實驗,驗證繪制圖像的正確性,并完成如下練習:根據pH變化曲線對滴加NaOH溶液至10mL時溶液中的離子濃度進行大小排序,并書寫相應的電荷守恒與物料守恒的表達式。
設計意圖:通過實驗2的相似變式設計新的情境,運用“水溶液中的離子平衡”分析模型予以解釋,并用已構建的分析模型對NaOH滴定醋酸這一真實問題進行理論分析。通過學生繪制實驗2滴定過程中溶液pH變化趨勢圖,診斷學生運用模型判斷變化體系中溶質種類與平衡種類的能力,發展學生“宏觀辨識與微觀探析”的化學學科核心素養,強化解決問題的基本思路。結合學生繪制的pH變化趨勢圖和分析過程完成對學生學習效果的評價,最后通過學生實驗2進行驗證,發展學生“證據推理與模型認知”的化學學科核心素養。
6.3 環節3:拓展
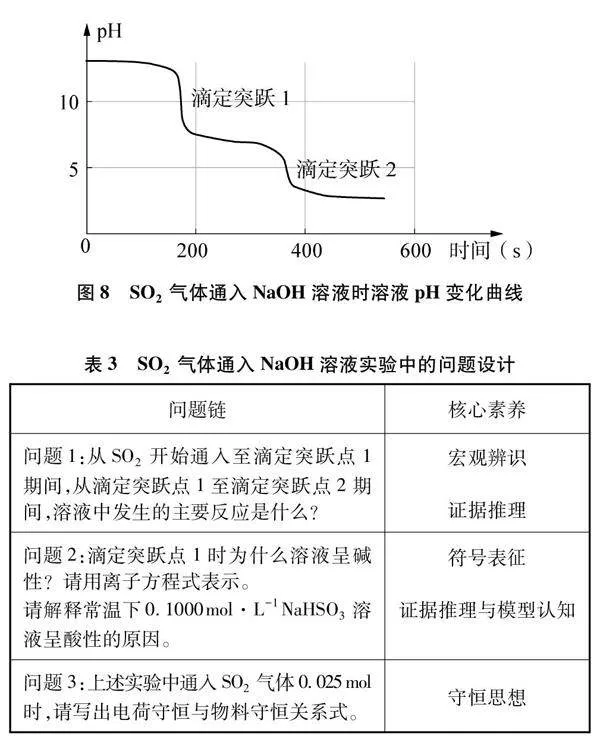
在SO2氣流持續通入NaOH溶液演示實驗的基礎上,學生根據采集到的溶液pH的變化曲線(圖8),判斷滴定過程中發生的化學反應、反應過程中溶質的變化情況、溶液中微粒濃度的變化情況等,完成下列問題(見表3)。
設計意圖:結合實驗3的相異變式設計拓展環節。本實驗安排在兩個滴定實驗之后,學生對實驗圖像中的圖形信息與數字信息已具有一定的理解能力。學生思維起點已有所提升,能夠在提供證據的基礎上進行合理推理和認知學習。借助pH傳感器,學生觀察到圖像中的兩次滴定突躍,運用分析模型分析兩次滴定突躍時溶液的pH大小,梳理溶液中發生的化學反應,判斷反應產物。進而通過比較多元弱酸的酸式鹽溶液中的電離平衡與水解平衡的程度,形成微粒濃度的正確排序。
6.4 環節4:應用
[資料]緩沖溶液滴定曲線的一般特點:會呈現一個平臺階段,即酸堿度變化很小的區域,在該區域內,緩沖溶液能穩定維持在一個確定的pH。
學生結合pH曲線圖選擇對應的緩沖溶液,并學習緩沖溶液在生產生活中的應用,如人體血液中的碳酸氫鹽緩沖體系、磷酸鹽緩沖液等。
設計意圖:基于緩沖溶液的pH變化特點,從pH曲線選擇特定的緩沖溶液,并學習緩沖溶液在生產生活中的應用,培養學生的“科學態度與社會責任”素養。
7 教學效果及反思
研究以自編高三平衡相關試卷作為前測,從高三年級選擇2個班級(共54人)進行教學實踐,其中一個班級為實驗組,另一班級為對照組,所選班級的學生學習水平、學習狀況基本相當。實驗結束后,以自編試題為后測,測定學生對教學內容的掌握程度。
分別對對照組和實驗組的前測和后測成績進行t檢驗。前測t統計量平均值為2.0066,對應概率p=0.6959>0.05,說明在被試樣本中,這兩個樣本在0.05的水平上沒有顯著性差異,說明對照組和實驗組教學前學業成績上沒有顯著性差異。后測t統計量平均值為1.6786,對應概率p=0.0312<0.05,說明這兩個樣本在5%的水平上有顯著性差異。實驗組在完成基于數字化實驗的化學反應原理教學實踐后學業成績上發生了顯著性變化。
具體試題分析中,發現完成基于數字化實驗的化學反應原理教學實踐的學生在圖像題上得分率更高。學生通過觀察曲線和數據,能更加有效地分析水溶液中的離子平衡,更準確地分析出溶液中占據主導地位的平衡。
為進一步了解學生對數字化教學的感受,筆者又對學生進行了問卷調查[11]。關于“通過數字化實驗數據的分析是否更有效地理解水溶液中的離子平衡”滿分為5分的數值型問題(下同),平均得分為4.75分,68.3%的學生給了滿分,3分及以上比例超過96.7%,說明學生對數字化實驗的教學比較認可。“通過繪制滴定曲線相較于問題是否可以提升學習體驗感”的問題,平均分為4.25分,學生較一般測試習題,更加喜歡繪圖等豐富的形式來增加學習體驗感和參與度。但是從問卷中也發現相較于數字化實驗,學生更喜歡現象比較明顯的化學實驗。
數字化實驗創設了大量的真實情境,結合緩沖溶液的學習,讓學生了解到化學反應原理在日常生產生活中的應用。在教學過程中,學生進行深度體驗,更好地從離子平衡的角度認識電解質及其水溶液,提高分析解決實際問題的能力,發展學生的高階思維。
通過分析數字化實驗的數據和圖像,幫助學生形成水溶液多平衡體系的分析模型。在師生對話與討論分析中,教師診斷學生的思維發展程度,突破學生的思維發展障礙并引導學生利用數字化實驗數據的內在邏輯構建分析模型。當換成二氧化硫與氫氧化鈉反應時,學生能應用“水溶液中的離子平衡”模型來分析實驗數據和解決化學問題,說明學生已形成復雜水溶液體系的分析思路,認知結構得到較大發展。
參考文獻:
[1][2][10]中華人民共和國教育部制定. 普通高中化學課程標準(2017年版2020年修訂)[S]. 北京: 人民教育出版社, 2020: 2,72.
[3]王祖浩. 以實驗創新研究促進學生學科核心素養的發展——《實驗化學》教科書內容建構及學科特色探索[J]. 全球教育展望, 2019, (11): 12~14.
[4][5]周洪. 高中物理DIS實驗與落實物理學科核心素養的融合和沖突[J]. 考試周刊, 2019, (71): 146~149.
2V3EH4T3IvKEfSKwZq2680F+GgYJnud5K+Sa4eti1hk=[6]劉作志, 萬勇. 國外數字化實驗教學研究的回顧與展望——基于VOSviewer可視化分析[J]. 中小學數字化教學, 2022, (6): 6~8.
[7]Xiantong Y, Mengmeng Z, Xin S, et al. Regional Educational Equity: A Survey On The Ability to Design Scientific Experiments of Sixth-Grade Students [J]. Journal of Baltic Science Education, 2019, (6): 12~15.
[8]楊先通, 王強. 基于DIIEE模型培養創造性思維的化學課堂教學設計——以“水的凈化”為例[J]. 化學教學, 2021, (7): 5~7.
[9]胡小勇, 朱龍. 面向創造力培養的設計思維模型與案例[J]. 現代遠程教育研究, 2018, (3): 8~10.
[11]薛耀鋒. 上海市中學數字化實驗教學現狀抽樣調查與分析[J]. 中國電化教育, 2013, (1): 88~93.

